贵紫麦1号紫粒性状的遗传规律及基因定位
2021-09-23董亚兵彭亚姝徐如宏钱小康任明见
董亚兵, 何 方, 彭亚姝, 徐如宏, 钱小康, 任明见
(1.贵州大学农学院/国家小麦改良中心贵州分中心, 贵阳 550025;2.遵义市农业农村局, 贵州 遵义 563000)
紫色小麦是一类花青素在种皮中累积而表现出紫色、紫红色、紫黑色等的小麦品种[1]。研究表明,花青素能够抗氧化、抗衰老及抑制心脑血管疾病的发生[2-5]等。紫色小麦富含花青素,作为特殊种质资源具有较大的开发和利用价值[6]。
紫粒小麦的种子因花青素的存在使种皮颜色呈现紫色[7]。种皮是由母体组织发育而来,所以母本基因型决定其紫粒色素,紫粒色素基因呈现母性遗传且由细胞核基因控制[8]。国内外对紫色小麦的紫粒性状遗传研究存在多种观点,李楠楠[9]研究表明,紫粒性状的遗传受一对显性基因或两对显性互补基因控制,并具有剂量效应。钱小康[10]、黄碧光[11]、孙群等[12]研究表明,紫粒性状分别受两对不完全显性互补基因、重复基因、两个相互独立基因和三个基因控制。紫色小麦的紫粒性状遗传复杂性受遗传背景和环境条件的影响。不同紫色小麦材料之间,紫粒性状的遗传特性具有较大的差异[13-15]。
通过全基因组水平上扫描并检测与重要性状相关的基因序列差异和结构变异可进行遗传进化分析[16-17],也可利用多态性差异开发新分子标记对重要性状基因进行精细定位及候选基因预测[18]。集团分离分析法(Bulked Segregation Analysis,BSA)通过一对亲本重组交换得到的分离群体中选取一定数量的植株,对目标基因的不同表型进行鉴别,形成两个亚群体或群体[19]。将每组等量的DNA混合形成两个相对性状的基因库,选择合适的分子标记对两个基因库进行分析,将两组之间显示多态性的分子标记与目标性状的基因进行连接[20-22]。孙磊[23]基于群体基因组重测序开发的SNP标记构建了高密度遗传图谱,并进行了葡萄果实颜色QTL定位,结合转录组测序从QTL定位区间筛选到多个候选基因,并对个别候选基因进行了初步功能验证。曾伟伟[24]采用全基因组重测序技术开发分子标记,对小麦茎秆发育调控基因qd1进行精细定位和克隆,将小麦茎秆发育调控基因qd1定在4 B染色体上,其遗传距离为0.29 cM。刘书林等[25]采用集团分离分析法(BSA)结合全基因组重测序结果开发新标记,将目的基因定位在4号染色体上。
贵紫麦1号是2015年通过贵州省农作物品种审定委员会审定的紫粒小麦品种(黔审麦2015003)。本研究通过常规遗传分析方法与全基因组重测序技术结合集团分离分析策略进行紫粒性状的遗传规律和基因定位研究,为紫色小麦紫粒性状目的基因的克隆、遗传转化及功能验证提供参考。
1 材料与方法
1.1 供试材料
本研究所用材料贵紫麦1号(黔审麦2015003)(紫粒)、贵农19号(黔审麦2007004)、贵农麦30号(黔审麦2015002),均由贵州大学农学院国家小麦改良中心贵州分中心自主选育并提供。
1.2 遗传群体构建
贵紫麦1号分别与白粒小麦品种贵农19号、贵农麦30号进行正反交获得F1代。将收获的F1代单株进行套袋自交获得F2代群体,同时开展回交获得BC1F1群体。并采用单籽粒传法将F2代群体通过加代自交获得F3、F4、F5代群体。于2021年3月分蘖后期对F5代单株进行挂牌编号,剪取叶片,采用CTAB法提取DNA置于-80 ℃冰箱保存备用。
1.3 遗传规律分析
利用色选机将F1、F2~F5及BC1F1各世代群体根据籽粒颜色进行区分和登记。统计F1、F2、F3、BC1F1群体各个组合紫粒和白粒的比例,分析紫粒基因的遗传规律。
1.4 开发标记及群体验证
根据F5代群体粒色深浅将群体划分为极紫、深紫、中紫、浅紫、浅色、白色等6个等级。在贵紫麦1号和贵农麦30号杂交组合中,从6个粒色类群中分别选取极紫和白色单株各30株,采用DNA基因组试剂盒提取DNA。将DNA进行等量混合构建紫、白两个极端混池,将混池和双亲DNA提供给深圳华大基因股份有限公司进行全基因组重测序检测。
基于重测序检测结果共开发出517对InDel标记,分子标记全部由上海生物工程股份有限公司合成。将517对分子标记在混池及双亲中进行检测,获得特异性标记。利用特异性标记在定位研究群体中进行验证。研究群体中的DNA提取参照彭琴等[26]等改良的CTAB法进行基因组提取。PCR反应体系见表1。
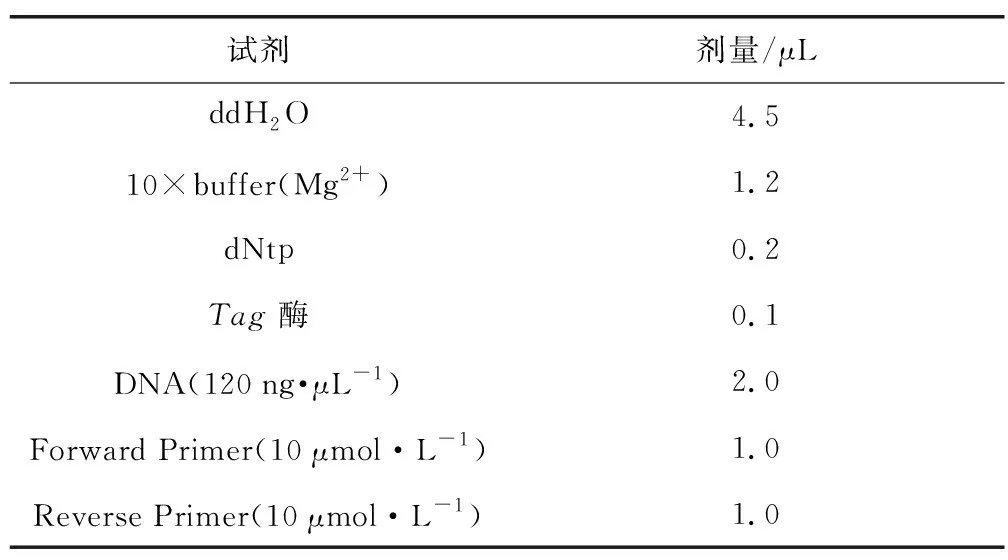
表1 10 μL PCR反应体系
PCR反应条件:94 ℃预变性4 min,94 ℃变性45 s,退火温度依引物设计而定,退火50 s,72 ℃延伸45 s,其中变性、退火、延伸3个步骤共35个循环,72 ℃延伸10 min,最后4 ℃保存。PCR扩增产物采用10%的非变性聚丙烯凝胶电泳,通过银染显影后在白炽灯下进行拍照保存,统计扩增条带。
2 结果与分析
2.1 世代群体紫粒性状的表现
利用贵紫麦1号与贵农19号、贵农麦30号,通过组配正反交组合(贵紫麦1号×贵农麦30号、贵农麦30号×贵紫麦1号;贵紫麦1号×贵农19号、贵农19号×贵紫麦1号)以构建正反交F1、F2、F3和BC1F1代群体。分别对各世代群体籽粒的颜色性状进行鉴定与统计(表2)。

表2 杂交后代群体籽粒颜色性状的表现
由表2可知,F1代籽粒的颜色与母本相同,F2世代籽粒的颜色均表现为浅紫色,F3世代籽粒颜色发生分离。通过F1代与紫粒亲本回交,后代籽粒颜色均为紫色;F1代与白粒亲本回交,后代籽粒颜色发生分离现象。结果表明,贵紫麦1号的紫粒性状由显性基因控制。
2.2 贵紫麦1号与贵农麦30号杂交后代群体籽粒颜色的分析
利用贵紫麦1号与白粒小麦贵农麦30号进行正反交,鉴定并统计其正反交F3及回交群体的籽粒颜色。通过卡方检验分析紫粒与白粒的分离比例(表3)。
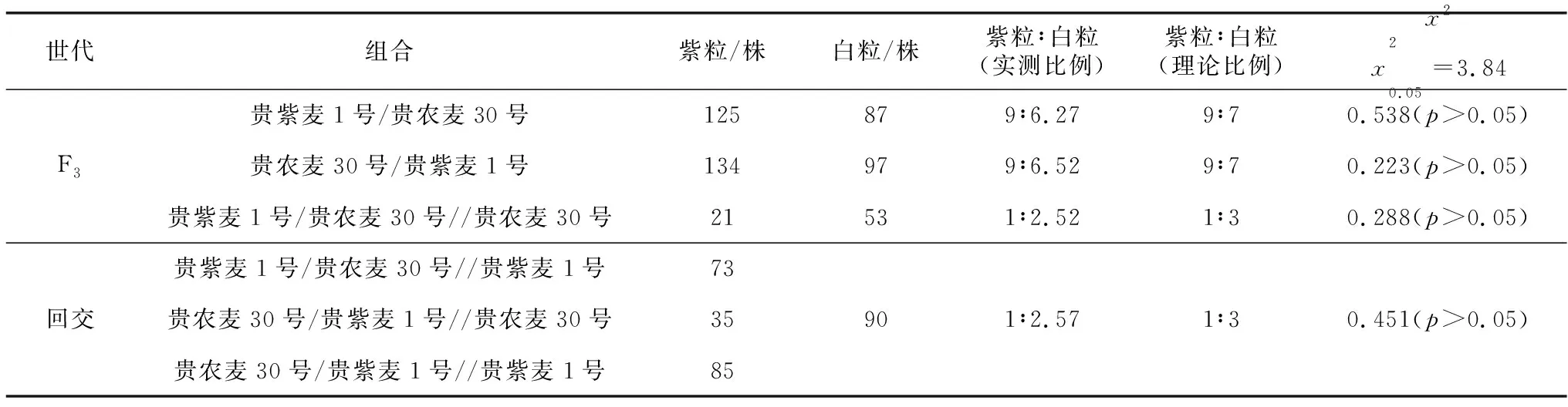
表3 贵紫麦1号与贵农麦30号杂交后代群体籽粒颜色的分离情况
由表3可知,群体中紫粒与白粒的分离比例符合1∶3;F3群体中紫粒与白粒的分离比例符合9∶7。F1代与白粒亲本回交,后代群体籽粒颜色发生分离现象,紫粒与白粒的分离比例均符合1∶3;F1代与紫粒亲本回交,后代群体籽粒颜色均表现为紫色。正反交F3世代中紫粒与白粒的分离比例均符合9∶7,表明贵紫麦1号的紫粒性状受两对显性互补基因控制。
2.3 贵紫麦1号与贵农19号杂交后代群体籽粒颜色的分析
利用贵紫麦1号与贵农19号进行正反交,鉴定并统计其正反交F3世代及回交群体的籽粒颜色。通过卡方检验分析紫粒与白粒的分离比例(表4)。
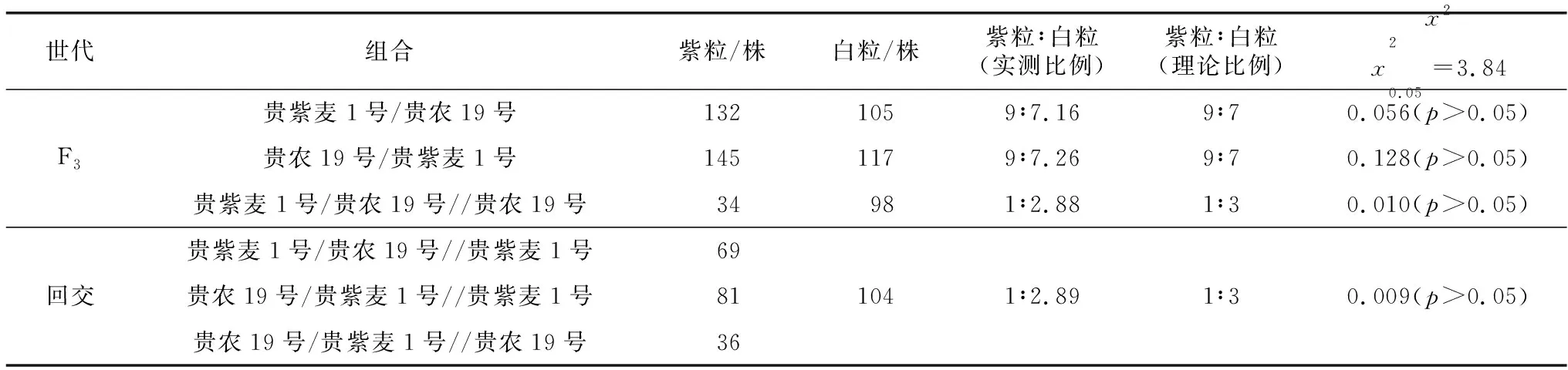
表4 贵紫麦1号与贵农19号杂交后代群体籽粒颜色的分离情况
由表4可知,群体中紫粒与白粒的分离比例符合1∶3;F3群体中紫粒与白粒的分离比例符合9∶7。F1与白粒亲本回交,后代群体籽粒颜色发生分离现象,紫粒与白粒的分离比例均符合1∶3;F1与紫粒亲本回交,后代群体籽粒颜色均表现为紫色。正反交F3世代中紫粒与白粒的分离比例均符合9∶7,表明贵紫麦1号的紫粒性状受两对显性互补基因控制。
2.4 紫粒性状基因的遗传模式
根据贵紫麦1号与白粒小麦(贵农19号或贵农麦30号)杂交后代群体籽粒颜色的分离情况分析,贵紫麦1号的紫粒性状由两对显性的互补基因控制。当两对显性基因共同存在时,贵紫麦1号的籽粒颜色方表现为紫色,当仅有一对显性基因或为双纯和隐性基因时,籽粒颜色为白色。假设紫粒小麦品种贵紫麦1号的基因型为AABB,白粒小麦品种贵农麦30号和贵农19号的基因型为aabb,其遗传模式见图1。
2.5 紫粒基因定位及群体验证
2.5.1重测序结果分析
采用全基因组重测序技术分别对紫、白两个混池及其亲本进行全基因组检测。经数据处理分析表现差异的InDel共有123 086个,通过数据过滤处理发现,表现出差异的InDel共有16 465个,将表现出差异的InDel整合至21条染色体上(图2)。大量差异InDel位点分布在2 A、6 A、1 B、2 B、3 B、5 B、6 B、7 B和7 D等9条染色体上,以上9条染色体中的InDel约占总InDel数量的67%。结果表明,贵紫麦1号的紫粒基因很可能存在于这9条染色体上。
为探究贵紫麦1号紫粒基因确切位置,需进一步分析这9条染色体上的InDel分布密度,再根据InDel的数量及密度判定贵紫麦1号紫粒基因的所在位置。基于重测序数据分析,染色体2 A和7 D中的InDel较于染色体6 A、1 B、2 B、3 B、5 B、6 B和7 B相对集中分布(图3),可初步判定贵紫麦1号的紫粒基因存在于2 A和7 D染色体上,其物理区间分别为673~698 Mb和581~601 Mb。
2.5.2多态性标记筛选及群体验证
将517对InDel标记在紫白混池和双亲中进行多态性检测,在2 A和7 D两条染色体共获得多态性标记39对,其中2 A染色体包括chr 2 A 26、chr 2 A 25、chr 2 A 37、chr 2 A 28、chr 2 A 34、chr 2 A 32、chr 2 A 16、chr 2 A 20、chr 2 A 1、chr 2 A 2、chr 2 A 27、chr 2 A 38、PP 1、PP 2、2 A 5、2 A 8、2 A 296、DY-2 A 5、DY-2 A 6和DY-2 A 7等20对多态性标记;7 D染色体包括chr 7 D 5、chr 7 D 6、chr 7 D 15、chr 7 D 14、chr 7 D 19、chr 7 D 43、chr 7 D 25、chr 7 D 48、chr 7 D 20、chr 7 D 7、chr 7 D 12、chr 7 D 24、chr 7 D 35、chr 7 D 37、chr 7 D 33、DY-7 D 1、DY-7 D 6、DY-7 D 8和DY-7 D 10等19对多态性标记。
利用JoinMap 4.0软件对分离群体的紫粒性状和分子标记的分离数据进行连锁计算,获取其遗传距离。遗传连锁图谱采用MapChat 4.0软件进行绘制。结果表明,控制贵紫麦1号紫粒性状的一对显性基因存在于2 AL和7 DL染色体上。2 A染色体中的紫粒基因GZMPp1与标记chr 2 A 32的遗传距离为1.2 cM。7 D染色体上的紫粒基因GZMPp2与标记DY-7 D 6的遗传距为0.5 cM。
2.6 候选基因功能注释
根据基因定位结果,在定位区间内进行候选基因查询。对每个基因的分子功能进行鉴定。在2 AL染色体的定位区间内共找到2个与花青素合成途径相关的功能注释基因,基因功能注释为bHLH protein。在7 DL染色体定位区间内共找到5个与花青素合成途径相关的功能注释基因,基因功能注释为MYB-related transcription factor。运用NCBI网站将两条染色体上的7条候选基因进行查询均与花青素合成代谢相关。

表5 贵紫麦1号定位区间内候选基因功能注释
3 讨 论
本研究以贵紫麦1号(紫粒)分别与贵农19号和贵农麦30号(白粒)进行正反交及回交。通过对籽粒颜色统计,以紫粒小麦为母本与白粒小麦杂交,其F1世代籽粒颜色为紫色;以白粒小麦为母本与紫粒小麦杂交,其F1世代籽粒的颜色为白色,因此,F1世代籽粒的颜色始终与母本一致。F2世代籽粒的颜色均为浅紫色。结果表明,贵紫麦1号的紫粒性状在种皮中表现,种皮是由珠被发育而来。因此,种皮颜色的表达由上一代植株的基因型控制且紫粒性状表现为显性。关于紫色小麦的紫粒性状遗传规律国内很早便展开了研究,欧俊梅等[27]在紫粒小麦漯珍1号的研究中,经过卡方测验,F2群体中紫粒与白粒的分离比例符合9∶7,而F1代与白粒亲本回交后紫粒与白粒的分离比为1∶3,结果表明,漯珍1号品种的紫粒性状是由两个完全显性的基因共同决定。徐丙元[28]在紫粒小麦漯珍1号的研究中发现,漯珍1号的紫粒性状同样由两个完全显性的基因独立决定。针对贵紫麦1号在F3代中籽粒颜色发生分离现象研究中,结果表明,贵紫麦1号的紫粒性状由两对显性互补基因控制,当两个显性基因共同存在时,贵紫麦1号的籽粒颜色表现为紫色,当只有一个显性基因或纯隐形基因时,籽粒颜色为白色。表明,两显性基因间存在相互作用的结果。不同来源的紫粒小麦研究结果与本研究结果一致[29]。也有研究表明,不同来源的紫粒小麦的紫粒性状是由一个完全显性基因决定的[30-31]。毕婵,尤明山[17]在紫粒小麦的研究中发现,紫麦农大3753的籽粒颜色为显性单基因控制,且将紫粒基因定位在7 D染色体上[32]。综上表明,其原因极有可能是不同生长环境的影响,紫粒小麦种皮中花色素的合成不仅受遗传物质的控制,而且还会受到光照和温度等环境因素的影响[33-35]。环境因素通过影响花青素的积累,从而影响紫粒小麦紫粒颜色的表型,干扰了研究者对紫粒性状的观察统计,从而导致不同的研究结果[36]。
基于全基因组重测序及特异性标记检测结果,将控制贵紫麦1号紫粒性状的两个互补显性基因分别位于2 AL和7 DL染色体上。根据基因定位结果,在2 AL和7 DL染色体定位区间内共找到7个与花青素合成途径相关的功能注释基因[37-38],基因功能注释为bHLH protein和MYB-related transcription factor[39]。王伟伟等[40]、叶广继等[41]研究发现,bHLH和MYB转录因子均可调控花青素的合成代谢。经过NCBI查询7个候选基因位置与重测序候选物理区间重叠,表明控制贵紫麦1号紫粒基因在这7个候选基因内。
