红螯光壳螯虾Hsp70基因的特征及其在热应激下的表达
2021-09-18姚成杰刘佳珺林振烔王艺磊
姚成杰,刘佳珺,林振烔,王艺磊
(集美大学水产学院,福建省水产生物育种与健康养殖工程研究中心,福建 厦门 361021)
0 引言
红螯光壳螯虾(Cheraxquadricarinatus),原产于澳大利亚,属于甲壳纲(Crustacea)十足目(Decapoda)拟河虾科(Parastacidae),为我国20世纪90年代引进的淡水虾类。由于食性广、生长快、肉质细嫩、味道鲜美、营养丰富,深受养殖户和消费者的喜爱[1]。已有研究表明,导致养殖生物免疫抗病能力降低的主要原因是环境因子变化[2]。其中,水温作为影响虾蟹等甲壳类动物生存最重要的环境因子之一,不仅直接影响其代谢、生长、蜕壳和存活等[3-5],而且还会影响盐度、溶氧量等环境因子。
热休克蛋白(heat shock protein,HSP)是一类高度保守的细胞蛋白家族[6]。按分子质量大小可分为HSP110、HSP90、HSP70、HSP60及小分子HSP和泛素等6个家族[7]。其在环境胁迫因子(高温、重金属和微生物感染等)刺激下表达量显著升高[8-10]。HSP70是HSP家族蛋白中含量最多的热应激蛋白,该蛋白广泛存在于动植物和微生物中,并扮演着“守卫者”的角色,其功能主要是参与和调控蛋白质的折叠修饰[11],在应激等不利条件下,提高细胞的抵抗力,起到应激保护作用。研究表明,HSP70可通过降解异常蛋白促进蛋白的正确重折叠而在应对热胁迫时发挥重要调节作用[12-13]。
研究热应激本质及HSPs的作用机理,对于动物生产和繁殖有着非常深远的现实意义。近年来,水生动物体在热应激过程中HSPs的表达变化相继被报道,例如有西伯利亚鲟(Acipenserbaeri)[14]、虹鳟(Oncorhynchusmykiss)[15]、银鲫(Carassiusauratusgibelio)[16]。相较于克氏原螯虾(Procambarusclarkia)[17]和锯缘青蟹(Scyllaserrata)[18]等水生无脊椎动物,红螯光壳螯虾的相关研究较少。
本实验以红螯光壳螯虾为研究对象,在NCBI上获取Hsp70(KR058821.1)基因序列的基础上,分析其结构特征,研究其在高温应激下鳃、肝胰腺和血淋巴中的表达变化,以期为研究红螯光壳螯虾热应激过程中的生理机制奠定基础,有助于螯虾养殖者理解热应激的生理变化、评估热应激的不利影响并做好热应激预防。
1 材料与方法
1.1 材料
红螯光壳螯虾取自厦门市纪雄水产有限公司,体长(13.03±0.43)cm,体重(80.69±0.56)g,于本实验室28 ℃的淡水养殖缸中暂养7 d后用于实验。
1.2 实验方法
1.2.1 高温应激实验
对照组以红螯光壳螯虾生长温度(26~30 ℃)的中间温度(28 ℃)进行实验,高温组设定为34 ℃和36 ℃。观察到红螯光壳螯虾的生长状况为:28 ℃下20尾虾生长均良好,活力较好;34℃应激下,20尾虾在初始一段时间反应大,躲避反应较为频繁,24 h之后活力有所恢复,48 h有30%的虾死亡;36 ℃应激下,20尾虾在24 h内全部死亡。根据数据统计及活力观察,最终确定以34 ℃进行高温应激实验。
将28 ℃下暂养的红螯光壳螯虾分为2组,分别设为对照组和实验组。对照组水温为28 ℃,于0 h 取样。实验组水温为34 ℃,于6 h、12 h、48 h和72 h取样。每个时间点各取6尾虾,共24尾。每尾虾取其血细胞、鳃和肝胰腺,放入RNA later溶液后保存于-80 ℃超低温冰箱中,用于RNA的提取。
1.2.2 热休克及免疫相关基因定量引物设计
本实验所用的Hsp70基因和内参基因β-actin定量引物通过Primer 5.0软件设计,所有引物依托厦门铂瑞生物科技有限公司合成。各引物及其序列如表1所示。
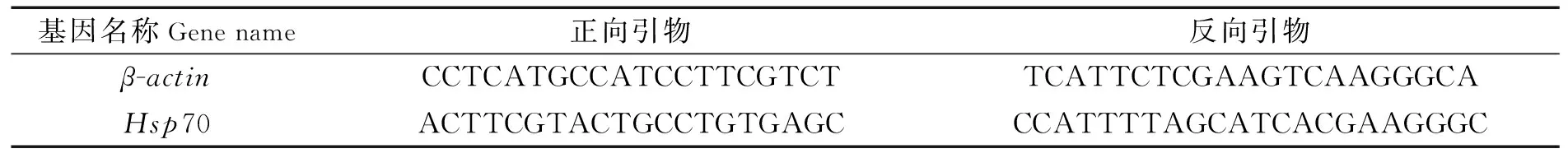
表1 实时定量PCR引物序列
1.2.3 总RNA的提取及cDNA模板制备
用EastepTMSuper总RNA试剂盒提取红螯光壳螯虾鳃、肝胰腺和血淋巴3个组织5个时相(对照组0 h;实验组6,12,48,72 h)的RNA,利用紫外分光光度计和1%(质量分数)琼脂糖凝胶电泳来验证RNA的质量及完整性。采用Promega公司提供的M-MLV酶进行逆转录,制备定量用cDNA模板。
1.2.4 目的基因的生物信息学分析
用Compute pI/Mw tool(http://www.expasy.org/tools/pi_tool.html)预测等电点和分子质量;用NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)查找磷酸化位点;采用SignalP 5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)寻找信号肽;用BioEdit软件(http://www.mbio.ncsu.edu/BioEdit/bioedit.html)进行序列多重比较;用MEGA X软件(http://www.megasoftware.net/)中的邻接法构建系统进化树。
1.2.5 实时定量PCR体系及条件
以红螯光壳螯虾的β-actin作为内参基因,以逆转录获得的cDNA第一条链为模板。反应体系如下:cDNA模板4.5 μL,SYBR Green Real-time PCR Master Mix 5 μL,正/反向定量引物各0.25 μL。包括对照组在内的5个时相,每个时相做6个样品。PCR反应条件:95 ℃变性15s,60℃退火1 min,40个循环。
数据分析:根据仪器自动给出样品的RQ值(即2-△△Ct,其中△CT=“样品目的基因的CT值”减“内参基因β-actin的CT值”,△△CT=“每一个样品的△CT值”减“基准样品的△CT值”),记录下RQ值。用RQ的平均值±标准误(mean±standard error,M±SE)表示基因表达水平。
使用SPSS 20.0统计软件对数据进行t-检验和单因素方差分析,以P<0.05为显著水平,P<0.01为极显著水平。
2 结果
2.1 CqHsp70序列分析
红螯光壳螯虾CqHsp70基因Genbank数据库登录号为KR058821.1。其核苷酸序列及推导的氨基酸序列见图1。CqHsp70的开放阅读框(open reading frame,ORF)1932 bp,编码氨基酸643个。使用Compute pI/Mw tool预测得到理论等电点为5.27,分子质量为70.3 ku,5’ UTR 37 bp,3’ UTR 549 bp。该序列预测含有32个丝氨酸(Ser)磷酸化位点,39个苏氨酸(Thr)磷酸化位点和12个酪氨酸(Tyr)磷酸化位点。此外,4—598aa为HSP70结构域,序列中并没有发现信号肽。

2.2 序列多重比对
多重比对发现HSP70在不同物种中保守性高(见图2)。比对中所用的物种和氨基酸序列信息见表2。
2.3 HSP70的系统进化树构建
从NCBI数据库中获取了16个不同物种的HSP70氨基酸序列(见表2)。使用MEGA X软件分析HSP70的进化树。根据构建后得到的HSP70进化树可见:HSP70主要分为脊椎动物和无脊椎动物两支,脊椎动物分支中包含哺乳动物和鱼类,无脊椎动物分支中包括虾蟹类和贝类等。红螯光壳螯虾HSP70与美洲螯龙虾(Homarusamericanus)、锯缘青蟹(Scyllaserrata)及三疣梭子蟹(Portunustrituberculatus)等虾蟹类的HSP70聚为一支,其与美洲螯龙虾一致性最高,达到99%。
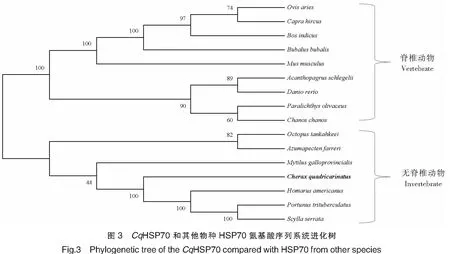
表2 HSP70的物种名称和GenBank登录号
2.4 CqHsp70在热应激下的表达
采用实时荧光定量PCR方法,对红螯光壳螯虾在34 ℃高温应激下的鳃、肝胰腺和血细胞中的CqHsp70基因表达量进行分析。结果表明:红螯光壳螯虾鳃中CqHsp70基因表达量在6 h时最低,与对照组差异不显著;12 h时该基因表达量最高,与对照组形成极显著差异(P<0.01);之后回落至正常水平(见图4a)。
在34 ℃高温应激下,红螯光壳螯虾肝胰腺中CqHsp70基因表达量变化趋势与鳃相同。6 h时,该基因的表达量与对照组差异不显著;12 h时该基因表达量最高,与对照组形成显著差异(P<0.05);48 h时已回复正常表达水平(见图4b)。
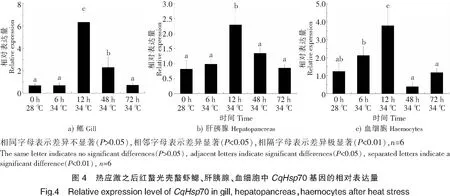
在34 ℃高温应激下,红螯光壳螯虾血细胞中CqHsp70基因表达量在6 h时已开始上升,但与对照组没有显著性差异;12 h时该基因表达量最高,与对照组形成极显著差异;48 h之后表达量与对照组差异不显著,已恢复至正常水平(见图4c)。
3 讨论
3.1 CqHsp70基因的结构特征
HSP70家族在进化上是高度保守的,是目前研究最深入的HSP之一,适量HSP70的存在对维持动物正常生长发育是必需的,在提高细胞对应激的耐受性及维护细胞自稳等方面具有重要的生物学作用[19]。红螯光壳螯虾CqHsp70的cDNA全长2231 bp,5’ UTR 37 bp,3’ UTR 549 bp,可编码643个氨基酸,4—598aa为HSP70结构域。CqHsp70预测含有83个磷酸化位点,序列含有39个丝氨酸(Ser)磷酸化位点,32个苏氨酸(Thr)磷酸化位点和12个酪氨酸(Tyr)磷酸化位点。在序列中没有发现信号肽,与拟穴青蟹(Scyllaparamamosain)的HSP70分析结果一致[20]。HSP70结构域可再分为三个结构域,N端两个结构域(ATP酶结构域和底物结合结构域)和C端结构域,且具有谷氨酸—谷氨酸—缬氨酸—天冬氨酸(EEVD)的末端特征序列[21]。多重序列比较结果显示,红螯光壳螯虾HSP70与其他物种蛋白序列在N端ATP酶结构域和底物肽结合结构域相似性很高,在C端结构域保守性有所降低,这符合HSP70的保守性和结构特征[22]。
HSP70在动物中广泛存在。进化树分析结果表明,HSP70分为两大支,一大支由脊椎动物组成,一大支由无脊椎动物组成,与其进化地位较一致。红螯光壳螯虾的CqHSP70与虾蟹类的HSP70聚为一支,且相似度较高,并与美洲螯龙虾的HSP70相似性最高,这表明HSP70蛋白在甲壳动物中高度保守。
3.2 CqHsp70基因的表达
热应激是指当环境温度超过动物舒适温度(产热最低点与蒸发散热急剧增加起始点之间的温度)时,动物体为保护其正常的代谢作用和各种生理机制所必须做出的各种反应的总和[6]。生物体在正常生理条件下有少量的热休克蛋白存在且表达量低,其表达量在受到热应激后会被强烈诱导[23]。
作为一种重要的内源性细胞保护因子,HSP70具有修复应激给机体带来损害的功能[24]。在大多数的器官中,应激诱导的HSP70是热休克蛋白中重要成员之一,当受到热应激诱导之后其表达量会增加[25]。对大西洋无眼裂缝虾(Rimicarisexoculata)转录组分析结果表明,两个Hsp70亚型基因表达量在热应激后分别增加261倍和154倍[26]。拟穴青蟹(Scyllaparamamosain)的Hsp70基因表达量在热应激后显著提高[27]。另外,甲壳类动物在热应激后,Hsp70表达量的升高对保护机体起着重要作用。研究表明,短期高温暂养斑节对虾(Penaeusmonodon)可增加Hsp70的表达,减少鳃相关病毒的复制[28]。非致死热休克诱导凡纳滨对虾(Penaeusvannamei)Hsp70的合成,促进其对热、氨和金属的耐受性[29]。而采用RNAi技术敲除Hsp70,会降低方斑卤虫(Artemiafranciscana)幼体对热和细菌感染的耐受性[30]。
本实验选择鳃、肝胰腺和血液这三个虾蟹重要免疫器官对Hsp70基因表达量变化进行分析,实时定量PCR结果表明,CqHsp70基因在红螯光壳螯虾的鳃、肝胰腺、血细胞中均有表达。尤其是在血细胞中表达水平最高,其次是在肝胰腺中,而在鳃中表达水平最低。这说明红螯光壳螯虾血细胞是CqHsp70发挥其抗应激作用的重要部位。
高温应激初始阶段(6 h内),红螯光壳螯虾血细胞中CqHsp70基因表达上调,这可能是因为血细胞中的CqHsp70基因作为重要细胞保护因子较早发挥作用。随着应激时间的延长,血细胞、肝胰腺和鳃中的CqHsp70基因的表达在12 h达到高峰。说明此时CqHsp70在应激防御中起着不可替代的重要作用,也说明高温应激后的12 h是红螯光壳螯虾调控热应激的关键点,在夏天高温季节的养殖过程中应特别加以注意。
