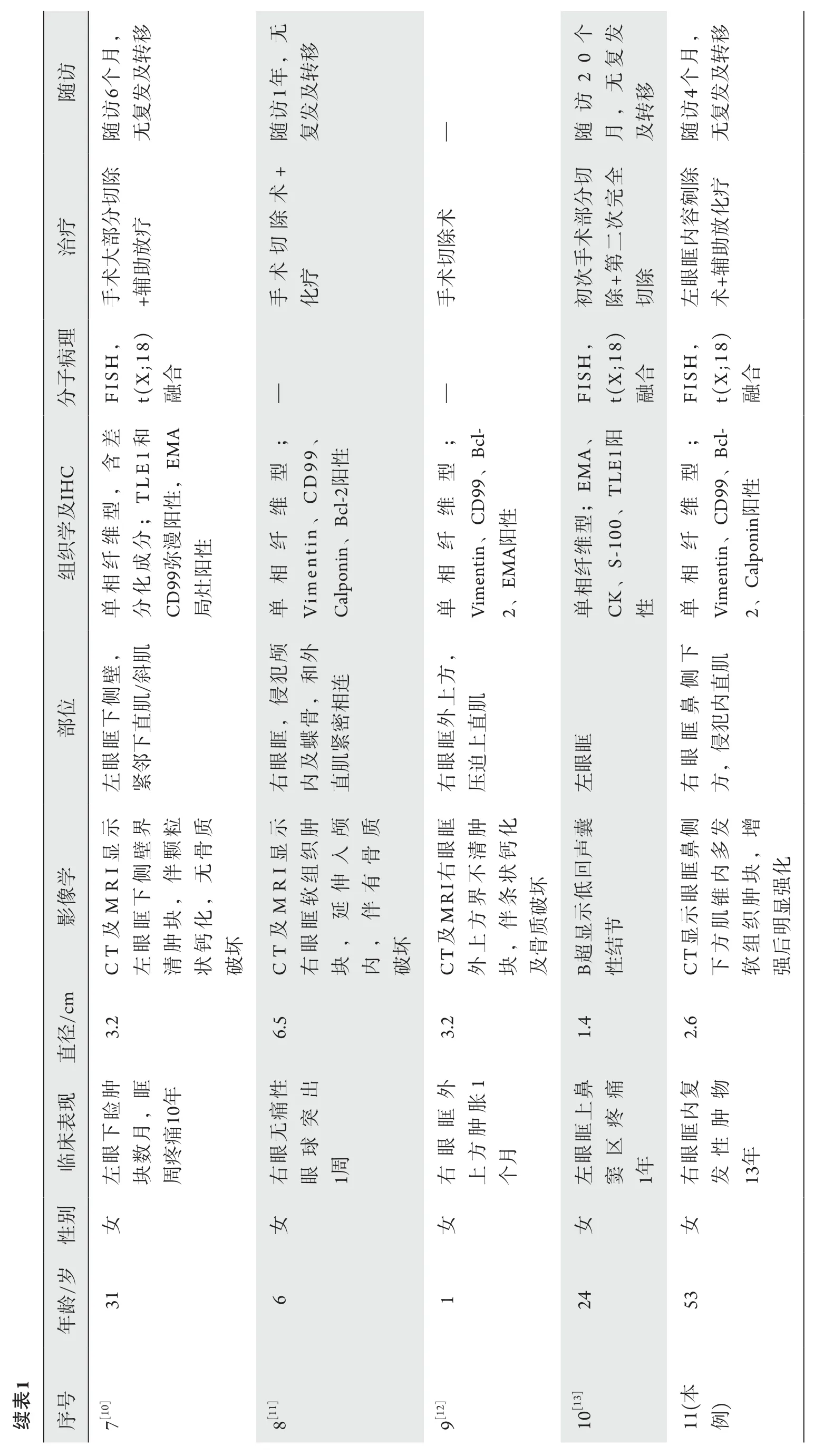
眼眶原发性滑膜肉瘤的临床病理学观察
2021-09-18孙慧叶敏蔡蓉蓉孙骥毕颖文
孙慧*,叶敏*,蔡蓉蓉,孙骥,毕颖文
(复旦大学附属眼耳鼻喉科医院病理科,上海 200031)
滑膜肉瘤(synovial sarcoma,SS)是一种具有独特遗传学特征并向间叶组织和上皮双相分化的恶性肿瘤,约占所有软组织肉瘤的10%,占所有恶性肿瘤的1%,最常发生于大关节周围的软组织[1-2]。SS最常见的发病年龄为15~40岁,30%的病例在20岁以下,以男性多见,好发于下肢及头颈部[2]。SS最初是因其频繁出现在大关节周围的软组织而得名,但是严格意义上来讲该肿瘤并非来源于滑膜组织,而是起源于多潜能干细胞,并向间叶组织和上皮分化,故滑膜肉瘤的命名是一种错用名称,但是其在日常临床及诊断过程中已经成为习惯性的用法,若再采用新的诊断名词会引起一定的误解,故SS的命名一直沿用至今[3]。
头颈部滑膜肉瘤较常见,但发生于眼眶的滑膜肉瘤十分罕见,文献中均为个案报道[4-13]。对复旦大学附属眼耳鼻喉科医院眼科收治1例原发于右眼眶的复发性滑膜肉瘤的患者,与研究[4-13]中报道的其他10例眼眶SS进行回顾总结,分析眼眶原发性滑膜肉瘤的临床病理学和分子遗传学特征。
1 对象与方法
1.1 对象
收集复旦大学附属眼耳鼻喉科医院眼科2020年10月收治的1例右眼眶SS病例的临床病理资料,同时回顾性总结文献[4-13]中已发表的10例眼眶原发性SS的临床病理资料,包括患者的临床病史、诊疗经过、影像学检查、治疗方式、组织病理形态、免疫组织化学表现、分子病理检测结果及随访资料。复旦大学附属眼耳鼻喉科医院1例SS患者的全部切片经由3位不了解临床病史的病理科医师复核、确诊,且研究获得患者的知情同意。
1.2 HE 染色及免疫组织化学染色方法
手术切除标本常规经10%中性甲醛液固定,常规脱水,石蜡包埋,4 μm切片,HE染色。免疫组织化学染色使用罗氏诊断产品(上海)有限公司的Ventana Ultra全自动免疫组织化学仪器,采用EnVision二步法,并设立阴性、阳性对照。所用抗体试剂波形蛋白(Vimentin)、Calpolnin、CD99、Bcl-2、INI-1、广谱细胞角蛋白(pan-cytokeratin,CKpan)、上皮细胞膜抗原(epithelial membrane antigen,EMA)、CD34、平滑肌肌动蛋白(smooth muscle actin,SMA)、MyoD1、S100蛋白及Ki-67均购自基因科技有限公司和福州迈新生物技术开发有限公司。具体操作步骤按照说明书进行。
1.3 荧光原位杂交方法及判读标准
采用美国雅培公司LSISS 18 双色分离探针(Vysis,Abbott Laboratories Inc)检测SS18基因的易位情况,根据HE切片定位选取范围为4 mm×4 mm肿瘤组织区域,具体实验步骤按试剂盒说明书进行。观察使用Nikon niu(日本)荧光显微镜。
判读标准:1)观察肿瘤细胞内信号时,将组织切片分为4个象限,每个象限选取50个肿瘤细胞核边界完整、孤立无重叠、杂交信号清晰的细胞核。2)红色信号和绿色信号之间的距离大于等于单个信号直径的2倍时,视为分离信号;红色信号和绿色信号之间的距离小于单个信号直径的2倍或者存在黄色信号,视为融合信号。如果1个细胞核中存在1对融合信号与1对分离信号,1对融合信号和单个红色信号,或者1对融合信号和单个绿色信号,则为SS18基因易位阳性细胞。3)计算SS中SS18基因易位的阳性细胞百分率。
2 结果
2.1 临床特征
患者,女,53岁。2007年患者无明显诱因首次发现右眼鼻下方肿物,边界不清,活动性差,在当地医院行手术切除肿物,术后病理诊断为滑膜肉瘤(单相纤维型);2009年患者因肿物复发再次于当地医院行手术切除术,术后辅以放射治疗(具体不详),患者将此次手术标本病理切片携带至复旦大学附属肿瘤医院病理科会诊,会诊结果为滑膜肉瘤(单相纤维型)。2014年患者因右眼球突出伴视力下降于外院就诊,外院行手术切除肿物;2016年患者因复发性右眼球突出伴视力下降及眶周疼痛于外院手术治疗;2018年患者再次因右眼球突出伴鼻下方肿物于外院进行手术治疗;外院术后病理诊断均为滑膜肉瘤(单相纤维型)。
2020年10月自觉原手术部位肿物再次复发(第6次发病),为求进一步诊治,遂来复旦大学附属眼耳鼻喉科医院就诊。入院检查:全身情况尚可。眼部检查:右眼视力0.12,矫正不提高;左眼1.0。右眼压16 mmHg(1 mmHg=0.133kPa),左眼压16 mmHg。右眼眶内侧结膜下见一最大径1 cm质嫩、红色肿物(图1A),边界不清,活动度差,右眼球突出伴各方位运动受限。右眼睑不能完全闭合;右眼结膜轻度充血,角膜透明,前房深浅可,瞳孔圆,对光反应迟钝,晶状体核性混浊,玻璃体少量絮状混浊,视网膜及视乳头窥不清。左眼检查无异常。既往史:因右眼眶肿物多次复发,行5次“眼眶肿物摘除”,1次放疗(具体不详);高血压病史4年,药物控制可。辅助检查:眼眶CT(图1B):右眼眶鼻侧下方肌锥内多发软组织增生团块,较大者最大径约2.6 cm,平扫呈等密度,增强后病灶明显不均匀强化,病灶形态不规则,边界不清,部分包绕眼球下部,侵犯内直肌、下眼睑,局部与视神经分界欠清,右眼球受压前突下移,眶窝扩大。拟诊:右眼眶肿物,于2020年10月28日全麻下行右眼眶内容物剜除术。
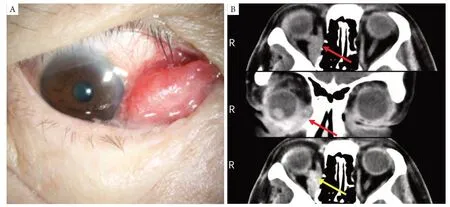
图1 右眼眶鼻侧下方滑膜肉瘤患者的术前临床及影像学特征Figure 1 Preoperative image and radiographic features of synovial sarcoma on the lower nasal right orbit
将目前文献中已发表的10例眼眶SS和我院的1例眼眶SS(表1)的临床病理学特点进行总结,其中男2例,女9例,左眼6例,右眼5例;眼眶SS患者发病年龄为1~53岁,平均年龄22岁,中位年龄24岁[4-13]。本组总结的病例中,术前病程范围较广,从1周到13年,11例中5例症状至少出现3年以上,通常在肿瘤发生多年后出现临床症状而就诊,患者可表现为进行性眼球突出伴移位及运动受限,视力下降,神经受累者可引起疼痛及感觉异常。
2.2 肉眼观察
送检眶内容标本大小4.5 cm × 4 cm × 4 cm,皮肤范围3.8 cm × 1.7 cm,眼球大小2.4 cm × 2.4 cm ×2.3 cm,于眶内容鼻侧见一不规则肿物,大小2.7 cm ×2.4 cm ×1.2 cm,切面灰红、灰褐色,实性,质地较细腻;另见灰黄、灰褐色碎组织,大小2.5 cm ×2.4 cm ×1 cm。
2.3 组织学检查
送检标本显微镜下见(图2):低倍镜下,肿瘤由弥漫分布的单一的梭形细胞组成(图2A),肿瘤细胞密集排列呈短条束和旋涡状,部分区可见狭长的裂隙状血管。高倍镜下,梭形细胞异型性明显,胞质少并呈弱嗜酸性,核呈梭形或者卵圆形,核分裂可见(图2B),间质含有较少的胶原纤维。肿瘤侵犯结膜下、巩膜表面(图2C)、视神经鞘膜、眶内肌肉(图2D)及纤维脂肪组织。本文报道的该例SS镜下仅见梭形细胞区域,广泛取材且多次切片后未见明显上皮样和差分化区域,符合单相纤维型。

图2 右眼眶鼻侧下方滑膜肉瘤患者的组织学特点Figure 2 Histologic section of the synovial sarcoma on the lower nasal right orbit
总结目前文献中已发表的10例和本组的1例眼眶SS(表1),其中眼眶SS以单相纤维型为主(单相纤维型7例,双相型4例),单相纤维型中有2例存在分化差的成分[4-13]。
2.4 免疫组织化学染色及荧光原位杂交
免疫组织化学检查(图3)提示肿瘤细胞弥漫表达Vimentin、Calpolnin、CD99、Bcl-2;INI-1核呈部分阳/弱阳;CKpan、EMA、CD34、SMA、MyoD1和S100均阴性;Ki-67阳性指数10%。
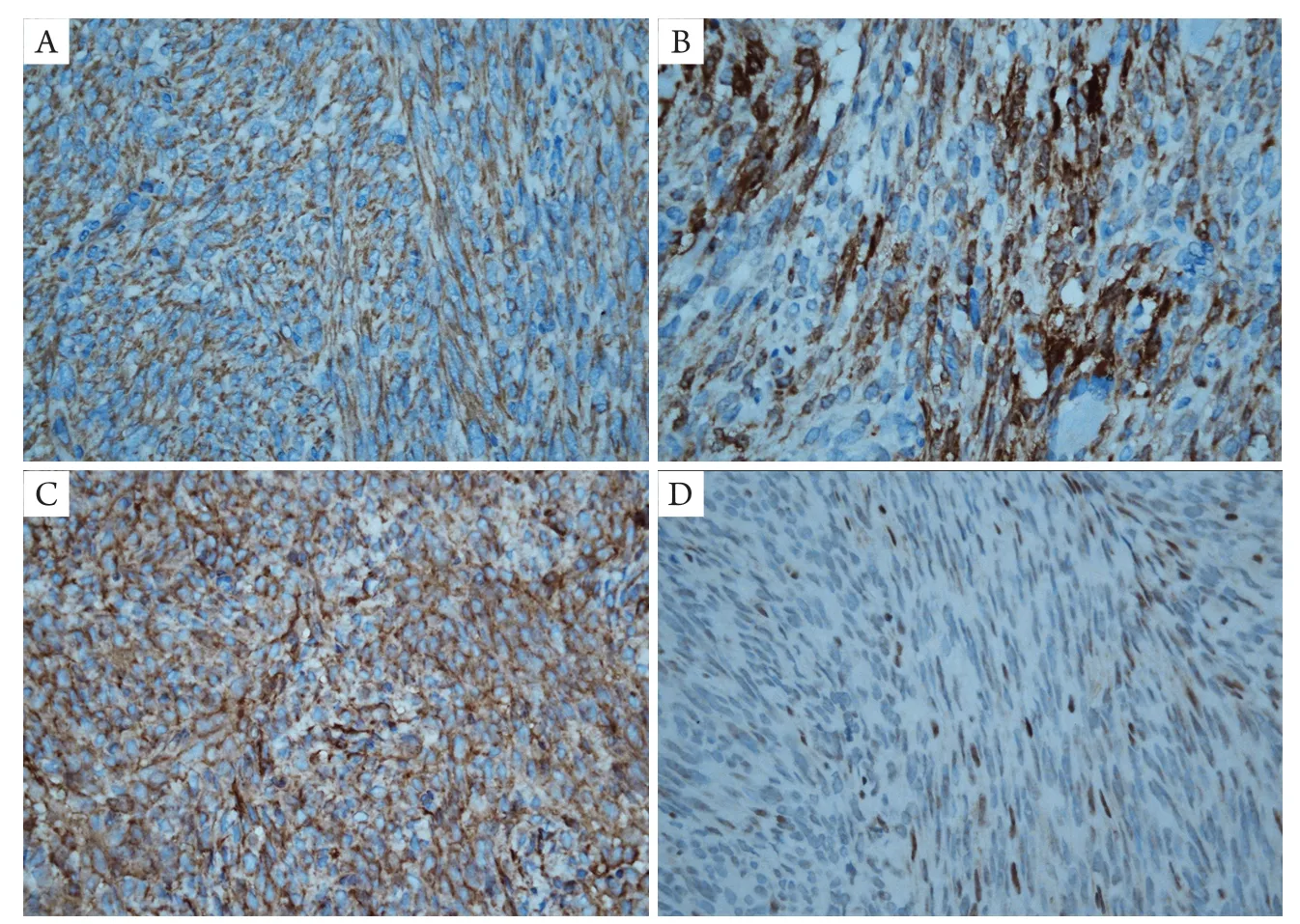
图3 右眼鼻侧下方滑膜肉瘤患者免疫组织化学染色特征(IHC,×400)Figure 3 Immunohistochemical stains of the patients with synovial sarcoma on the lower nasal right orbit (IHC,×400)
荧光原位杂交(fluorescence in situ hybridization,FISH)检测:荧光显微镜下计数200个肿瘤细胞,>50%的肿瘤细胞内可见红绿分离信号,即有SS18基因易位(图4)。从而进一步证实我院报道的该例肿瘤具有特征性的t(x:18)(p11;q11)染色体易位,导致SS18(SYT)-SSX融合基因的产生,符合滑膜肉瘤的诊断。
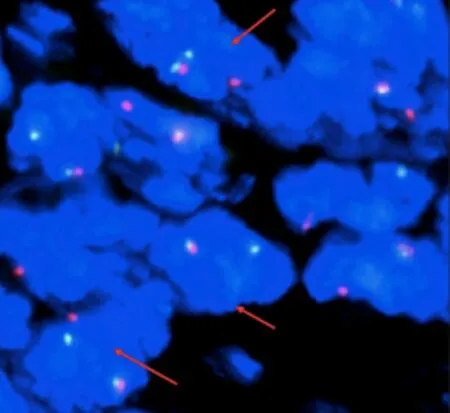
图4 FISH法检测到SS18分离信号(箭头所示)Figure 4 SS18 separation signal (arrows) detected by FISH
2.5 病理诊断及随访
(右眼眶)滑膜肉瘤(单相纤维型)。随访4个月,未见肿瘤局部复发及远处转移。
3 讨论
SS 是一种具有间叶和上皮双相分化的恶性肿瘤,在细胞遗传学上具有特异性的t(X;18)(p11;q11),并产生SS18(SYT)-SSX融合性基因[2]。SS好发于15~40岁的青少年,中位年龄为30岁,也可发生于10岁以下的儿童,男性多见[14]。SS病变部位广泛,大部分发生于四肢大关节附近,也可发生于身体内无滑膜的部位,如心包、肺、肾和头颈部等[2]。头颈部SS由Jernstrom[15]在1954年首次报道。既往研究[16]显示:头颈部SS尚常见,约占所有SS的3%~10%,年轻男性患者多见,临床上多表现为锥体旁口咽部和喉部的软组织肿块,也可出现声音嘶哑及吞咽困难。眼眶部位SS罕见,且均为个案报道,我们总结的共11例眼眶SS患者中年轻女性患者多见(男:女=2:9),与其他部位相比,该性别优势的具体原因不清楚,可能是由于病例数目较少,不一定具有统计学意义,也可能需要更多的大样本研究进行报道。本组病例术前病程范围较广,从1周到13年,11例中5例症状至少出现3年以上,可能由于早期肿瘤生长缓慢且位置较深难以发现,通常在肿瘤发生多年后出现临床症状而就诊。
发生于下肢的大关节附近的SS大多与腱鞘、腱膜和滑膜结构紧密相连[17]。根据上述总结的眼眶SS,我们发现其与眼眶直肌和斜肌的腱鞘密切相关。影像学上,眼眶SS与其他部位相似,不具有特征性,多表现为边界欠清晰的卵圆形或分叶状软组织肿物。在CT上,常表现为中等密度的软组织肿块,其内散在分布斑点状、不规则状钙化,增强扫描强化不均匀[7]。MRI扫描可以确定肿块具体部位,病变范围,还可评估肿瘤的侵袭性,如邻近肌肉、骨骼的浸润和淋巴结转移等情况[14]。T1和T2加权像多表现为异质性的中等至高信号强度的肿块,有时因出血坏死出现囊性外观,因此影像学上可能会误诊为良性肿瘤[13]。MRI在T2WI压脂像上瘤体内可见卵圆形稍高结节影或网格状低信号间隔,该特点对滑膜肉瘤的诊断价值重大[18]。本例患者CT检查结果显示:右眼眶肌锥内、眼眶内下方多发软组织肿块,平扫等密度,增强后明显不均匀强化,病灶边界不清,形态不规则,部分包绕眼球下部,并侵犯右侧内直肌、下眼睑,未见明显的骨质破坏。
临床上起病隐匿,多表现为软组织内缓慢生长的肿块,当肿瘤体积较小时,其边界可较清晰,部分病例可呈浸润性生长。眼眶SS大体呈结节状或者分叶状,少数病例可伴有囊性变,直径1~6.5 cm,切面灰红色,部分可呈鱼肉状[4-13]。组织学形态上,SS可分为3种主要的生长模式[9]:1)单相纤维型。最常见,主要由弥漫分布且排列紧密的短梭形细胞组成,瘤细胞也可排列呈人字形、鱼骨样,类似于纤维肉瘤。核分裂像因肿瘤分化程度多少不等,梭形细胞间散在分布的肥大细胞对其诊断具有提示意义;2)单相上皮型。罕见,主要由腺样排列的上皮细胞组成,形态类似于腺癌,经广泛取材切片后,局灶可见梭形细胞区域;3)双相型。最为经典,由比例不等的上皮样细胞和梭形细胞组成;上皮样细胞呈立方形或者高柱状,核呈圆形或者卵圆形,常排列成腺样、巢状及乳头状结构,梭形细胞成分和单相纤维型相似,部分区可见到梭形细胞和上皮样细胞移行。大部分SS中可出现多少不等的差分化区域[9],多表现为小圆形细胞、大圆形细胞或胖梭形细胞,甚至可出现横纹肌样形态。本文总结的11例眼眶SS以单相纤维型为主(单相纤维型7例,双相型4例),单相纤维型中有2例存在分化差的成分[4-13]。
免疫组织化学染色对于SS 的诊断是必要的。大多数SS 中上皮样成分表达上皮标记(CKpan、CK7、CK19)和Vimentin;梭形细胞表达Vimentin、Bcl-2、Calpolnin及可灶性表达上皮标记[3]。此外,62%的病例CD99阳性,30%的病例S-100阳性,CD34、Desmin和SMA阴性,可排除血管源性、肌源性和纤维源性肿瘤[19]。研究[14]显示:TLE1在SS中显示出强而弥漫的核染色,其敏感性高,特异性差。对于一些差分化SS,仅依赖其组织学形态及免疫组织化学染色难以确诊,此时分子病理诊断可发挥重要的作用。遗传学研究[20]表明:90%以上的SS病例具有t(x:18)(p11;q11),即位于X号染色体上的SSX基因(SSX1、SSX2或SSX4)与位于18号染色体上的SS18基因(或称SYT)发生融合,产生SS18-SSX融合性基因。极少数滑膜肉瘤会出现INI-1弱表达或表达缺失,可能的原因是SYT-SSX复合体的形成间接灭活滑膜肉瘤中的INI-1基因,导致其蛋白水平表达下降甚至缺失[21]。本文报道的1例SS做了SS18分离探针FISH检测,检测到SS18分离信号,即存在SS18基因易位,且免疫组织化学染色INI-1呈部分阳/弱阳。本例为首次描述眼眶SS中INI-1表达的丢失的报道,具有一定的参考价值。
眼眶SS 需要与以下眼眶其他软组织来源的肿瘤相鉴别。1)梭形细胞横纹肌肉瘤(spindle cell rhabdomyosarcoma,SC-RMS)[22]:好发于儿童和青少年。组织学上由条束状排列的细长梭形细胞组成,核呈卵圆形,胞质嗜伊红色,大多数肿瘤内可找见特征性的核偏位的横纹肌母细胞,核分裂像多少和肿瘤细胞异型性根据不同的分化程度而有差异。肿瘤细胞表达Desmin、MSA、MyoD1及Myogenin。(2)孤立性纤维性肿瘤(solitary fibrous tumor,SFT)[23]:多见于中老年患者,组织学上肿瘤边界多较清晰,肿瘤细胞多呈“无结构样模式”生长,也可排列呈血管外皮瘤样结构,肿瘤细胞呈短梭形或卵圆形、核仁不明显、核分裂不多见,其中非典型/恶性SFT的异型性明显,核分裂像易见。免疫组织化学标记CD34、STAT6阳性,CK阴性。3)恶性周围神经鞘膜瘤(malignant peripheral nerve sheath tumor,MPNST)[24]:眼眶较为少见,是一种起源于周围神经或显示神经鞘不同成分分化的梭形细胞肉瘤。MPNST常呈弥漫性生长,由排列紧密、束状增生的梭形细胞组成,部分还可见神经纤维瘤区域,核形态不规则、部分呈逗点状。免疫组织化学染色S-100、SOX-10阳性,约50%的病例失表达H3K27me3。4)纤维肉瘤[25]:眼眶较少见,可发生于任何年龄,但多发生于儿童。镜下见梭形细胞排列呈人字状、鱼骨样及条束状,肿瘤细胞密集,核细长,两端尖细,肿瘤细胞间见多少不等的胶原纤维。免疫组织化学染色显示Vimentin阳性,不表达Calpolnin、CD99及Bcl-2。此外,滑膜肉瘤中FISH检测SS18基因易位可有效鉴别。5)梭形细胞癌[26]:眼眶部位罕见,是一种既含有癌成分又含有肉瘤样成分的恶性肿瘤。组织学上梭形细胞成分排列呈束状或者不规则形,细胞质丰富,嗜酸性,部分伴间变,核分裂易见,但是没有明确的骨、软骨及横纹肌肉瘤等异源性成分;上皮样细胞呈多边形、卵圆形,排列呈花边状、腺样或者见鳞状细胞癌成分,并可见上皮样和肉瘤样成分移行区域。免疫组织化学肿瘤细胞Vimentin和CK均有不同程度的表达,不表达CD99及Bcl-2,FISH检测无SS18基因易位。
SS 治疗目前主要以外科手术切除为主,辅以放化疗,大多数学者认为手术切缘和肿瘤大小是影响预后的关键因素[27]。Fayda等[28]认为放化疗是治疗头颈部SS 的较好选择。化疗通常是儿童SS的主要治疗方法,因儿童SS对化疗具有更高的敏感性,通常选择异环磷酰胺和阿霉素联合使用[10]。放射疗法可以改善大多数患者生存率[29]。肿瘤小于5 cm且位于年轻患者四肢的SS患者(<10岁)通常有更好的预后[30]。非肢端滑膜肉瘤的预后通常比肢体滑膜肉瘤的预后差,头颈部SS复发率高达70%,其可能是由于肿瘤无包膜、解剖位置复杂导致难以完整切除,广泛切除肿瘤可能会导致功能障碍,甚至死亡[17]。转移发生于近50%患者中,成年人更常见,最常见的转移部位是肺,淋巴结和骨髓,也可转移至眼眶[14]。但是头颈部SS中淋巴结转移率较低,除非存在明显的淋巴结肿大,否则不建议进行颈淋巴结清扫术[27]。由于文献中报道的眼眶SS较少,且多为个例,随访资料不足,难以进一步明确其预后情况。本例患者从2007年至2020年因肿物多次复发行5次“眼眶肿物摘除”,并在2009年行1次放疗,病情无明显好转,于2020年10月28日全身麻醉下行右眼眶内容物剜除术,术后辅以放化疗,随访4个月,未见肿瘤局部复发及远处转移。
滑膜肉瘤是一种罕见的软组织肿瘤,通常发生于四肢,头颈SS较常见,但是眼眶SS比较少见,诊断需要将临床影像学检查、组织病理学及分子病理学特点进行结合,同时也需要排除其他软组织来源的眼眶恶性肿瘤。眼眶SS 手术风险较大,预后较差,术后放化疗有助于延长生存时间。
志谢
复旦大学附属肿瘤医院病理科朱雄增教授对本例SS病例诊断提供了重要的帮助与支持。
