蜂毒肽与单组分脂膜相互作用的单分子研究*
2021-09-17王康徐成吴晋锋杨恺元冰
王康 徐成 吴晋锋 杨恺 元冰
(苏州大学物理科学与技术学院, 软凝聚态物理及交叉研究中心, 苏州 215006)
近年来, 单分子追踪技术的出现和发展为研究细胞膜界面生物学过程提供了一条新的途径, 然而细胞膜内生物分子运动的异质性特征使得从大量分子轨迹中区分和分离不同的分子运动模式变得非常困难, 迫切需要发展简单易行的分析方法.本文以蜂毒肽和单组分平板支撑脂膜的相互作用体系为例, 发展了一种利用单分子运动位移标准差的频数分布来区分和分离不同运动模式脂分子的数据分析方法, 提供了比传统基于位移或回旋半径频数分布的分析方法更高的准确度和更多的定量信息.利用该方法成功分离得到了脂分子在平板膜内的快慢两种运动状态, 并发现其分布情况部分相符于脂分子在上下叶的位置分布; 在不同浓度蜂毒肽的表面吸附或跨膜成孔作用的影响下, 这两部分脂分子的运动受到了不同的干扰.本文针对生物膜体系内分子运动的复杂异质性特征发展了一种实现分子运动模式分离的数据分析方法, 并利用此方法获得了蜂毒肽破膜成孔的不同阶段对脂膜上下叶的不同影响.该方法的开发将对利用单分子追踪技术研究生物体系动力学过程有重要帮助.
1 引 言
近年来的诸多研究表明, 细胞膜不仅是隔绝细胞内外环境的屏障, 还与细胞生物功能的实现紧密相关.诸如配体-受体的识别和吸附、离子的跨膜输运、病毒对细胞的感染、以及天然抗菌肽的破膜杀菌等许多复杂的生物反应都发生在细胞膜界面系统中.因此, 深入理解细胞膜界面的性质对于认识和调控细胞的生物功能具有重要意义[1].
蜂毒肽与细胞膜的相互作用是一类典型的细胞膜界面相互作用系统.蜂毒肽是最具代表性的抗菌肽种类之一, 包含26个氨基酸, 带6个正电荷.根据目前普遍接受的观点, 蜂毒肽与细胞膜的相互作用过程大致遵循“两态”模型[1−4]: 当吸附到膜表面后, 蜂毒肽会由原本的无规卷曲变为α螺旋结构; 当达到某一临界浓度, 这些吸附的多肽会进一步插入膜中, 形成跨膜孔和导致物质泄漏.对于蜂毒肽与细胞膜的相互作用, 其研究方法主要集中在静态表象的研究, 例如核磁共振成像、单层巨囊泡泄露检验等[5,6].例如, 我们曾经结合共聚焦荧光成像技术和分子动力学模拟, 揭示了蜂毒肽在跨膜成孔过程中的“细胞膜对称性破缺”模型[2,5].研究发现, 蜂毒肽在膜表面的吸附和聚集会导致脂膜的变形和外叶脂分子的抽离, 由此带来的脂膜对称性破缺会降低多肽分子跨膜插入的自由能势垒并促使“花冠型”跨膜孔的形成.近年来单分子追踪技术的发展使得从单分子运动学的角度来揭示抗菌肽与细胞膜相互作用的更多分子细节成为可能[7−9].最近我们对蜂毒肽与脂膜作用过程中单个多肽的三维运动进行实时追踪, 发现蜂毒肽跨膜过程中会形成U型多肽构象, 并存在两种不同插膜深度的亚稳态, 位置分别位于脂膜上叶的头尾界面处以及下叶的头尾界面处; 而单个磷脂分子的运动分析结果也揭示了多肽形成花冠型膜孔的动力学特性[10].然而, 这方面的研究尚处于起步阶段, 还存在许多困难.一方面, 在细胞膜界面体系中组分分子会具有多种复杂的状态以完成不同的生物功能, 例如细胞膜上脂筏的形成会导致不同区域内脂分子运动的异质性, 膜蛋白在发挥其生物功能与未发挥生物功能时处于两种不同的运动状态等[11,12].另一方面, 单分子追踪实验往往需要对大量数据(例如同一实验参数下获得几百甚至上千条分子轨迹)进行复杂的数据处理[13].因此, 如何从这些复杂的运动学数据中准确提取出不同的运动状态并进行深入研究对于理解细胞膜界面体系非常重要.
本文以蜂毒肽与细胞膜相互作用过程为例, 针对细胞膜内脂分子运动环境的复杂性, 提出了一种新的分子运动轨迹数据处理方法, 用于准确区分大量单分子运动轨迹中所包含的不同运动状态, 从而避免了由于不同运动状态相互耦合而可能导致的多肽-膜相互作用过程的错误信息.最终, 基于对不同浓度蜂毒肽作用下磷脂分子运动情况的研究, 从单分子运动学的角度阐释了蜂毒肽对脂膜上下叶的影响及其浓度依赖性质.
2 实验方法与模型
2.1 实验材料
磷脂分子1, 2-dioleoyl-sn-glycero-3-phosphocholine (DOPC)、荧光标记的磷脂分子1, 2-dipalmitoyl-snglycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) (Rh-PE)、以及孔径为100 nm的聚碳酸酯膜皆购于Avanti Polar Lipids.蜂毒肽购于南京杰肽生物科技有限公司.碘化钾(KI)、硫代硫酸钠(Na2S2O3)购于Sigma Aldrich.磷酸缓冲液(PBS)购于BioSharp.
2.2 样品制备
支撑磷脂双层膜以囊泡融合法制备: 向DOPC中混合入0.1%摩尔比的Rh-PE之后以氯仿溶液充分溶解(2.0 mg/mL), 随后利用氮气流吹干氯仿并真空干燥2 h以上, 以确保氯仿完全挥发.加入一定体积的PBS溶液(0.2 mg/mL), 在200 W的功率下超声45 min, 使其重新水化为囊泡, 随后使用孔径为100 nm的聚碳酸酯膜挤压21次得到尺寸均匀的小囊泡分散液.将小囊泡溶液转移至进行过亲水化处理的样品仓中, 室温孵育2 h以上.最后使用1 mL的PBS溶液冲洗三遍以洗去未融合的小囊泡, 即可获得荧光标记的支撑磷脂双层膜, 用以进行单分子追踪实验.在原始脂双层膜观察舱内原位加入荧光淬灭剂(100 mmol/L KI,0.1 mmol/L Na2S2O3), 室温孵育15 min后清洗三遍, 即可获得上叶荧光淬灭的脂膜.在原始脂双层膜观察舱内原位加入确定浓度的蜂毒肽溶液(0.5或5.0 mg/mL), 室温孵育30 min后即可获得在不同浓度蜂毒肽影响下的脂膜.
2.3 样品表征
样品的观察采用装有全内反射 (TIRF, 100 × )镜头的荧光显微镜 (IX71; Olympus) 进行, 使用EMCCD (Andor DU-897 U) 采集图片数据, 采集帧率为30 fps.每个实验体系皆进行至少3 次独立重复实验, 每次实验在不同的样品或同一样品的不同区域共计采集6—8 组视频数据.视频采集后, 采用Image J软件MOSAIC 插件对所记录的每一个荧光标记脂质的轨迹进行分析, 从中选取有效轨迹.
2.4 单分子运动轨迹分析
对于单分子运动轨迹, 需要分析其在x或y方向位移 (Δx或Δy)、回旋半径(radius of gyration,Rg)、位移标准差(displacement standard deviation,Dstd), 并针对某一物理量统计该实验体系中大量分子的频数分布 (probability distribution function,PDF).
位移Δx (或Δy)是指轨迹中相隔某一时间段在x或y方向的位置变化:

回旋半径( Rg) 是衡量轨迹在一段时间内运动造成的尺寸大小的物理量:
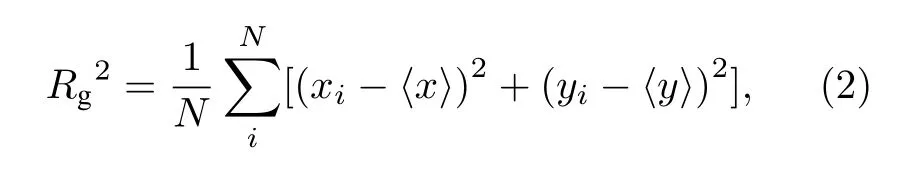
其中, x和y分别代表某一时刻轨迹中的x以及y坐标, 〈 x〉 和 〈 y〉 对应于这两个坐标的平均值.
一条轨迹位移的标准差(Dstd)是指一条轨迹中每一个时间点产生位移的标准差:
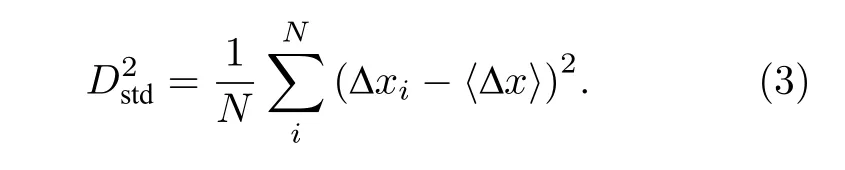
此外, 统计某一物理量在该体系中大量分子的频数分布PDF是指统计物理量在各个数值范围内的出现次数.
对该分布进行高斯函数拟合, 函数为
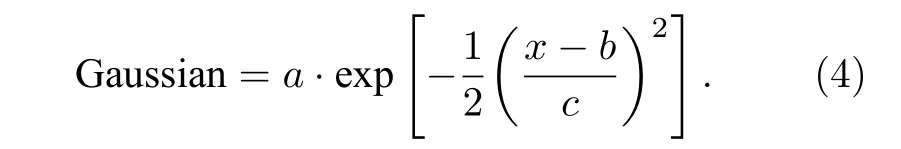
拟合参数包括a, b和c.拟合优度是指用于衡量拟合函数与原数据相符程度的系数.计算方法如下:
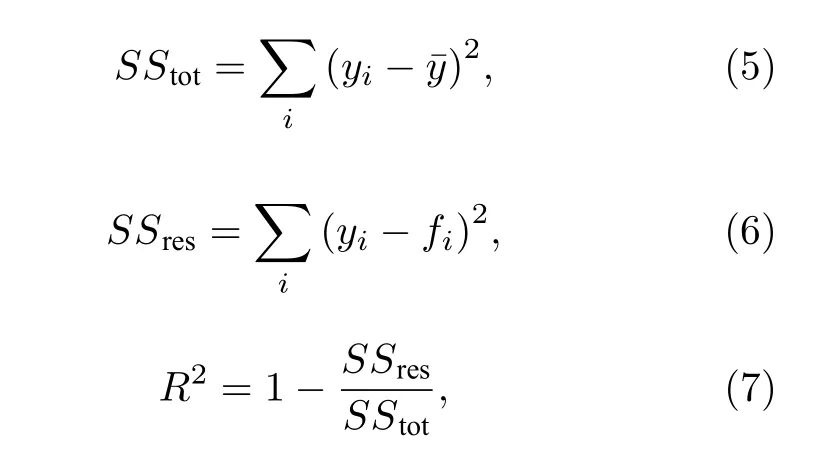
其中y为待拟合数值, y¯ 为其平均值, f为拟合值.R2越接近于1, 代表拟合函数对于原数据描述得越好.
2.5 数值模拟方法
对于理想布朗运动, 其位移的两个分量Δx以及Δy应满足正态分布:
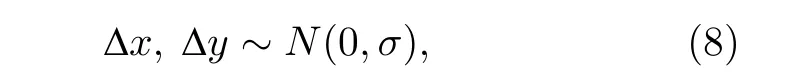
其中σ是这一正态分布的标准差, 其平均值为0,因此:

而用于衡量布朗运动扩散能力的物理量扩散系数满足:
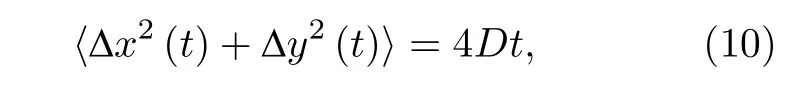
其中D为拟合参数, 即扩散系数.因此, 从形式上来说, 布朗运动的扩散能力可视为由位移的标准差决定.在数值模拟中, 我们根据这一特性, 利用正态随机数生成器, 生成了不同扩散能力的布朗运动轨迹以便进一步研究(附录图A1).
3 结果与讨论
3.1 模拟轨迹数据: 利用不同分析方法实现运动模式分离
由于所使用的实验体系和细胞膜自身的特点,磷脂分子在膜中的运动行为极其复杂.例如, 支撑磷脂双层膜是单分子追踪实验中最常用的一种细胞膜模型.一般认为, 由于支撑膜上下叶所处环境不同(下叶周围的水层很薄, 仅有1 nm左右[14]),支撑膜中部分的磷脂分子会呈现出异常的扩散行为, 其扩散能力会处于较低的水平[15].此外, 由于受到蛋白或周围环境的作用, 细胞膜中同一个脂分子在不同时刻也可能会体现出不同的运动模式[16,17].因此, 实验中所获得的数据常常是不同运动模式下的磷脂分子运动轨迹的混合.这一现象大大增加了对磷脂分子运动行为分析的难度, 因此迫切需要一种有效的方法来分离分子轨迹中的不同运动模式.目前常用方法主要是通过分析一定时间间隔内分子在x或y方向位移(Δx或Δy)和回旋半径( Rg)的频数分布(PDF)来研究运动的情况[18], 但实际效果并不十分理想.
例如, 我们利用数值模拟方法生成了两类不同运动模式的轨迹, 其中标准差较大的一类记为 Tfast,其 σ =1.25 , 而标准差较小的一类记为 Tslow, 其σ=1 , 混合之后的轨迹为 Tmixed.分别计算了上述三类轨迹的位移PDF和回旋半径PDF的分布情况, 结果如图1所示.这里, Tmixed的位移和回旋半径的PDF由混合前两类轨迹的平均值来产生:
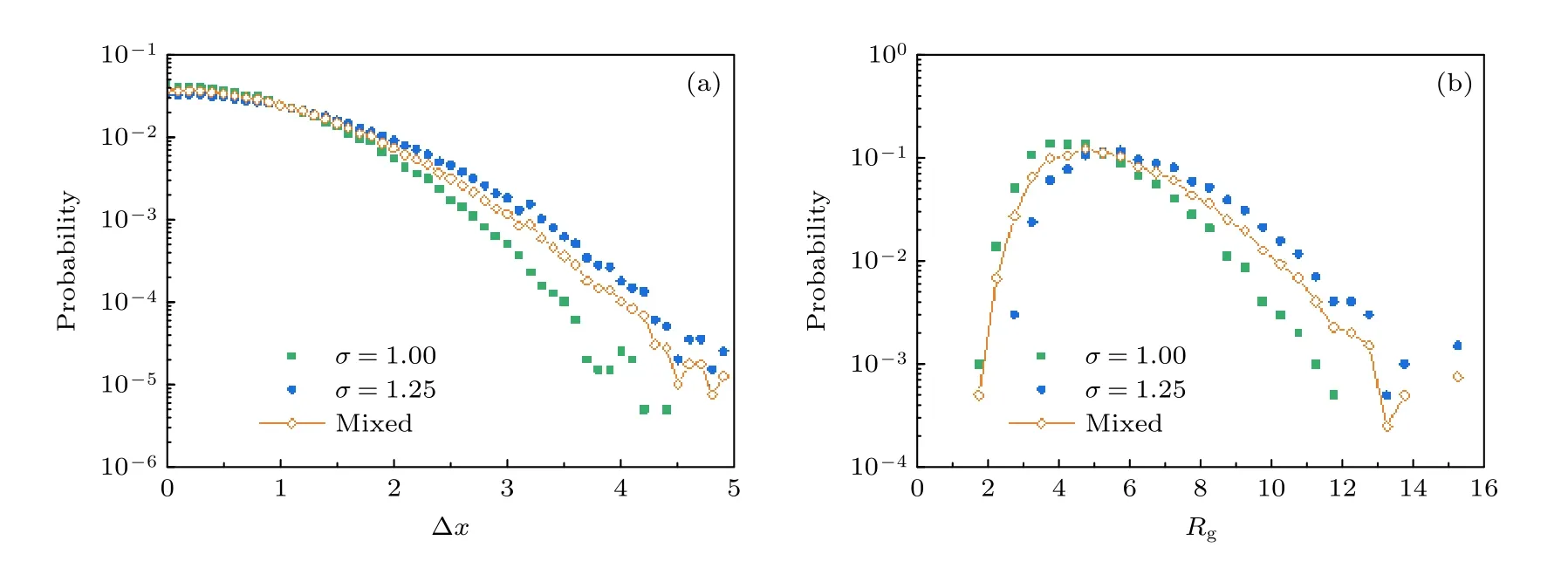
图1 利用传统的位移和回旋半径PDF进行轨迹分析 (a) 轨迹的位移频数分布情况, 包括两类原始轨迹 T (σ=1) ,T(σ=1.25) 和二者混合之后的轨迹 T mixed ; (b) 三类轨迹的回旋半径频数分布情况Fig.1.Conventional PDF analysis of the displacement and R g of trajectories: (a) Displacement PDF of the trajectories before mixing ( T (σ=1) , T (σ=1.25) ) and after mixing ( T mixed ); (b) R g PDF of the three conditions.

结果发现这三类轨迹的位移PDF的区分度并不是很高, 特别是在Δx较小的部分, 差别很小.回旋半径 Rg是通过计算一条轨迹每一时刻相对于平均位置的平均偏移水平来体现一条轨迹所代表的运动能力:

与前文所描述的位移PDF情况类似, 在轨迹的标准差相差较小的情况下, 不同轨迹之间 Rg的区别也较小, 不易区分.
鉴于此, 本文提出一类新的分析方法, 通过计算每一条轨迹位移的标准差(Dstd)来进行PDF分析, 以期实现不同轨迹运动模式的区分.如图2(a)所示, 包含两类运动模式轨迹的 Tmixed, 其Dstd频数呈现典型的双峰分布, 因此可以使用两个高斯函数的叠加对这一分布进行拟合, 拟合所得的两个高斯函数称为 G1和 G2.为了精确区分这两类不同的运动模式, 我们尝试将这两个高斯函数的交点作为区分两种不同运动模式的阈值: 将低于这一阈值的部分记为, 而高于这一阈值的部分则为分离之后得到的轨迹数量 Ns与混合前 Tslow的轨迹数量 N0之比即为这一分离操作的准确率:

图2 利用Dstd频数分布进行轨迹分析举例 (a) T mixed(σ=1,1.25) ; (b) T mixed(σ=1,1.5); (c) T mixed(σ=1,2); (d) 三种Tmixed经过Dstd轨迹分离法处理之后所得轨迹数量的准确率Fig.2.Typical examples showing trajectory analysis based on the PDF of Dstd: (a) T mixed(σ=1,1.25); (b)Tmixed(σ=1,1.5);(c) T mixed(σ=1,2); (d) accuracy of the seperation shown in Fig.(a) (c).
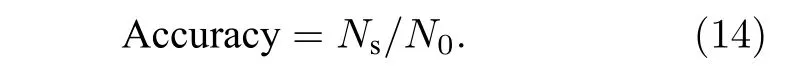
图2给出了利用此方法对具有不同σ值的混合轨迹组 Tmixed的处理效果(对应的拟合优度可见附录表A1).结果表明, σ越大, Dstd频数分布的两个高斯峰之间的差别越明显, 分离准确率也越高;但即便是在σ较小的情况(如 σ =1.25 ), 其准确率也仍高于90%.这些结果充分表明, 对于包含不同运动模式的分子轨迹来说, 利用Dstd频数分布来进行分析具有比传统位移和回旋半径PDF分析方法更大的优势, 而利用高斯函数的交点作为区分两种不同运动模式的阈值的方法也具有良好的定量区分效果.
3.2 平板磷脂双层膜: 脂分子轨迹的Dstd频数分布分析
使用传统的囊泡融合法制备了平板支撑DOPC磷脂双层膜, 利用单粒子追踪技术追踪了磷脂分子在膜内的运动轨迹.图3(a)和图3(b)为典型的单个磷脂分子位置变化的时间序列照片和轨迹曲线,清晰显示了该分子在膜内的扩散运动行为.此外,导致磷脂分子具有不同运动模式的原因之一是其上下叶所处的环境不同, 因此我们在原始脂膜体系中加入荧光淬灭剂碘化钾和硫代硫酸钠, 以淬灭脂膜上叶的绝大部分荧光基团[17].然后, 利用Dstd频数分布法对基于原始脂膜和上叶荧光淬灭后脂膜内的脂分子轨迹数据(每种条件>1300条)分别进行了分析.
纯脂膜中脂质分子Dstd的频数分布呈现出典型的双峰分布(图3(d)), 这符合已有研究中关于脂膜中存在部分异常扩散磷脂分子的推测[17,19].利用上文所述的方法分离轨迹, 得到该组轨迹相应的Tslow和 Tfast所占比例分别为21.3%和78.7% (图3(e),拟合参数及拟合优度见附录表A1和表A2).然而,对于加入荧光淬灭剂之后的脂膜系统(图3(c)—图3(e))[17], 尽管其Dstd的频数仍呈双峰分布, Tslow及 Tfast对应高斯峰的位置, 两个高斯峰的交点与加入前基本一致, 但分布情况却发生了显著变化:Tslow占轨迹总数量的比例显著提高, 而 Tfast所占比例明显降低(分别为49.7%和50.3%).考虑到淬灭剂会淬灭脂双层上叶绝大多数的荧光基团, 这些结果表明 Tslow主要、却非完全来源于脂膜下叶的脂分子, 而脂膜中磷脂分子自身运动异质特性也应对Tslow有所贡献; 此外, 我们的结果还表明, 淬灭剂的加入尽管改变了磷脂膜上下叶中荧光分子的数目分布, 却不会对磷脂分子的运动行为造成额外的影响.这些结果充分显示了Dstd频数分布轨迹分析法在分离不同运动模式脂分子轨迹上的有效性,同时也清楚表明了磷脂分子在膜内扩散运动的异质性, 并暗示了支撑脂双层膜在仿生细胞膜或细胞器膜方面可能存在的局限性.
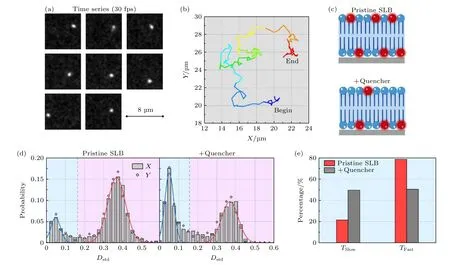
图3 DOPC支撑脂双层膜内磷脂分子运动轨迹的Dstd的频数分布分析 (a), (b) 典型的单个磷脂分子时间序列荧光成像照片(拍摄速率30 frames/s)及运动轨迹(总时长4.38 s).(c)—(e) 原始以及加入荧光淬灭剂之后的脂膜: (c)示意图; (d)分子轨迹Dstd频数分布情况; (e) T slow 与 T fast 比例柱状图.图(c)中红色为荧光脂分子, 蓝色为无荧光脂分子Fig.3.PDF of Dstd of the lipid trajectories in a DOPC SLB before or after fluorescence quenching: (a), (b) Representative lipid molecule in a pristine membrane, its time-serial images (at 30 frames/s) and trajectory (with a time duration of 4.38 s); (c)−(e) schematic diagram, PDF of Dstd, and percentage histogram of the T slow and T fast , of the membrane before and after outer-leaflet fluorescence quenching.
作为比较, 我们同样使用了传统的 Rg频数分布方法对磷脂运动轨迹进行了分析.如附录图A2(a)所示, Tmixed的频数分布在 Rg≈0.7 的区域会呈现出反常高水平分布, 这是由原本两种轨迹的标准差差距很大导致的.在现有文献中, 也有学者直接利用 Rg值的大小以区分不同运动模式的轨迹.尽管在一定程度上, 利用 Rg分离轨迹与利用Dstd实现轨迹分离的结果有一定的相似度(附录图A2(b)和图A2 (c)), 然而这一方法强烈依赖于分析者的主观判断来进行临界 Rg值的选择,并且分离阈值的确定会受频数分布步长的影响.但Dstd频数分析法由两个高斯函数的交点作为阈值来定量区分, 且不会受到步长选择的影响(附录图A3).
3.3 蜂毒肽导致的磷脂分子异常扩散行为
根据之前的研究结果, 蜂毒肽实现杀菌功能的细胞膜作用过程主要包括两步: 多肽在细胞膜表面的吸附和聚集, 以及多肽的插膜和跨膜孔的形成.基于巨囊泡泄露测试的实验结果显示, 蜂毒肽导致跨膜孔道形成的临界浓度约为3.0 µg/mL,仅在高于此临界浓度时, 脂膜上吸附的多肽分子能够形成跨膜孔道并造成显著的物质跨膜泄露(附录图A4(a)—图A4 (d))[5].因此在实验中, 我们选择了远低于或高于此临界值的两个多肽浓度体系(0.5与5.0 µg/mL)以实现多肽不同的作用状态: 在0.5 µg/mL蜂毒肽浓度的体系中, 多肽主要呈现为脂膜表面吸附的状态, 该状态恰好对应于多肽跨膜成孔的中间态时间过程; 而当浓度达到5.0 µg/mL, 部分多肽分子会在脂膜内形成跨膜孔道(附录图A4(e)—(f))[10].因此对这两个浓度体系下蜂毒肽与细胞膜相互作用状态的研究, 有助于深入了解蜂毒肽杀菌活性的浓度依赖性, 以及它破膜杀菌的动力学过程.
基于对不同蜂毒肽浓度(0.5或5.0 µg/mL)的脂膜体系中、大量脂分子扩散行为追踪(每种条件下约600条轨迹)、Dstd频数分布分析及相应的双高斯峰拟合, 分别得到了 Tslow以及 Tfast轨迹组(图4(a),(b), 拟合结果见表1, 相应拟合优度见附录表A3).与原始脂膜相比, 高浓度体系中Tfast峰位显著左移(由0.37到0.29, 降低了约21.6%),意味着 Tfast轨迹组的脂分子运动速率明显变慢; 峰的宽度显著变窄(半高宽由原始的0.11降至0.08,降低了约27.3%), 同时 Tfast组脂分子所占比例发生了明显提高(由纯脂膜中的78.7%提高到87.3%),这些现象表明体系中脂分子运动的异质性大大降低, 即大部分脂分子呈现出较为均匀的、比原始脂膜中 Tfast组脂分子慢的运动状态.这一结果证明高浓度下多肽形成跨膜孔对磷脂分子运动扩散能力不仅起到显著阻碍作用、也起到了均一化作用.相较之下, 低浓度蜂毒肽体系则出现了不同的情况.该体系中, Tfast峰位与原始膜接近(0.37—0.36)且呈现较宽的分布(半高宽保持在0.11), Tfast所占比例由纯脂膜中的78.7%提高到87.9%.这意味着大量的脂分子(包括原始的快速运动及部分慢速运动分子)共同呈现出了不均一的运动行为, 证明了低浓度多肽在脂膜表面的吸附并没有影响 Tfast组脂分子整体的运动速率.需要注意的是, 不同浓度多肽都增强了 Tslow和 Tfast组脂分子(主要为下叶和上叶脂分子)之间的耦合, 使他们呈现了更相似的运动状态.
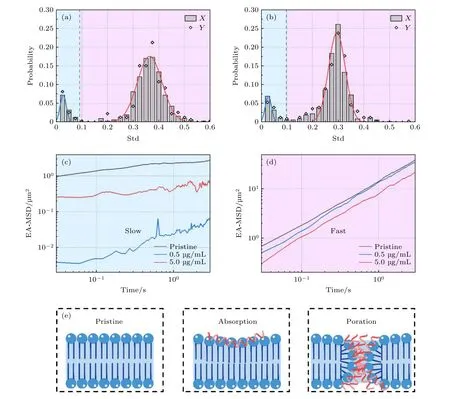
图4 蜂毒肽作用下的脂分子运动行为分析 (a), (b) 蜂毒肽影响下磷脂分子运动轨迹的Dstd频数分布, 多肽浓度为 (a) 0.5 µg/mL,(b) 5.0 µg/mL; (c), (d) 三种实验体系内 T fast 与 T slow 的系综平均均方位移; (e) 三个体系中多肽与脂膜作用示意图Fig.4.Dstd PDF analysis of the melittin-exposed lipid membrane: (a), (b) PDF of Dstd of lipids incubated with melittin at (a) 0.5 µg/mL and (b) 5.0 µg/mL; (c), (d) EA-MSD of T fast and T slow in the three systems; (e) cartoons showing melittin-membrane interactions in the three systems.

表1 不同浓度蜂毒肽影响下磷脂膜中磷脂分子运动Dstd频数分布的拟合结果Table 1.Fittings of the Dstd PDF of lipid trajectories in membrane incubated with melittin at different concentrations.
基于上述不同体系内 Tslow和 Tfast的分组结果,分别研究了原始膜及不同多肽浓度体系中 Tslow和Tfast组分子轨迹的均方位移, 如图4(c)和图4(d)所示.而且, 为了方便比较这些体系内磷脂分子的运动能力[20,21], 进一步利用扩散方程MSD=4Dta进行拟合, 得到了扩散系数D和指数α, D的大小代表了粒子扩散运动能力的强弱, 而α则体现了粒子的扩散方式.通常情况下α = 1对应布朗运动, α < 1则对应着亚扩散[22,23].
对于 Tfast部分磷脂 (拟合结果见附录表A4),在三个体系中α皆略小于1, 即表现出亚扩散特征.与原始脂膜体系相比, 0.5 µg/mL浓度蜂毒肽的加入使得此部分磷脂的D值略微降低 (由3.60—3.30 µm2/s, 降低了约8.3%).这意味着低浓度多肽在膜表面的吸附会轻微地阻碍部分磷脂分子(主要是上叶磷脂分子)的扩散速率, 这与之前模拟结果中所示的、多肽吸附导致其下方区域脂分子扩散运动减速的现象相符(图4(e), 附录图A5)[10]; 但当蜂毒肽浓度增大至5.0 µg/mL, 此部分磷脂的D值会显著降低(至2.08 µm2/s, 降低了约42.2%),表明高浓度下多肽跨膜成孔会严重阻碍(主要是上叶)磷脂分子的扩散.此外, Tslow部分的磷脂分子呈现出不同的运动变化趋势.加入0.5 µg/mL 浓度蜂毒肽使得此部分磷脂分子运动显著受限(D由0.56 µm2/s 降低至0.01 µm2/s).这可能是由蜂毒肽的吸附和浅插使得脂膜表面张力增大、厚度变薄、以及上下叶磷脂之间的耦合性[6]等原因导致的; 而在5.0 µg/mL浓度蜂毒肽的作用下, 此部分磷脂分子运动受限情况则会有所缓解(D由0.01 µm2/s 增加为0.24 µm2/s).这可能与跨膜孔道的形成释放了多肽分子吸附或成孔所带来的高表面张力有关.这些结果显示了不同浓度蜂毒肽作用下(或者蜂毒肽跨膜成孔过程的不同阶段), 不同运动模式的脂分子的扩散运动行为受到的不同影响; 考虑到脂分子的运动模式主要受上下叶位置决定, 这些结果体现了多肽在膜表面的吸附和成孔分别对上下叶脂分子运动带来的不同干扰.
4 结 论
脂膜分子运动的异质性以及平板支撑双层脂膜上下叶环境的不对称性等因素导致膜中磷脂分子呈现出不同的运动模式, 这些运动模式的耦合会给细胞膜界面动力学过程的分析和理解带来诸多困难, 而传统的基于分子位移或回旋半径频数分布的分析方法并不能将这些运动模式进行有效分离.针对这一问题, 本文提出了一类基于分子位移标准差的频数分布来区分和分离不同运动模式分子轨迹的方法, 该方法表现出了比传统手段更高的准确度和更多的定量信息.利用这一方法, 研究了单组分磷脂膜中磷脂分子的运动情况, 发现即使结构最为简单的单组分支撑膜体系也包含有快、慢两种不同运动状态的磷脂分子; 脂膜上叶荧光淬灭实验表明, 运动能力强和弱的磷脂分子分别主要位于双层膜的上叶和下叶.基于这一结果, 进而研究了在蜂毒肽影响下的磷脂分子的运动状况, 刻画了蜂毒肽的"两态"作用模式分别对磷脂膜中运动较快和较慢的两类磷脂分子的影响: 对于运动较快的磷脂分子(主要是上叶脂分子), 吸附状态的蜂毒肽对其影响较小, 而多肽跨膜孔道的形成则会显著抑制其运动; 对于运动较慢的磷脂分子(主要是下叶脂分子), 多肽吸附对膜结构的扰动(例如厚度变薄、形变、表面张力增大等)会进一步限制其运动, 但蜂毒肽跨膜孔道的形成却会减弱这种限制.然而, 不论是吸附还是跨膜成孔的多肽, 都会显著增强上下叶脂分子之间的耦合.本文发展了一类对复杂生物膜体系中不同运动模式的分子运动轨迹进行区分和分离的数据分析方法, 并应用该方法, 阐述了蜂毒肽-脂膜作用的不同阶段, 对上下叶脂分子运动的不同影响.本方法的发展将对利用单分子追踪技术研究生物体系动力学过程有重要帮助.
附 录
文中通过正态随机数生成法产生了不同长度的轨迹的位移(Δx, Δy):

随后根据生成的Δx和Δy得到一条完整轨迹的实时坐标:
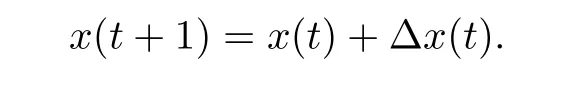
文中提到的数值模拟的轨迹为了接近实际实验中的轨迹,轨迹的长度均采用了100 帧.不同扩散能力的轨迹可以通过调整位移满足的高斯分布中的σ来调整, 两类不同扩散能力的轨迹就是将两类σ值不同的轨迹混合而来, 文中提到的混合轨迹体系中均含有4000条轨迹.图A1为σ = 1的四条代表轨迹.

图 A1 数值模拟所得的σ = 1的四条代表轨迹Fig.A1.Four typical trajectories with σ = 1 obtained from numeric simulations.
图A2为不同步长下得到的 Rg的频数分布, 其中黑色虚线代表的理论曲线是根据 Tfast的Dstd的平均值所生成的标准布朗运动的轨迹的 Rg的频数分布情况.将这一理论曲线与实际从磷脂分子运动轨迹中得到的结果比较, 可以发现 Rg较低部分即为扩散模式不同的轨迹.为了验证 Rg和Dstd分离法之间的关联, 计算了每一条轨迹的 Rg以及Dstd之间的皮尔森相关系数(Pearson correlation coefficient),得到这个代表两个量之间相关性的R = 0.7652 (皮尔森相关系数介于–1和1之间, 越接近于–1代表两个量呈现负相关关系, 越接近1代表两个量呈现正相关关系).也就意味着 Rg和Dstd这两个物理量基本成正相关关系, 那么根据这两个物理量筛选出的轨迹也就基本重合.
图A3给出了不同步长的Dstd的频数分布以及根据对应的高斯拟合所得到的阈值, 结果显示, 三种不同步长得到的阈值均为1.10, 证明了利用Dstd的频数分布分离轨迹的方法不取决于频数分布的步长.
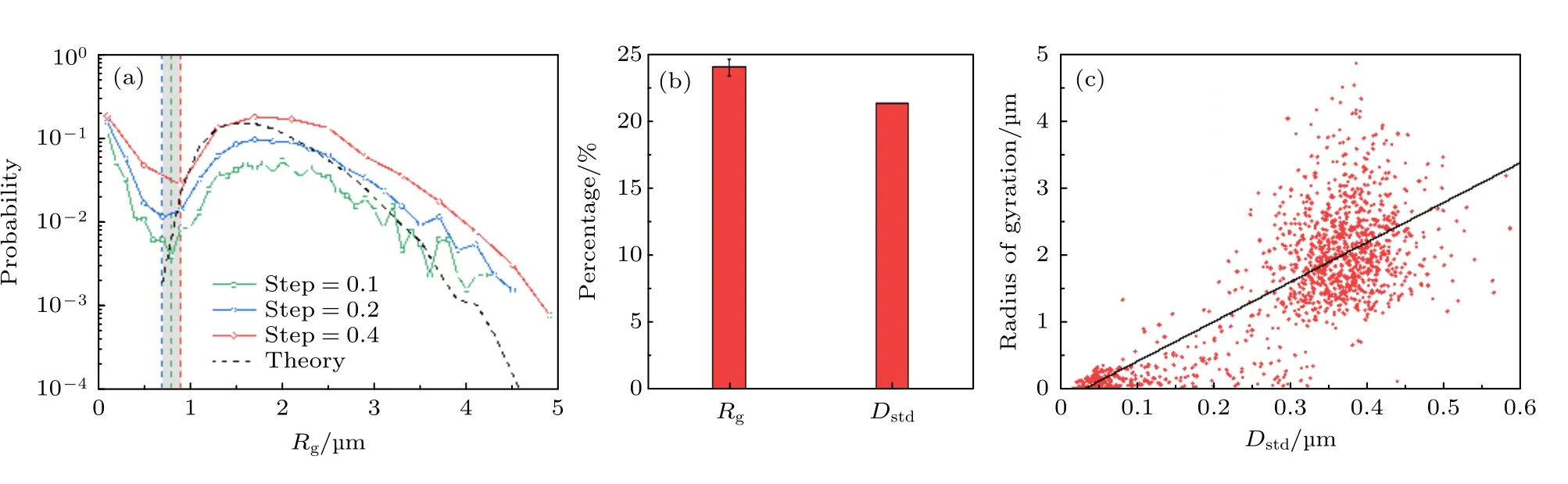
图 A2 原始脂膜内脂分子运动行为的回旋半径PDF分析 (a) 不同步长下的 R g 频数分布以及相应的阈值; (b) 分别以 R g 和Dstd 为标准分离轨迹得到的 T slow 占比柱状图; (c) 纯DOPC脂膜中磷脂分子运动轨迹的回旋半径以及位移标准差之间的关系,其中黑色线为拟合曲线, 二者呈现正相关Fig.A2.PDF analysis of R g for the lipids in a pristine membrane: (a) PDF of R g acquried with different step values (Step = 0.1,0.2 or 0.3).Dashed lines show determination of the threshold value separating the trajectories.(b) Percentage of T slow obtained by Rg or D std analysis.(c) Relationship between R g and D std for a pure DOPC bilayer.

图 A3 不同步长的Dstd的频数分布以及相应的高斯拟合 (a) 步长为0.05; (b) 步长为0.02; (c) 步长为0.04Fig.A3.PDF of Dstd by different step and corresponding Gaussian fittings: (a) step = 0.05; (b) step = 0.02; (c) step = 0.04.
如图A4所示, 本文使用的蜂毒肽浓度主要是0.5 µg/mL以及5 µg/mL, 使用GUV动力学泄露实验研究了不同浓度下蜂毒肽与磷脂膜的相互作用情况.结果显示, 0.5 µg/mL的蜂毒肽并没有对GUV产生明显的扰动, 这时蜂毒肽主要吸附在磷脂膜上.蜂毒肽导致GUV产生明显泄露的临界浓度为2.5 µg/mL, 而当蜂毒肽浓度上升到8 µg/mL后,GUV出现了大量的解离现象.因此5 µg/mL的蜂毒肽与脂膜的相互作用以形成跨膜孔道为主.
图A5所示的是分子动力学模拟中在蜂毒肽分子吸附作用下脂分子的运动情况, 结合图A5(a)和图A5(b)可以发现, 蜂毒肽吸附区域下方的脂分子运动受到了抑制(以红色虚线圈标出), 而蜂毒肽周围区域的部分脂分子运动有所增强, 这一结果体现了多肽吸附导致的脂分子运动的异质性.

图 A4 不同浓度的蜂毒肽作用下的GUV泄露实验 (a)—(c) 分别在0.5, 5.0以及8 µg/mL的蜂毒肽的作用下的GUV泄露情况, 其中绿色通道为GUV中包裹的钙黄绿素, 红色通道代表GUV所在的轮廓; (d) 0—10 µg/mL各浓度的蜂毒肽对GUV的扰动情况; (e)浓度3 µg/mL蜂毒肽的作用下, 典型的GUV荧光泄露曲线; (f) 低浓度蜂毒肽吸附在脂膜以及高浓度蜂毒肽形成跨膜孔道的示意图Fig.A4.GUV leakage experiment incubated with different concentration of melittin: (a)–(c) Confocal images of GUV leakage incubated with 0.5, 5.0 and 8 µg/mL of melittin; (d) influence on GUV by different concentration of melittin; (e) typical leakage curve of GUV incubated with 3 µg/mL; (f) sketch of absorption or poration of melittin interacted with membrane.

图 A5 分子动力学模拟中蜂毒肽影响下脂分子的扩散情况 (a) 代表性俯视截图, 显示蜂毒肽在脂膜表面的吸附; (b)脂分子的扩散图谱[10]Fig.A5.Diffusion of lipids upon melittin exposure in molecular dynamics simulations: (a) Representative snapshot of melittin binding on a membrane (top view); (b) diffusion map of individual lipids[10].
拟合优度是用于衡量拟合函数与原数据相符程度的系数.计算方式如下:
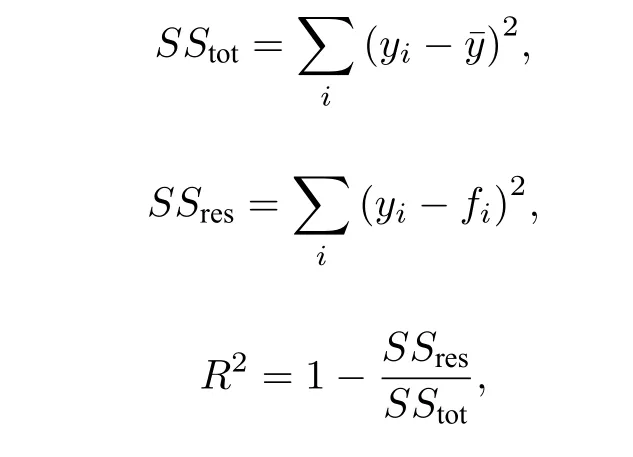
其中y表示拟合前的原始数据, f表示拟合所得的函数, 通过上面的式子可以发现, 当拟合函数对原始数据描述得越好时, 拟合优度R2就越接近1.
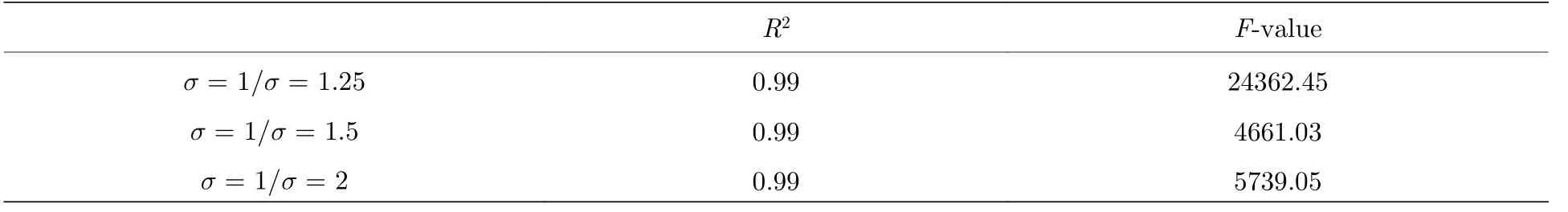
表 A1 正文中图2所示高斯拟合的拟和优度Table A1.Goodness of the Gaussian fittings in Fig.2 in the main text.
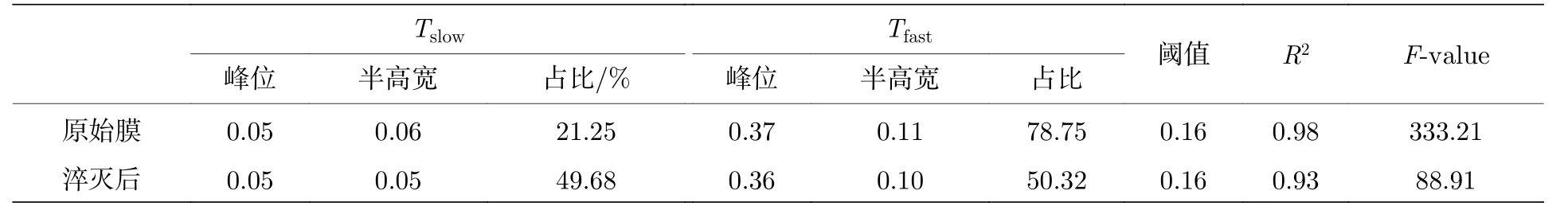
表 A2 单组分DOPC磷脂膜淬灭前后磷脂分子运动Dstd频数分布的拟合数值Table A2.Fittings of the Dstd PDF of lipid trajectories in a SLB membrane before and after quenching.
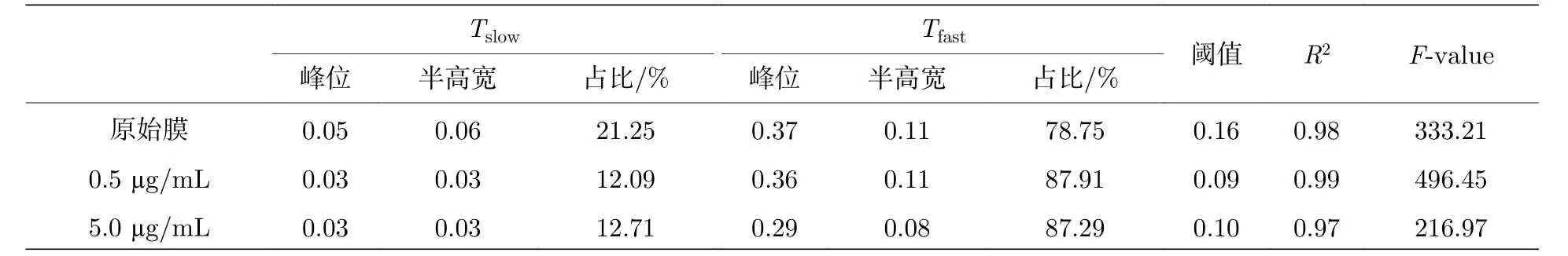
表 A3 不同浓度蜂毒肽影响下磷脂膜中磷脂分子运动Dstd频数分布的拟合数值Table A3.Fittings of the Dstd PDF of lipid trajectories in membrane incubated with melittin at different concentrations.
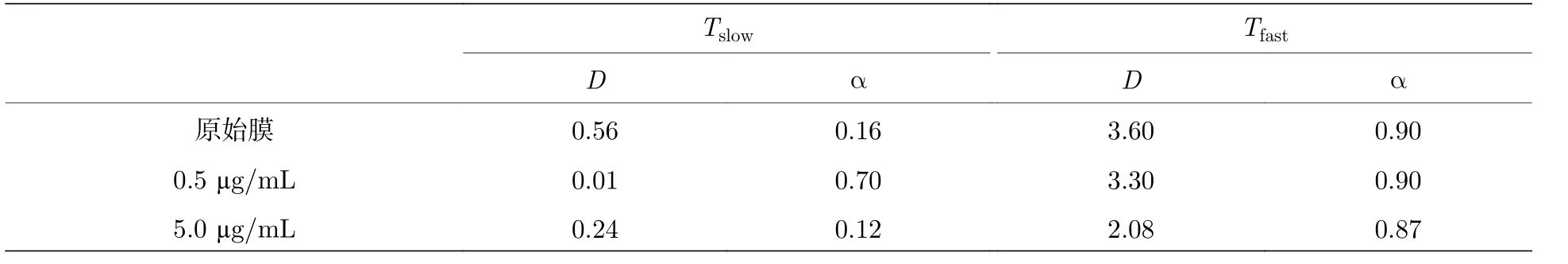
表 A4 不同浓度的蜂毒肽影响下磷脂分子运动轨迹的系综平均均方位移的扩散方程拟合结果Table A4.Fittings of the EA-MSD of lipid trajectories in membrane incubated with melittin at different concentrations.
