自发性孤立性肠系膜上动脉夹层诊疗进展
2021-09-17王垚柯赵渝李凤贺
王垚柯,赵渝,李凤贺
(重庆医科大学附属第一医院血管外科,重庆 400000)
0 引言
自发性孤立性肠系膜上动脉夹层(Spontaneous isolated superior mesenteric artery dissection,SISMAD)是一种罕见的血管疾病,在一项对6666具尸体进行的尸检报告中该病发生率为0.06%[1]。自Bauersfeld在1947年首次报导SISMAD病例以来[2],过去几十年仅有少量的病例报告。近年来,随着计算机断层扫描(Computed tomography,CT)在腹痛患者中的广泛应用,尤其是高质量CTA的普及,SISMAD病例数较前大大增加,相关文献报道也越来越多,其中大多数来源于中国、日本、韩国等亚洲国家[3],但发病率是否与人种、环境、气候及生活习惯等有关尚无研究证据支持。由于SMAD可因夹层动脉瘤破裂出血或SMA堵塞引起肠缺血、肠坏死等致患者死亡,在临床上受到医生的关注与重视。然而,SISMAD的病因及自然病程尚不清楚,最佳治疗方案的选择也未达成共识。
1 病因
SISMAD的病因目前尚不明确,部分研究者认为与动脉壁病理变化有关,包括动脉中层囊性坏死、血管平滑肌细胞发育不良、外膜炎症、中膜弹性层破裂、穿透性动脉溃疡、假性动脉瘤和动脉瘤等[4,5]。也有研究者认为结缔组织病(如马凡综合征、Ehlers-Danlos综合征等)是SISMAD发生的可能原因[6,7],但在大多数报告中没有确定SISMAD的具体潜在原因,此外,不容易将这些结缔组织病与夹层发生后的继发性变化区分开来。
有研究者[5]提出SISMAD的发生可能与肠系膜上动脉的解剖学特点及血流动力学有关。肠系膜上动脉是腹主动脉第二个主要分支,自腹主动脉发出后在胰腺后方下行,位置相对固定,之后跨过胰腺钩突的前方进入小肠系膜根部,此段位相对活动,在移行区存在异常剪切力,可能是导致肠系膜上动脉夹层的原因。Park等[8]测量了SISMAD患者胰腺下缘和SMAD入口之间的距离,平均距离是11.2mm±9.61mm,发现SMAD总是从SMA的弯曲段周围开始。Park等[8]还建立了SMA不同弯曲度的模型(60°、90°、120°),应用计算机流体力学对SMA开口及弯曲段的血流流场及动脉壁剪切应力进行分析,认为在SMA的特定部位发生的异常血流动力学变化是SISMAD发生发展的一个重要因素。肠系膜上动脉与腹主动脉存在一定的角度,KIM等[9]测量了三组研究人群(韩国SISMAD患者、韩国人和白种人患者的体检数据库)的腹主动脉肠系膜上动脉夹角(aortomesenteric angle,AMA),发现SISMAD患者的AMA比正常韩国人、白种人的AMA更大(75.7°±17.5°vs.56.0°±19.6°vs.62.6°±19.2°,P<0.001),认为较大的AMA是SISMAD的一个重要病因。吴等[10]人的一项研究也发现SISMAD患者具有比正常人更大的AMA(73°±19.8°vs.50°±18.81°,P<0.001),并且进一步进行力学研究证实,较大的夹角与SMA弯曲段动脉壁较高的应力和血管腔内较高的振荡剪切指数有关,弯曲段也正是夹层通常发生的地方。
2 临床表现
SISMAD好发于50多岁的中老年男性,其临床表现多种多样,临床上以症状性SISMAD多见,但缺乏特异性,亦有隐匿发病的无症状患者,在影像学检查中偶然发现。在几篇系统性回顾报道[3,11-14]中,男性SISMAD患者占80.6%-88.5%,症状性SISMAD占83.4%-93.3%,其中腹痛是最常见的症状,多为持续性腹痛伴阵发性加重,部分患者可能伴有腰背部放射痛或表现为隐痛。Cho等[15]认为肠系膜上动脉狭窄与SISMAD患者的临床症状有关,提示腹痛可能是由于内脏缺血引起,而Park等[16]认为腹痛原因来源于肠系膜上动脉夹层及血肿本身,动脉夹层周围的炎症刺激内脏神经丛而导致疼痛。除腹痛外,其他症状包括恶心呕吐、腹胀、腹泻、血便、厌食、便秘、体重下降、发热、多汗、胸骨后疼痛等[13]。部分患者可出现持续超过一个月的慢性症状,包括恶心、呕吐、腹泻、黑便、餐后疼痛和体重减轻,提示SMAD可能有亚急性或慢性病程[14]。在体征方面,发病早期可能无明显腹部体征或腹部体征较轻,表现为“症状体征分离”,严重者可能因不同程度的肠坏死表现出腹部压痛、反跳痛及肌紧张等腹膜刺激征。
3 诊断
SISMAD患者常因突发腹痛于急诊或基层医院就诊,且其临床表现和体征缺乏特异性,容易漏诊或误诊。有学者建议,在适当的临床环境中应考虑对每个有2-3h以上不明原因腹痛病史的患者进行急性肠系膜缺血的诊断性检查[14];对于顽固性上腹痛和血压升高、且腹痛与查体和实验室检查相对不符的患者应怀疑SMAD[17]。
目前数字减影血管造影(Digital Subtraction Angiography,DSA)被认为是诊断SMAD的金标准,可以清楚的显示夹层的位置、累及范围、血管管腔通畅情况及分支血供等,但因为其属于有创操作,并未作为首选的诊断方法,而在血管腔内介入治疗方面更有价值[5,14,18-20]。临床上约95%的ISMAD患者依靠CT诊断[13],尤其是增强CT,可以见到特征性的“双腔征”,可以显示夹层的破口、真假腔直径、真假腔有无血栓、远端血供及是否合并其他动脉夹层等,也有助于判断有无肠道缺血/坏死。彩色多普勒超声(Color Doppler Sonography,CDS)可根据SMA内真假腔及撕裂的内膜片等征象诊断SMAD。BAO等[21]发现CDS和CT血管造影(CTA)在测量最小内径、横截面积、直径和狭窄面积率以及真腔流速等方面无显著性差异,CDS可能是诊断SISMAD的一种有效手段,并且具有更高效、更无创、更经济等优点。但是肠道蠕动、肠道积气、检查者经验等会影响CDS成像效果,故其在诊断SISMAD方面存在局限性。实验室检查和腹部X线在本病的诊断中尚无明确作用。
4 分型
目前尚无针对SISMAD的病程发展进行分期的文献报道,临床上根据增强CT或者DSA进行影像学分型。2007年Sakamoto等[22]根据假腔的影像学表现首次对SISMAD进行影像学分型,将其分为4型(图1):Ⅰ型,假腔血流通畅,既有入口又有出口;Ⅱ型,“死胡同”形假腔,有入口无出口;Ⅲ型,假腔内血栓形成,伴溃疡样突起(真腔突出到血栓形成的假腔中形成的局部充血囊);Ⅳ型,假腔内完全血栓形成,不伴溃疡样突起。但是此方法未考虑真腔血栓形成或狭窄等情况,2009年YUN等[18]提出新的分型(图2):Ⅰ型,真假腔均通畅,有入口和出口;Ⅱa型,真腔通畅,假腔有入口无出口,呈囊袋状;Ⅱb型,真腔通畅,假腔内血栓形成;Ⅲ型,真假腔均闭塞。2010年,Zerbib等[23]在Sakamoto分型的基础上补充了另外两种分型:Ⅴ型,假腔内部分血栓形成,肠系膜上动脉近端动脉瘤样扩张、远端狭窄;Ⅳ型,肠系膜上动脉部分或完全血栓形成。以上分型均是以SMAD真假腔情况作为依据,未考虑夹层长度,但是SISMAD患者的临床症状与夹层长度和真腔狭窄程度有关[18,24]。2013年Luan等[20]根据夹层的位置及长度提出一种新的分型方式:A型,夹层位于SMA弯曲部分并向近端延伸;B型,夹层仅限于SMA弯曲部分;C型,夹层位于SMA弯曲部分并向远端延伸,但未累及回结肠动脉或远端回肠动脉;D型,夹层位于SMA弯曲部分并向远端延伸,累及回结肠动脉或远端回肠动脉。目前,YUN分型因其简单、全面,在临床上应用较广泛。然而,尽管很多分型方法被提出,但是分型的目的并不是为了更全面的囊括所有SMAD类型,而是协助临床医疗决策,临床上何种分型方式更适用尚未确定。

图1 Sakamoto分型[22]
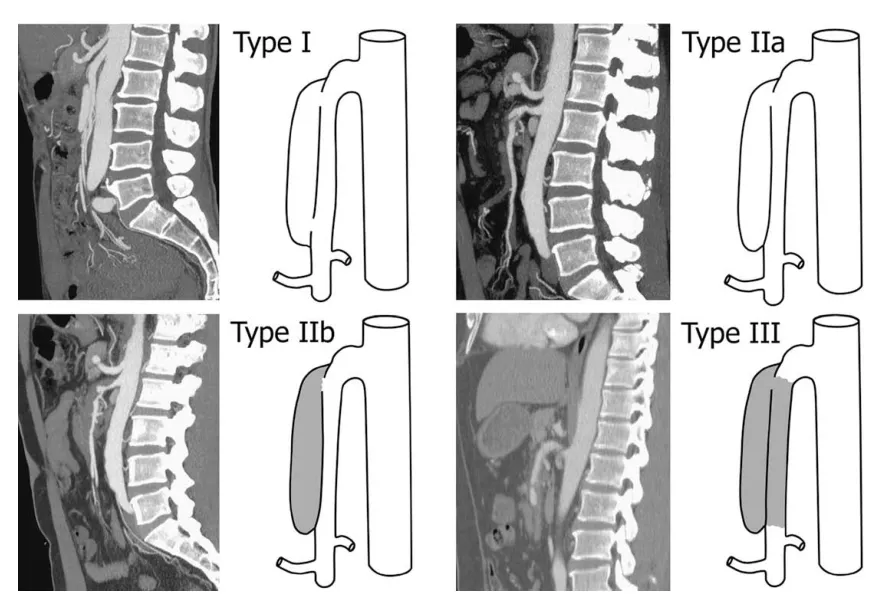
图2 YUN分型[18]
5 治疗
SISMAD的治疗目的是缓解症状,预防肠缺血或肠系膜上动脉破裂,目前可供选择的治疗方案包括保守治疗、血管腔内介入治疗和开放手术治疗。欧洲血管外科学会临床实践指南[25]推荐:无症状患者不需要立即干预,可以通过抗血小板治疗和控制高血压进行保守治疗;有症状患者最初可以进行保守治疗,应该考虑给予抗血小板药物或肝素以预防受累动脉血栓形成;当保守治疗无效且怀疑肠缺血时,应行血管腔内治疗或开放手术。然而,最佳治疗策略仍未达成共识。
5.1 保守治疗
保守治疗是最常见的初始治疗方案,治疗方式主要包括抗血栓治疗、控制血压、肠道休息、抑制胃酸分泌、镇痛及营养支持等。Park等[16]分析了46例接受保守治疗的患者6.5-74.2个月的随访结果,CTA显示41.3%的患者假腔缩小,23.9%的患者夹层长度变短,43.5%的患者无变化;15.2%的患者夹层完全重塑,没有患者出现夹层进展;随访期间26%的患者出现轻度腹部不适,但无复发性腹痛,无SISMAD相关死亡率。Heo等[26]对83名有症状的SISMAD患者予以保守治疗,96%的患者腹痛缓解,4%的患者出现长时间的腹痛,包括一名患者肠道坏死;在长期(1-173)个月随访中,CTA显示34%的患者无变化,63%的患者有部分或完全重塑,2%的患者有动脉瘤样改变,1%的患者夹层进展。多项研究[7,12,27-30]显示SISMAD具有相对良好的病程,保守治疗对于大多数患者来说是安全有效的,但仍需密切的监测及随访。
抗血栓治疗的目的是预防SMA血栓形成以及潜在的远端栓塞[12],尽管临床上30%和57%的患者分别接受了抗血小板治疗及抗凝治疗[3],然而其有效性及必要性仍存在争议。Kim等[31]对29名SISMAD患者予以不使用抗血栓药物的保守治疗,26名患者保守治疗成功,在(13-129)个月的随访中,27名患者CT扫描显示夹层改善或完全消失,无症状复发。在初次CT扫描中没有肠缺血或梗死证据的患者中,不使用抗血栓治疗的保守治疗可能就足够了[31]。此外,在一些大样本研究及系统性回顾[26,32,33]中,抗血栓治疗与单纯的保守治疗在症状缓解率、动脉重塑率等方面未发现明显差异。考虑到夹层动脉瘤破裂可能引起致死性出血以及抗血栓形成药物相关出血风险,抗血栓治疗的使用需充分权衡利弊。
5.2 腔内介入治疗
2000年Leung等[34]首次报道了对SISMAD患者予以腔内治疗,此后,腔内治疗SISMAD的报道日渐增多。腔内治疗最常见的措施是支架置入,亦有溶栓、弹簧圈栓塞、球囊血管成形等方式[14]。腔内治疗SISMAD的优势在于可以早期、有效的恢复肠系膜上动脉血运,快速缓解临床症状,并且创伤小、术后恢复快,这使得腔内治疗已成为除保守治疗外的首选治疗策略。有研究显示[35],相对于保守治疗,腔内治疗的患者症状复发率更低,完全重塑率更高,腔内治疗具有更好的长期预后,可能是症状性SISMAD患者合适的一线治疗方案。一些学者[5,36-38]提出了SISMAD腔内治疗的适应证,包括:腹痛持续时间超过7天;有急性肠缺血迹象;肠系膜上动脉真腔受压>80%或肠系膜上动脉夹层动脉瘤直径>2.0cm;保守治疗失败。
腔内治疗的争论点主要是植入支架的选择。由于SMA细长,且夹层常发生于弯曲段,因此临床上使用较多的是柔顺性好的自膨式裸支架,可以使内膜贴壁,封闭夹层破口或减少假腔血流灌注使假腔内形成血栓,同时维持真腔通畅并且不影响分支的血供。Wen等[39]对12名接受覆膜支架植入的SISMAD患者进行了16-36个月的随访,显示了较好的短期疗效;覆膜支架可以更好的封闭夹层破口,可能是一种安全有效的选择,但是覆膜支架相对较硬,且有可能封堵SMA的分支血管引起肠缺血,因此临床上未作为首选。近年来,多层支架被用于动脉瘤的治疗,它通过降低瘤腔内的平均流速和湍流,导致动脉瘤囊内血栓形成,而被覆盖的侧枝和分支仍是开放的[40,41]。然而在中国,多层支架尚未推出,有研究者[40]运用多层重叠裸支架来替代并取得了类似的效果。目前许多研究[39,42-45]显示腔内治疗具有良好的疗效及中期通畅率,然而支架狭窄、支架内血栓形成等并发症时有发生,因此支架植入的患者需长期或终生服用抗血栓形成药物并且规律随访。Hang等[46]对支架远端狭窄的原因进行了分析,发现支架与血管直径比和远端边缘的角度是支架置入术后支架远端边缘狭窄发生的独立危险因素,他们认为锥形支架更适合放置在肠系膜动脉中,支架尺寸约等于近端正常参考直径可能是一个更好的选择,而不是超过参考直径的10%。
5.3 手术治疗
开放手术治疗SISMAD的术式较多,如肝右动脉转流术、腹腔干转流术、主动脉-肠系膜上动脉搭桥等旁路手术,以及补片血管成形术、内膜切除术、血栓切除术等,部分患者因肠坏死行肠切除术、空肠造口术、小肠移植术等[7,29,47-49]。近年来,随着腔内介入技术的发展,开放手术治疗创伤大、技术要求高、风险高、并发症多等缺点逐渐明显,临床上开放手术的应用逐渐减少。但是开放手术疗效确切,仍是一种不可忽略的治疗策略,目前主要用于出现腹膜炎体征考虑肠坏死的患者、夹层动脉瘤破裂出血的患者以及保守治疗和腔内治疗失败的患者。
6 小结
SISMAD是一种罕见的血管疾病,也是腹痛的罕见原因。本病的发病机制尚不明确,肠系膜上动脉的解剖学特点和血流动力学改变可能是本病发展的重要原因。本病缺乏特异性的临床表现,诊断主要依靠CT等影像学手段。大多数SISMAD患者表现出良性临床病程,但仍可能因肠坏死或动脉破裂等导致患者死亡,临床医生应予以重视。保守治疗和腔内治疗的有效性、安全性得到研究证实,但是最佳初始治疗方案的选择仍存在争议。对于肠坏死或动脉破裂等患者,应选择开放手术治疗。
