沉默EpCAM表达对胆囊癌细胞增殖和迁移的影响
2021-09-16邬仲鑫蔡炜龙尹磊
邬仲鑫 蔡炜龙 尹磊
胆囊癌起源于胆道上皮细胞,是胆道系统最常见的恶性肿瘤[1-2],在我国其发病率逐年增加。由于胆囊癌早期缺乏明显和特殊的临床症状,且易转移,因此大多数患者明确诊断时已处于肿瘤中晚期。目前,根治性切除是胆囊癌唯一有效的治疗方法,但其根治性(R0)切除率低[3]。胆囊癌对放化疗效果不显著,尚无有效的靶向治疗或免疫治疗方案,因此预后极差,患者平均生存时间只有5.2~24.4个月,且近年来,胆囊癌患者的5年相对生存率持续下降[4]。因此,目前亟待了解胆囊癌发生、发展的相关机制并研制出针对性较强的分子靶向治疗药物[5]。上皮细胞黏附分子(EpCAM)是一种分子量为40 kD的Ⅰ型跨膜糖蛋白,其通过参与细胞核信号传导、介导肿瘤细胞迁移、增殖和分化等过程,在肿瘤的发生和远处转移中发挥重要作用。大量研究表明,EpCAM在结肠癌、肺癌、胃癌等肿瘤中呈高表达[6],且抗EpCAM靶向药物已用于治疗恶性腹腔积液[7]。然而有关EpCAM在胆囊癌中的作用研究很少,因此本研究探讨沉默EpCAM表达对胆囊癌细胞增殖和迁移的影响。
1 材料和方法
1.1 实验材料 人胆囊癌细胞株(EH-GB1、EH-GB2、GBC-SD、NOZ、OCUG-1、SGC-996)由中国科学院上海生命研究院细胞资源中心提供。DMEM培养基、William′s培养基、RPMI1640培养基、Opti-MEM培养基和FBS均购自美国Gibco公司;链霉素-青霉素双抗购自上海翊圣有限公司;小干扰RNA si-NC和si-EpCAM(5′-CUAC AAGCUGGCCGUAAACdTdT-3′)、EpCAM引物均由上海拓然生物科技有限公司合成;脂质体转染试剂LipofectamineTM2000购自美国Invitrogen公司;CCK-8试剂盒、多聚甲醛、结晶紫均购自上海碧云天生物科技有限公司。反转录试剂盒和实时荧光定量PCR试剂盒均购自大连Takara公司;酶标仪(BIORAD,IMARK)购自美国伯乐公司;显微镜(OLYMPUS,cx23)购自中国奥林巴斯有限公司。
1.2 细胞培养 将人胆囊癌细胞株置于5%CO2和37℃的培养箱中,分别用含10%FBS和100 U/ml青霉素、100 U/ml链霉素的培养基培养。EH-GB1、EH-GB2、GBC-SD和OCUG-1细胞株使用DMEM培养基,NOZ细胞株使用William培养基,SGC-996细胞株使用RPMI1640培养基。细胞常规置于100 mm培养皿中,于生长对数期时使用胰蛋白酶-EDTA消化并收集。
1.3 细胞分组和转染 将人胆囊癌细胞株NOZ和GBC-SD分为实验组(si-EpCAM组)、对照组(si-NC组)和空白组(Control组),其中si-EpCAM组细胞转染si-EpCAM,si-NC组细胞转染si-NC,Control组细胞不添加小干扰RNA。将NOZ和GBC-SD细胞株接种于6孔板内,待长至30%~50%左右时进行转染。转染过程按照LipofectamineTM2000转染试剂说明书进行,即用250 μl Opti-MEM培养基培养液分别稀释10 μl 20 μmol/L的siRNA储存液和5 μl lipo2000,混匀并室温孵育5 min后将两者混合,室温孵育20 min,加入到含有1 500 μl Opti-MEM培养基的6孔板内。转染6 h后,更换新鲜培养基。待48 h后收集人胆囊癌细胞株进行后续实验。
1.4 EpCAM的mRNA相对表达量检测 采用qRTPCR法。转染后的细胞中加入1 ml Trizol提取总RNA,检测RNA的浓度和纯度。按mRNA反转录试剂盒说明书进行反转录,qRT-PCR反应条件:95℃预变性30 s;95℃变性5 s;60℃退火延伸34 s,共40个循环。引物序列如下:上游:5′-AATCGTCAATGCCAGTGTACTT-3′;下游:5′-TCTCATCGCAGTCAGGATCATAA-3′。其相对表达量采用 2-ΔΔCt法计算。
1.5 细胞增殖能力检测 采用CCK-8法。转染后的细胞常规消化、离心、重悬后计数,将细胞接种于96孔板中,GBC-SD 细胞每孔 0.8×103个,NOZ 细胞每孔 1×103个,每组设置5个复孔。将96孔板置于37°C、5%CO2培养箱中,分别于1、2、3、4 d加入培养液与CCK-8按9∶1 混合的反应液 100 μl/孔,37 ℃避光培养 3~4 h 后取出,使用酶标仪检测450 nm处的吸光度(OD)值来表示细胞增殖能力,并绘制细胞生长曲线。上述实验重复3次,取平均值。
1.6 细胞克隆能力检测 采用克隆形成实验。转染后的细胞常规胰酶消化、离心、重悬后计数,将细胞分别接种于3 cm培养皿中,每孔1 000个细胞,每组设置3个复孔,置于37°C、5%CO2培养箱中。持续2周,定期换液随时检查,到细胞形成克隆时终止培养,染色观察克隆数量。每孔加入1 ml 4%多聚甲醛固定后以结晶紫染色。拍照并采用Image J软件进行计数。上述实验重复3次,取平均值。
1.7 细胞迁移能力检测 采用Transwell小室实验。转染后的细胞常规胰酶消化、离心、重悬后计数。用无血清培养基调整细胞密度至5×105/ml。取200 μl细胞悬液加于上层小室,下室加入500 μl 10%FBS的完全培养基,放置在37°C、5%CO2培养箱内,培养24~48 h后取出Transwell小室,去除小室上清液,用PBS冲洗,多聚甲醛固定20 min后,用棉签轻轻擦掉上层未迁移细胞,结晶紫染色20 min,PBS冲洗。显微镜下观察和计数5个不同视野的细胞迁移数。上述实验重复3次,取平均值。

2 结果
2.1 6株及3组细胞EpCAM的mRNA相对表达量比较 6株细胞中,NOZ和GBC-SD细胞株EpCAM的mRNA相对表达量相对较高,SGC-996细胞株最低,见图1;而在NOZ和GBC-SD细胞株中,si-EpCAM组Ep-CAM的mRNA相对表达量均明显低于si-NC组,差异均有统计学意义(均P<0.05),见表1。
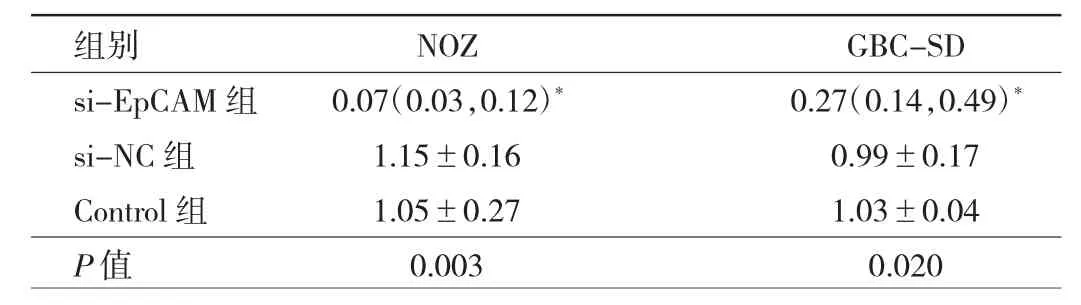
表1 3组NOZ和GBC-SD细胞EpCAM的mRNA相对表达量比较

图1 6株胆囊癌细胞EpCAM的mRNA相对表达量比较(EpCAM为上皮细胞黏附分子)
2.2 3组细胞增殖能力比较 加入CCK-8后第4天,NOZ和GBC-SD细胞株中,与si-NC组比较,si-EpCAM组细胞OD值均明显降低,差异均有统计学意义(均P<0.05)。见图 2。
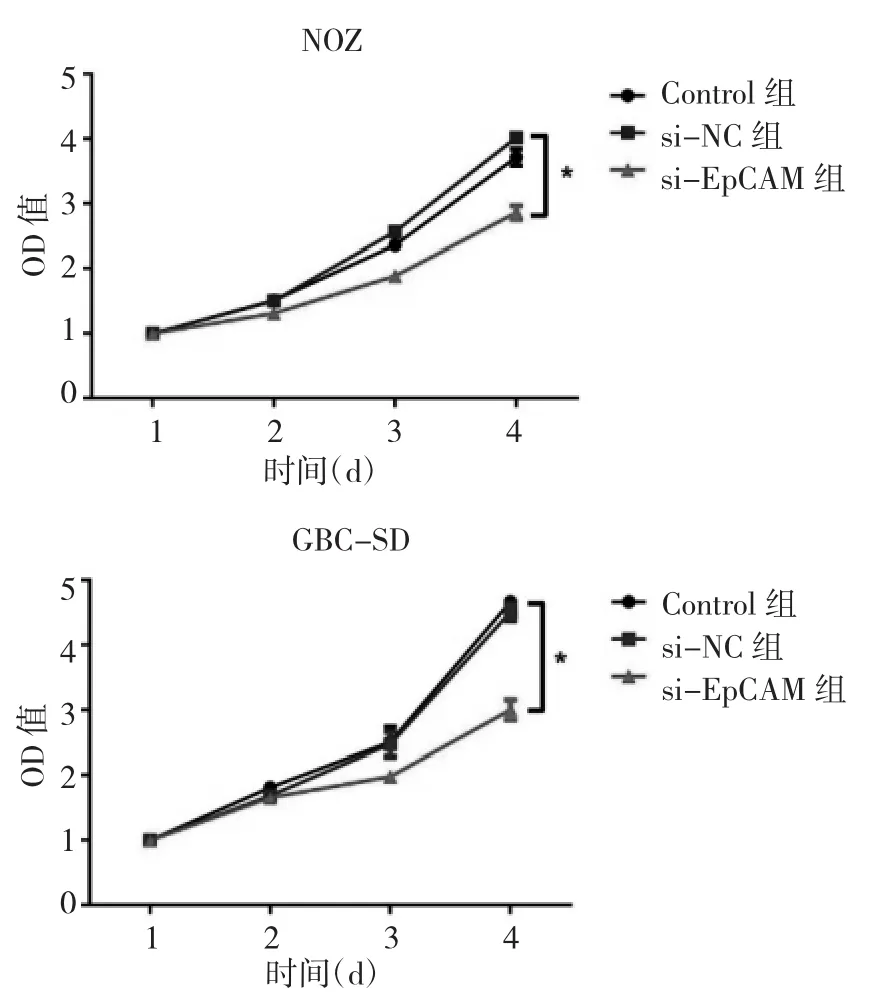
图2 3组NOZ和GBC-SD细胞增殖能力比较(OD为吸光度;*P<0.05)
2.3 3组NOZ和GBC-SD细胞克隆能力比较 NOZ和GBC-SD细胞株中,si-EpCAM组细胞的克隆形成数均明显少于si-NC组,差异均有统计学意义(均P<0.05)。见图3(插页)、表2。

图3 3组NOZ和GBC-SD细胞克隆能力比较(EpCAM为上皮细胞黏附分子)

表2 3组NOZ和GBC-SD细胞克隆形成数比较
2.4 3组NOZ和GBC-SD细胞迁移能力比较 NOZ和GBC-SD细胞株中,与si-NC组比较,si-EpCAM组中细胞迁移数均明显降低,差异均有统计学意义(均P<0.05)。见图4(插页)、表3。

图4 3组NOZ和GBC-SD细胞迁移能力比较(EpCAM为上皮细胞黏附分子;结晶紫染色,×100)

表3 3组NOZ和GBC-SD细胞迁移数比较
3 讨论
胆囊癌恶性程度较高,病程进展迅速,缺乏有效治疗手段,且发病率呈现逐年升高的趋势。近几十年来关于胆囊癌的研究有了一定的进展,但早期诊断和采取合适的治疗方法仍是改善本病预后的主要途径。然而,胆囊癌高转移、高侵袭特性的分子机制尚未被完全阐明,并且用于胆囊癌诊断的肿瘤分子标志物特异性较差,远不能为胆囊癌的早期诊断提供分子靶标。
EpCAM最早于1979年在结肠癌中发现,是一种嗜同种非钙离子依赖性上皮细胞黏附分子。除了在细胞间黏附中发挥作用外,相关体内外实验还表明,EpCAM在细胞信号传导,增殖及分化中起着重要作用[8]。EpCAM在上皮起源的肿瘤中有着异常的高表达水平,在结直肠癌、肝癌等多种肿瘤中作为筛选肿瘤干细胞的标志物[9-10];也可作为在肿瘤进展和转移过程中治疗和预后的标志物[11-12]。EpCAM的预后价值在不同肿瘤中有所差别,在乳腺癌[13]、结直肠癌[14]、前列腺癌[15]、胰腺癌[16]等中,高表达和预后不良呈正相关;而在食管癌[17]、胃癌[18]、甲状腺癌[19]等中,高表达和预后不良呈负相关。因此,EpCAM与不同临床结果之间的关系是复杂的,可能与肿瘤的起源或肿瘤进展的阶段相关,其相关机制还需要进一步的研究。
Varga等[20]发现,EpCAM高表达是胆囊癌不良预后的独立危险因素。本研究初步探讨了EpCAM在胆囊癌细胞NOZ和GBC-SD中对其增殖和转移功能的影响,为今后进一步的机制研究奠定基础。EpCAM作为上皮细胞黏附分子,在细胞间连接和癌细胞侵袭转移中具有重要作用。本研究首先在6株胆囊癌细胞系中检测了EpCAM的mRNA相对表达量,结果发现,在NOZ和GBC-SD中EpCAM的相对表达量较高,可能与NOZ和GBC-SD本身具有较强的迁移能力相关;而在SGC-996中,EpCAM几乎没有表达,也提示可能与SGC-996较弱的迁移能力有关(关于胆囊癌细胞的迁移能力数据尚未发表)。在Transwell实验中,敲减EpCAM的表达明显抑制了NOZ和GBC-SD的迁移能力,证明了EpCAM的确在胆囊癌细胞的迁移中发挥了重要作用,其相关机制还需要进一步研究,在胆囊癌中是否与肿瘤转移有关也有待探索。此外,本研究应用CCK-8实验和克隆形成实验验证了敲减EpCAM的表达可抑制NOZ和GBCSD的增殖能力,说明EpCAM在胆囊癌细胞的增殖方面也发挥了作用。
综上所述,EpCAM可能通过促进胆囊癌细胞的增殖和迁移能力从而促进胆囊癌的发生、发展及转移。EpCAM可考虑作为筛选肿瘤干细胞的标志物,也可作为诊断和治疗胆囊癌的分子靶点。但其调控胆囊癌细胞功能的具体机制以及在临床中的应用仍需进一步探索。
