生物预处理对肉桂枝叶化学成分的影响
2021-09-16曾维星毕良武李胜男陈玉湘赵振东
曾维星, 程 贤, 毕良武*, 李胜男, 陈玉湘, 赵振东
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业和草原局林产化学工程重点实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042;2.南京林业大学 江苏省林业资源高效加工利用协同创新中心,江苏 南京 210037)
肉桂(CinnamomumcassiaPresl)属于樟科植物,一般指桂皮,也分为桂皮、桂枝、桂叶,中国的主要产地有广东、广西、云南等省区。桂皮一般作为传统的辛香料,用作食物烹饪的调味品,而肉桂枝叶则用于提取肉桂油。利用新鲜肉桂枝叶直接提取肉桂油,通常提取得率较低。在实际生产过程中,肉桂油加工企业通常将肉桂枝叶贮存一段时间进行自然陈化,通过加强肉桂枝叶代谢物的积累从而促进肉桂油提取得率的提高。此外,随着多学科的相互渗透和交叉,生物技术研究与天然产物研究的结合日益密切,微生物发酵技术已经开始作为生物预处理手段,应用于天然产物的提取分离[1-4]。李军集等[5]以经水蒸气蒸馏提取肉桂油后所得肉桂叶渣为原料进行生物发酵,研究显示发酵后肉桂叶渣的化学成分发生了明显变化,产生了其他具有挥发性芳香气味的化学成分。张笮晦等[6]利用微生物菌株XJ26的发酵液处理肉桂叶成功提取了肉桂醛等肉桂叶精油成分,并且在最优工艺条件下,肉桂醛、香豆素和邻甲氧基肉桂醛的提取得率分别为1.40%、 0.73%和0.92%,其中香豆素和邻甲氧基肉桂醛的得率均高于已报道的数据。此外,本课题组前期研究也发现肉桂枝叶经酵母菌等预处理后,可以增加肉桂油的提取得率[7]。因此,明确不同预处理条件下肉桂枝叶主要化学成分的变化规律对于探索其预处理作用机理具有重要意义。本研究分别使用加水、加酵母液、45天陈化的方式对新鲜肉桂枝叶进行预处理,先采用气质联用鉴定肉桂油挥发性化学成分,再借助UHPLC-QTOFMS技术对空白对照组和预处理后的肉桂枝叶主要化学成分(包括挥发性和非挥发性成分)进行全面表征,最后对质谱数据进行聚类和热图分析,探索肉桂枝叶主要化学成分经不同方式预处理后的变化及其内在转化规律,以期为肉桂枝叶的生物预处理研究提供重要参考。
1 实 验
1.1 原料、试剂与仪器
新鲜肉桂枝叶,采摘自广西梧州市藤县金鸡镇;蒸馏水,实验室纯水仪制备;酵母粉,湖北安琪酵母股份有限公司;甲醇,市售分析纯。
10 mL挥发油测定器,四川蜀玻公司。KH5200B型超声波仪器,昆山禾创超声仪器有限公司;7890A-5975C气相色谱-质谱联用(GC-MS)仪,美国安捷伦公司;Waters Acquity BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),美国Waters公司;Shimadzu LC-30A Series UHPLC系统,配备SIL-20AC自动进样器,LC-20AD 二元泵,CTO-20A柱温箱,SPD-M20A二极管阵列检测器,日本岛津公司;AB SCIEX QTOFTM 5600+质谱仪system,美国SCIEX公司;移液枪、5424高速离心机,德国Eppendorf公司。
1.2 生物预处理
取大小均匀的肉桂枝叶均分为4组,处理方式如下:1) 按肉桂枝叶与水质量比5 ∶1将水均匀喷洒在枝叶表面,作为水预处理组(W);2) 将0.1 g/mL的酵母水溶液按肉桂枝叶与酵母液质量比5 ∶1均匀喷洒在枝叶表面,作为酵母液预处理组(Y);3) 叶片不做任何预处理,作为空白组(C)。W、Y和C组枝叶分别置于玻璃培养皿中,并用透气封口膜密封,静置一周,叶片不做任何预处理,静置45天,作为陈化存放组(A)。
1.3 肉桂油的提取及其成分鉴定
1.3.1肉桂油的提取 分别将空白组、水预处理组、酵母液预处理组和陈化存放组的肉桂枝叶用小型植物粉碎机粉碎成约1 cm×1 cm大小的碎叶片,使用水蒸气蒸馏法提取6 h,冷却后从油水分离器中收集肉桂油,称质量,计算肉桂油提取得率。
1.3.2肉桂油成分鉴定 吸取10 μL提取得到的肉桂油加入到40 μL甲醇中,稀释至原体积的5倍进样气相色谱-质谱联用仪。GC-MS分析条件:色谱柱为石英毛细管柱(30 m×0.25 mm×0.25 μm);载气为He,流量1.6 mL/min;进样口温度为170 ℃;进样量为0.2 μL;分流比为100 ∶1;色谱柱升温程序为 80 ℃保持2 min,以3 ℃/min的速率升至170 ℃保持10 min。质谱条件:EI电离源,电离源温度为230 ℃,电子轰击能量为70 eV,扫描范围(m/z)为50~500。
1.4 肉桂枝叶提取物制备及分析
1.4.1样品制备 将不同方式处理的肉桂枝叶用小型粉碎机粉碎至粒径约0.4 mm,称取0.26 g左右粉碎的肉桂枝叶转移至10 mL离心管中,平行加入8 mL甲醇后盖紧离心管,使用功率250 W,频率40 kHz 超声波处理10 min后取出放置12 h;第二天再次超声波处理10 min后取出,取上清液1 mL转移至离心管,10 000 r/min离心5 min后取出,用移液枪吸取0.8 mL上清液至进样瓶中,进行UHPLC-QTOFMS分析,每组样品平行操作6次。同时将所有提取后的样品等量混合后进行UHPLC-QTOFMS分析,用于化合物鉴定。
1.4.2色谱条件 Shimadzu LC-30A Series UHPLC系统,柱温为35 ℃。流动相为0.1%甲酸/水(A)和乙腈(B),流速为0.2 mL/min。流动相梯度:0~3 min,5% B;3~10 min,5%~60% B;40~45 min,60%~95% B;45~55 min,95% B;55~56 min,95%~5% B;56~60 min,5% B,进样体积为2 μL。
1.4.3质谱条件 AB SCIEX QTOFTM 5600+质谱仪,ESI离子源,正负离子模式下进行检测。雾化:N2,1.5 L/min;干燥器:N2,140 kPa;CID碰撞气:氩气,50 kPa;解簇电压90 V;碰撞能45 V;离子源温度350 ℃;毛细管温度300 ℃;扫描范围(m/z)50~1 000;所有样品数据采集均采用全扫描模式,非靶向模式获得MS/MS二级碎片。
1.5 数据处理
肉桂油提取得率(Y)计算公式如下:Y=(me/mt)×100%,其中Y为肉桂油提取得率,%;me为收集的肉桂油质量,g;mt为用于提取的肉桂枝叶质量(以干质量计),g。液相色谱-质谱数据借助美国AB公司Peak View软件对化合物的分子式进行分析;数据分析及绘图使用Originlab Corporation公司Origin2018软件;化合物结构式绘制采用ChemBioDrawUltra 14.0。GC-MS数据对比谱库,鉴定肉桂油的成分,根据峰面积归一化法计算得到各成分的相对峰面积。
2 结果与讨论
2.1 生物预处理对肉桂油提取得率及其成分的影响
以原料枝叶的干质量计算不同预处理方式下的肉桂油提取得率。酵母液预处理组(Y)、水预处理组(W)、空白组(C)和陈化存放组(A)枝叶的肉桂油提取得率分别为0.76%、 0.68%、 0.63%、 0.95%。可以看出,空白组、水预处理组、酵母液预处理组和陈化存放组的提取得率比为1 ∶1.08 ∶1.21 ∶1.51。利用酵母液预处理原料枝叶后肉桂油提取得率相比空白组提高20.63%,虽然酵母液预处理组的肉桂油提取得率低于陈化存放组,但预处理时间仅为7天,远小于陈化存放时间(45天)。陈化过程中伴随着肉桂枝叶中部分化学成分向肉桂油成分的转化,推测利用酵母进行预处理,加快了陈化的转化过程。因此,利用酵母液作为预处理手段,能够在较短时间内促进肉桂油提取得率的提高。
借助气相色谱-质谱联用仪得到谱图,结合NIST标准质谱库以及Pub Med数据库,共鉴定出了10种化合物,利用峰面积归一化法计算得到各个化合物的相对峰面积,结果见表1。

表1 不同预处理方式下的肉桂油成分
由表1可知,4组原料枝叶提取所得肉桂油中主要化学成分相同,反式肉桂醛为含量最高的成分。经过生物预处理或自然陈化干预后,主成分反式肉桂醛含量有所下降,但考虑到4组肉桂油提取得率本身存在差异,空白组、水预处理组、酵母液预处理组和陈化存放组提取所得肉桂油中的反式肉桂醛的实际量的比为1 ∶1.01 ∶1.06 ∶1.25,因此,预处理后反式肉桂醛实际量均有所增加。此外,在生物预处理后邻甲氧基肉桂醛、乙酸肉桂酯实际量也有所增加。
由此可见,以酵母液预处理和自然陈化后所得肉桂油的主要组成成分基本一致,并且生物预处理有助于肉桂油中反式肉桂醛等主成分的积累。
2.2 肉桂枝叶甲醇提取物成分的鉴定
为了进一步明确肉桂枝叶甲醇提取物成分(包括挥发性和非挥发性成分)在预处理干预下的变化规律,本研究采用高分辨质谱仪对肉桂枝叶甲醇提取物分别在正、负离子模式下进行检测,混合样品的质谱离子流图如图1所示。综合考虑化合物的保留时间、精确相对分子质量、分子式、相对分子质量偏差、特征离子碎片及文献数据,鉴定出了34个化学成分,包含17个酸类化合物、5个醇类化合物、4个苷类化合物、 3个醛类化合物、3个黄酮类化合物和2个酯类化合物,鉴定结果见表2。
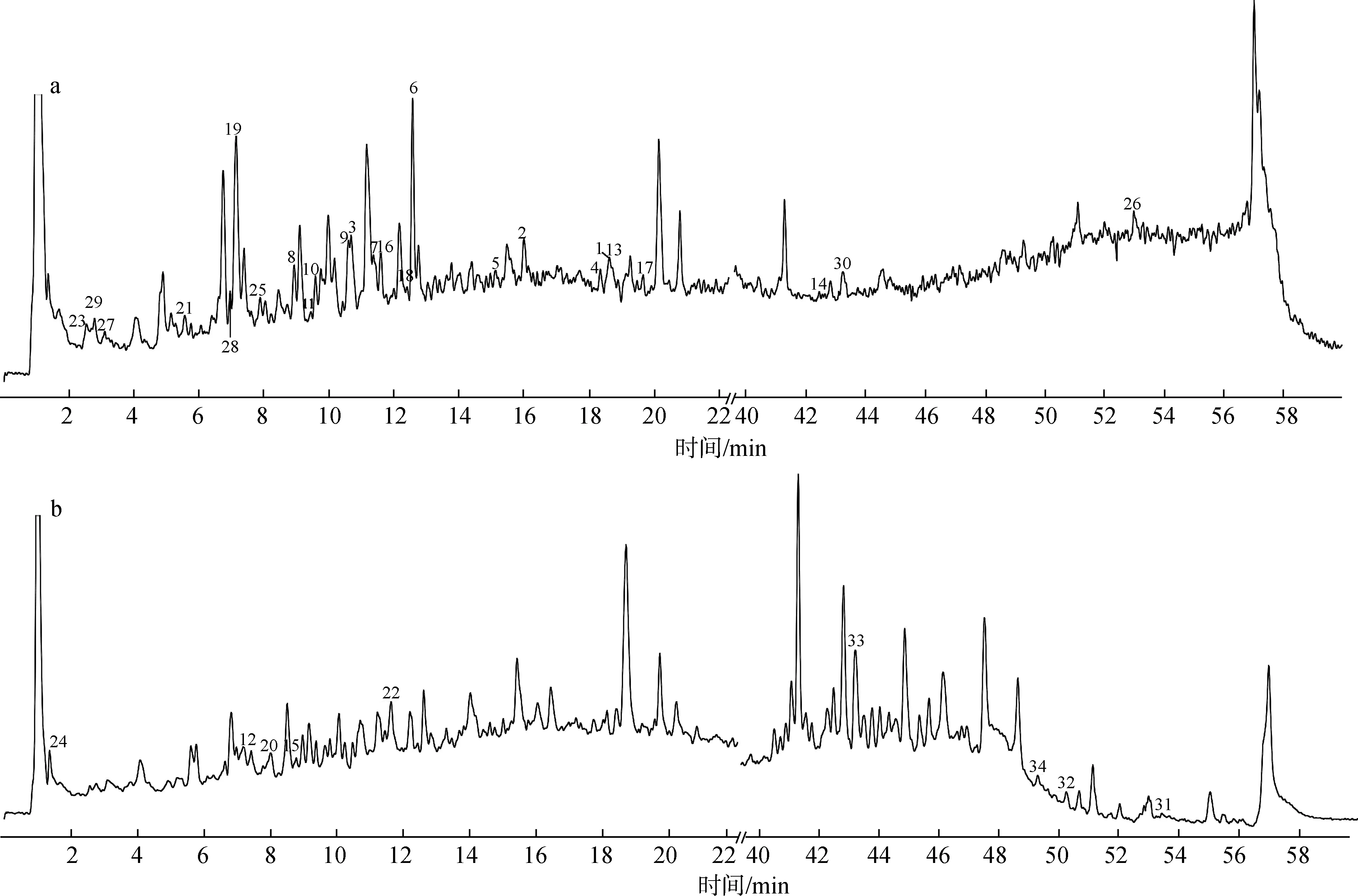
a.正离子模式 positive ion mode; b.负离子模式 negative ion mode
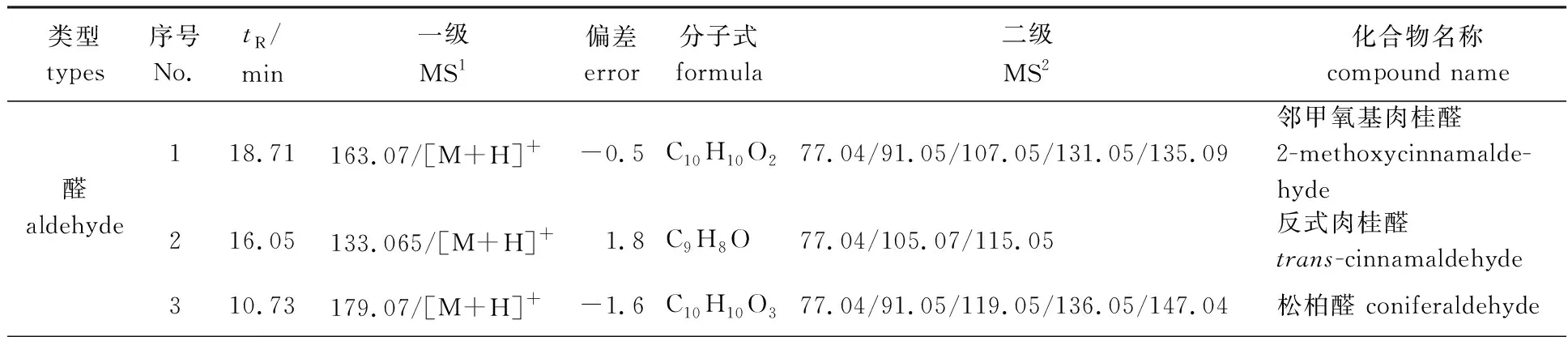
表2 肉桂枝叶甲醇提取物成分的定性分析
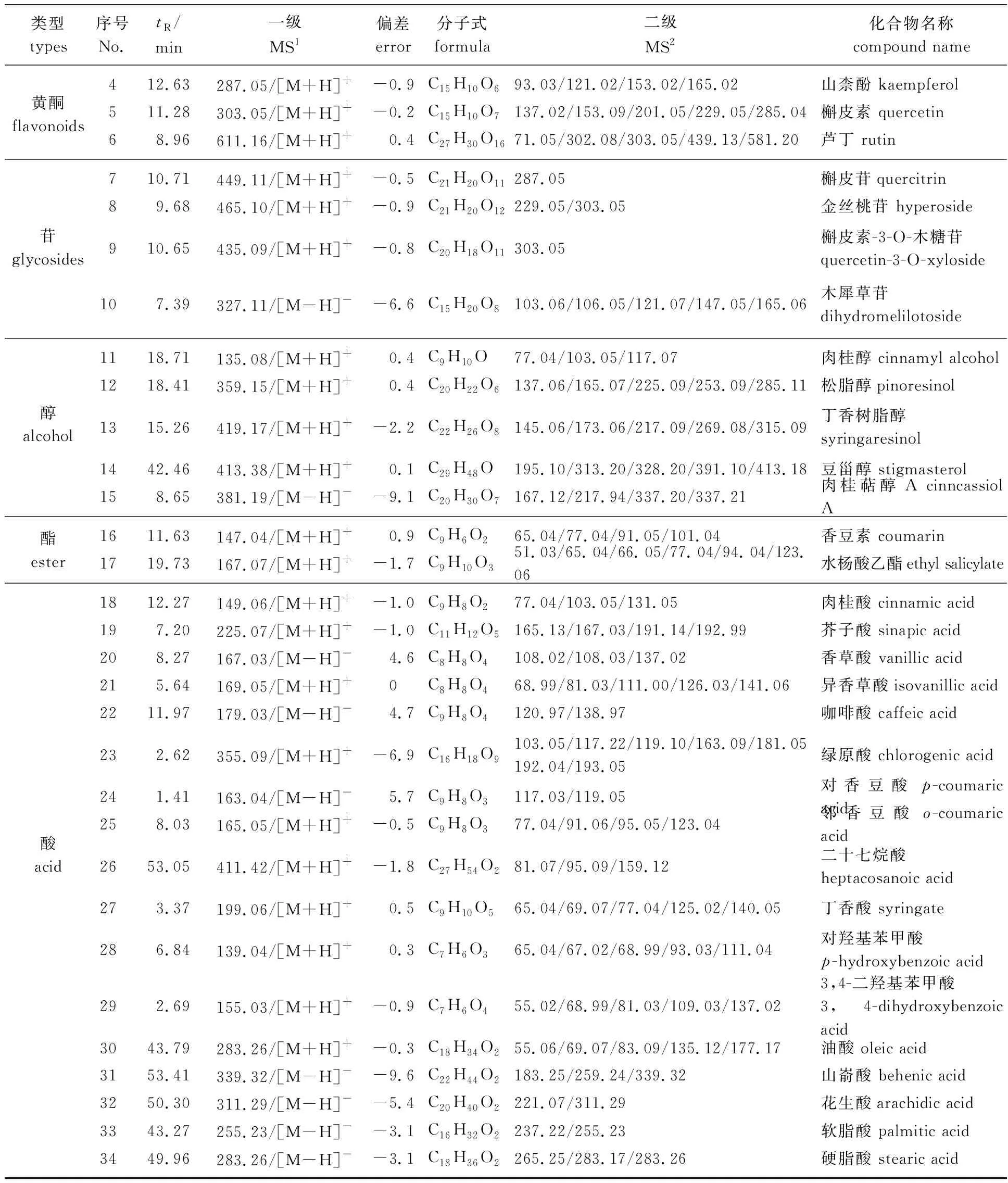
续表2
化合物1的保留时间为18.71 min,准分子离子峰为m/z163.07,其加和形式为[M+H]+,根据元素构成规则和软件分析,推测出该化合物的分子式为C10H10O2,其相对分子质量偏差为-0.5,其中离子碎片m/z135.09分析推测为准分子离子失去1个CO(28 u)后产生的,离子碎片m/z107.05则是准分子离子相继失去1个CO和1个C2H4(28 u)后产生的,推断化合物1为邻甲氧基肉桂醛,该化合物质谱裂解路径如图2路径(I)所示。结合文献[8],同理推断醛类化合物2为反式肉桂醛[9],该化合物质谱裂解路径如图2路径(II)所示,化合物3为松柏醛[10]。
化合物4的保留时间为12.63 min,准分子离子峰为m/z287.05,其加和形式为[M+H]+,根据元素构成规则和软件分析,推测出该化合物的分子式为C15H10O6,其相对分子质量偏差为-0.9,其中离子碎片m/z165.02分析推测为准分子离子C环(C6H6O,94 u)断开后,再失去一个CO(28 u)后产生的,离子碎片m/z153.02为AB环C—C的断裂,即Retro Diels-Alder(RDA)反应,结合文献[11],推断化合物4为山柰酚,该化合物质谱裂解路径如图2路径(III)所示。同理推断其他黄酮类化合物5和6分别为槲皮素、芦丁[12]。
化合物10的保留时间为7.39 min,准分子离子峰为m/z327.11,其加和形式为[M-H]-,根据元素构成规则和软件分析,推测出该化合物的分子式为C15H20O8,其相对分子质量偏差为-6.6,其中离子碎片m/z147.05推测为准分子离子失去1分子葡萄糖(C6H12O6,180 u)后产生,离子碎片m/z103.06推测为准分子离子相继失去1分子葡萄糖和1分子CO2(44 u)后产生,因此推断化合物10为木犀草苷[9],该化合物质谱裂解路径如图2路径(IV)所示。同理推断其他苷类化合物7、8和9分别为槲皮苷[13]、金丝桃苷[14]和槲皮素-3-O-木糖苷。
化合物11的保留时间为18.71 min,准分子离子峰为m/z135.08,其加和形式为[M+H]+,根据元素构成规则和软件分析,推测出该化合物的分子式为C9H10O,其相对分子质量偏差为0.4,其中离子碎片m/z103.05分析推测为准分子离子相继失去1个H2O(18 u)和1个CH2(14 u)后产生的,这与已知肉桂醇的离子碎片解离路径一致[8],因此推断化合物11为肉桂醇,该化合物质谱裂解路径如图2路径(V)所示。同理推断其他醇类化合物12和13分别是松脂醇[14]和丁香树脂醇[15],化合物14和15分别为豆甾醇和肉桂萜醇A[14]。
化合物16的保留时间为11.63 min,准分子离子峰为m/z147.04,其加和形式为[M+H]+,根据元素构成规则和软件分析,推测出该化合物的分子式为C9H6O2,其相对分子质量偏差为0.9,其中离子碎片m/z101.04分析推测为准分子离子相继失去1个CO(28 u)和1个H2O(18 u)后产生的,离子碎片m/z91.05分析推测为准分子离子失去2个CO(28 u)后产生的,这与香豆素酯键结构处断裂相吻合[16],推断化合物16为香豆素,该化合物质谱裂解路径如图2路径(VI)所示。同理推断其他酯类化合物17为水杨酸乙酯[17]。
化合物23的保留时间为2.62 min,准分子离子峰为m/z355.09,其加和形式为[M+H]+,根据元素构成规则和软件分析,推测出该化合物的分子式为C16H18O9,其相对分子质量偏差为-6.9,其中离子碎片m/z193.05推断为准分子离子失去一个咖啡酸(180 u)所产生,m/z163. 09推断为准分子离子失去一个奎宁酸(192 u)后继续失去一个H2O所产生,上述2种碎片与绿原酸酯键断裂所得碎片完全一致,结合文献[17],推断化合物23为绿原酸,该化合物质谱裂解路径如图2路径(VII)所示。同理推断化合物18为肉桂酸,该化合物质谱裂解路径如图2路径(VIII)所示。其他酸类化合物19~25分别为芥子酸、香草酸、异香草酸、咖啡酸、绿原酸、对香豆酸、邻香豆酸[8,17-18]。27~29分别为丁香酸、对羟基苯甲酸、3,4-二羟基苯甲酸[18]。
化合物31的保留时间为53.41 min,准分子离子峰为m/z339.32,其加和形式为[M+H]+,根据元素构成规则和软件分析,推测出该化合物的分子式为C22H44O2,其相对分子质量偏差为-9.6,其中离子碎片m/z183.25推断为准分子离子失去一个C11H24(156 u)所产生,上述碎片与山嵛酸碳链断裂所得碎片完全一致,结合文献[8],推断化合物31为山嵛酸,该化合物质谱裂解路径如图2路径(IX)所示。同理推断其他酸类化合物26为二十七烷酸,化合物30为油酸,化合物32~34分别为花生酸、软脂酸、硬脂酸[18]。
另外,通过表2与表1相关成分比对后发现,肉桂油挥发性次要成分乙酸肉桂酯在肉桂枝叶甲醇提取物中未被检测到,目前尚不清楚其原因。当然提取肉桂油的水蒸气蒸馏法与分离提取物的甲醇提取法是有区别的,肉桂油和甲醇提取物检测所用手段(GC-MS与UHPLC-QTOFMS)的检测器也不尽相同。
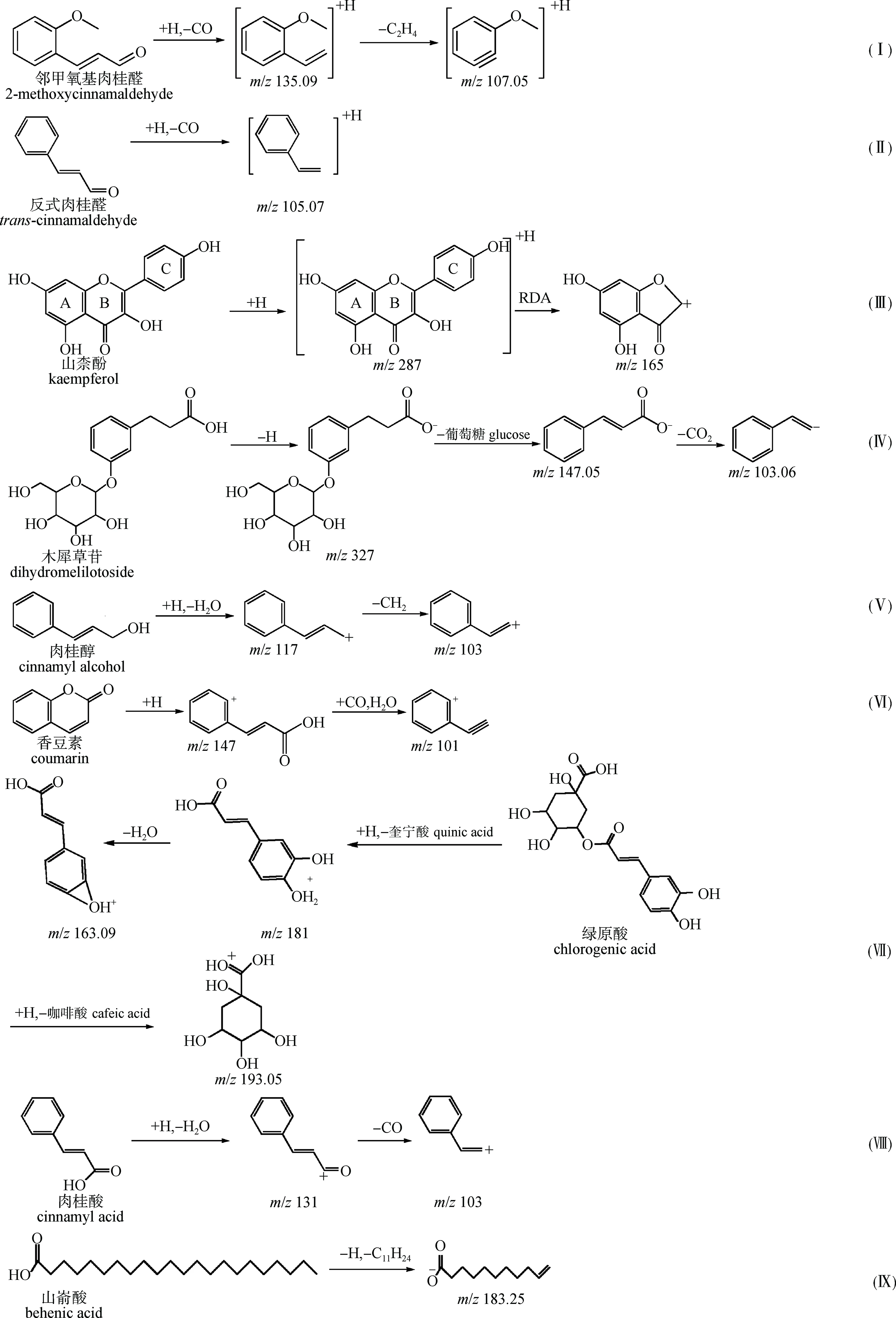
图2 肉桂枝叶化学成分的质谱裂解路径
2.3 生物预处理干预下肉桂枝叶成分的变化规律
首先利用热图聚类分析描述了4组样本34种化学成分质谱响应强度的接近程度,将34种化学成分分为3个级别,结果如图3所示。第I级包括反式肉桂醛、邻甲氧基肉桂醛、肉桂醇、肉桂酸、松柏醛等,大部分属于醛类化合物,在肉桂枝叶中的含量较高且在离子源中容易离子化[19]。

C:空白组 control;W:水处理组water pretreatment;Y:酵母液处理组yeast pretreatment;A:自然陈化aging
第I级包括的化合物的质谱响应强度见表3。由表3可以发现,肉桂枝叶经酵母液预处理后,反式肉桂醛、邻甲氧基肉桂醛、肉桂醇、肉桂酸、香豆素、松柏醛的质谱响应强度在Y组样品中最高。已有报道表明酵母菌预处理能够通过破壁作用促进天然产物的提取[20],这可能是酵母液预处理促进肉桂油提取得率提高的重要诱因。
第II级化合物包括松脂醇等,共计17种化学成分,属于肉桂枝叶的次要成分,大部分属于非挥发性化合物。通过热图分析可以发现:肉桂枝叶的次要成分在酵母菌预处理后的变化趋势与自然陈化干预下的变化趋势一致,具体表现为肉桂枝叶的次要成分在Y组和A组样品中的质谱响应强度普遍低于C组。因此,初步推断在生物预处理或自然陈化过程中肉桂枝叶次要成分可能发生了转化,具体机制有待进一步验证。
综上所述,可以发现:1) 酵母液预处理促进了反式肉桂醛等挥发性成分在肉桂枝叶中的积累;2) 肉桂枝叶的非挥发性成分在生物预处理干预下的变化趋势与自然陈化干预下的变化趋势一致。因此,本研究所涉及的生物预处理方式对改善肉桂枝叶的陈化转化有积极指导作用。
3 结 论
3.1采用加水、加酵母液和45天自然陈化3种方式预处理肉桂枝叶,考察预处理方式对肉桂油及肉桂枝叶甲醇提取物中主要成分的影响。结果表明:经过酵母液预处理原料枝叶后,肉桂油提取得率相对于空白组提高20.63%,因此,生物预处理手段能够在较短时间内促进肉桂油提取得率的提高。同时,以生物预处理干预后所得肉桂油和自然陈化后所得肉桂油的主要成分组成基本一致。
3.2采用UHPLC-QTOFMS技术对4组肉桂枝叶甲醇提取物进行分析,通过参照比对等分析手段从肉桂枝叶甲醇提取物中共鉴定出了34个化合物,包含17个酸类化合物、5个醇类化合物、4个苷类化合物、3个醛类化合物、3个黄酮类化合物和2个酯类化合物。
3.3酵母液预处理干预下,肉桂枝叶提取物中挥发性成分的相对含量有所提高,非挥发性成分的相对含量有所下降,变化趋势与自然陈化干预下的变化趋势一致,因此生物预处理在肉桂油提取方面具有潜在应用价值。
