大麦籽粒苯丙氨酸含量QTL初步定位分析
2021-09-16严苓方杨晓梦孙正海普晓英杨加珍曾亚文
严苓方,杨晓梦,杜 娟,孙正海,普晓英,杨加珍,曾亚文
(1.云南省面向南亚东南亚经济林全产业链联合研发中心/云南省高效经济林培育示范型国际科技合作基地/西南林业大学园林园艺学院,云南昆明 650224; 2.云南省农业科学院生物技术与种质资源研究所/云南省农业生物技术重点实验室,云南昆明 650205; 3.农业部西南作物基因资源与种质创制重点实验室,云南昆明 650205)
大麦(HordeumvulgareL.) 是世界上最早被驯化的谷类栽培作物之一[1],不仅是粮食作物、经济作物和饲料作物,还是药食同源作物[2],对预防和治疗糖尿病、高血压、心血管疾病、慢性尿毒症等慢性疾病有特殊功效和巨大的药用价值[3]。因此,大麦的功能成分是当前大麦的研究热点之一。
大麦籽粒中含有丰富的必需氨基酸。其中,苯丙氨酸是人体八大必需氨基酸之一,但人和动物自身无法合成[4]。现已明确大麦籽粒氨基酸含量为数量性状,受基因型和环境共同影响[5]。农艺措施、气象因素及地域条件等均会影响大麦籽粒氨基酸的含量[6-7]。遗传学研究发现,大麦籽粒氨基酸的含量受胚乳三倍体基因和母体植株二倍体基因的影响[8-9]。闫新甫等[10]进一步研究发现,二棱大麦籽粒中苯丙氨酸含量的遗传存在直接加性效应和显性效应,并存在明显的直接显性效应与环境互作。
通过构建作图群体挖掘数量性状位点是目前大麦QTL研究的主要方法。前人已经对大麦功能成分(γ-氨基丁酸[11]、蛋白质[11]、黄酮[12]等)以及农艺性状(抗病性[13-14]、粒长[15]、粒重[16-17]、籽粒抽穗期[16-17]、穗高[18]、穗长[18]、叶面积[18]、叶宽[18]、株高[18]等)进行了QTL定位分析,但关于大麦氨基酸QTL定位研究鲜有报道。目前仅明确了控制大麦籽粒γ-氨基丁酸含量的QTL主要分布在3H、4H、5H和7H染色体上[11],而关于大麦苯丙氨酸含量QTL的定位,目前还未见 报道。
本课题组在前期的研究中,发现一个籽粒苯丙氨酸含量比较高的品种(紫光芒裸二棱),并利用该品种构建了重组自交系。本研究以该重组自交系为材料,测定群体及其亲本籽粒的苯丙氨酸含量,并结合SSR标记和完备区间作图法构建遗传连锁图谱,挖掘大麦籽粒苯丙氨酸含量QTL,以期为大麦籽粒高苯丙氨酸含量品种筛选以及大麦籽粒苯丙氨酸含量QTL精细定位和克隆转化提供理论依据。
1 材料与方法
1.1 试验材料
重组自交系的构建与试验材料种植参考杨晓梦等[11]的方法。亲本及RIL群体193个株系种植于云南玉溪市,随机区组排列,行长1 m,行距0.3 m,每行播种100粒种子,3次重复。复合肥(N∶P2O5∶K2O=13∶5∶7)为基肥,施肥量为纯氮120 kg·hm-2,2012年11月6日出苗,2013年1月2日追肥纯氮30 kg·hm-2,其他管理同当地常规高产麦田。待植株成熟后,亲本及群体株系随机选取3株,取平均值为最终测定值。将收获的大麦籽粒编号分装,晒干,去掉杂质后,用磨粉机磨细,收集粉末,低温储存,编号待用。
1.2 试验方法
1.2.1 苯丙氨酸含量的测定
采用日立-L8900全自动氨基酸自动分析仪测定群体及亲本籽粒中苯丙氨酸的含量。
1.2.2 大麦总DNA的提取
参考孙正海等[19]的方法提取叶片基因组总DNA。以OD260/OD280比值在1.8~2.0为评价指标,使用紫外分光光度计(DU-7400)对DNA的纯度进行检测,同时用OD260值计算DNA浓度(DNA浓度=OD260×50×稀释倍数)。
1.2.3 SSR引物来源及筛选
本试验所用500对SSR引物均匀覆盖大麦基因组,引物序列来自网站(http://www.wheat.pw.usda.gov/cgi-bin/graingenes),由北京鼎国昌盛生物技术有限责任公司合成。合成的引物在两个亲本间进行多态性筛选,筛选出的多态性引物在群体内进行PCR扩增。PCR反应体系为10 μL,包括上下游引物各0.5 μL、DNA 2 μL、PCR Buffer 1.5 μL、dNTPs 0.4 μL、ddH2O 4.9 μL、Taq polymerase 0.2 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性40 s,55 ℃退火40 s;72 ℃延伸1 min,35个循环;72 ℃最后延伸5 min,4 ℃保存。利用8%聚丙烯酰胺变性凝胶电泳进行扩增产物分离,银染法显色检测。
1.2.4 SSR标记带型记录
将银染显色的凝胶于胶片观察灯下读带,用QTL IciMapping V3.3软件记录:带型和母本紫光芒裸二棱一致的记作“0”,和父本Schooner一致的记作“2”,杂合带记作“1”,缺失记作“-1”。
1.2.5 QTL定位分析
利用已构建的大麦RILs群体的分子遗传连锁图谱,用QTL IciMapping V3.3软件中完备区间作图法(ICIM)[20]对QTL进行定位,LOD值≥2.5作为QTL存在的阈值,确定苯丙氨酸含量QTL在染色体上的相对位置,估算其遗传效应。QTL命名遵循Mccouch等[21]的原则。
2 结果与分析
2.1 RIL群体籽粒苯丙氨酸含量的表型变异
由图1可知,RIL群体峰度值为0.77,偏度值为0.07,表明群体籽粒中苯丙氨酸含量分布为尖顶峰(右偏正态分布),说明群体中苯丙氨酸含量较小的株系在群体中所占比重较大,且群体中苯丙氨酸中间含量株系相对较多。群体苯丙氨酸含量平均值介于两亲本之间,父本Schooner苯丙氨酸含量为0.60 mg·g-1,表现为低值亲本;母本紫光芒苯丙氨酸含量为1.23 mg·g-1,为高值亲本。群体籽粒苯丙氨酸含量在0.59~1.24 mg·g-1之间,变异系数为 2.04%。群体均值为 0.88 mg·g-1,低于亲本均值(0.92 mg·g-1),且出现了超亲分离现象,具数量性状特征,适合进行QTL定位分析。
2.2 RIL群体的遗传连锁图谱
500对SSR引物中有180对可以获得清晰且多态性好的条带,上述标记在群体中的分离情况基本符合1∶1的孟德尔分离比例,为纯合位点。利用180对亲本间具有多态性好的引物进行群体扩增,构建7个连锁群。结果(表1和图2)表明,遗传连锁图谱总长度为2 671.03 cM,平均遗传距离为14.84 cM,其中,7H染色体覆盖距离最长,为542.89 cM,且标记数量最多(39),标记间平均遗传距离为13.92 cM;6H染色体覆盖距离最短,为233.72 cM,且标记数量最少(15),标记间平均遗传距离为15.59 cM。
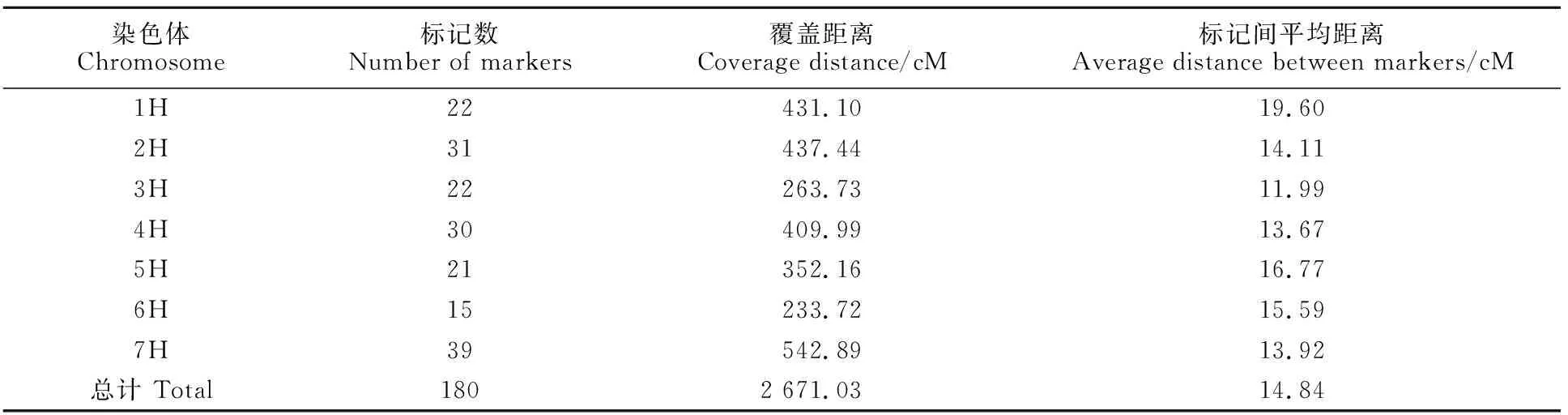
表1 分子标记在大麦染色体上的分布Table 1 Distribution of markers on different chromosomes of barley
2.3 大麦籽粒苯丙氨酸含量QTL定位结果
由表2可以看出,4个与大麦籽粒苯丙氨酸含量相关的QTL分别位于2H、4H、5H和7H染色体上,初步命名为qPHE-2H、qPHE-4H、qPHE-5H和qPHE-7H。4个QTL中,qPHE-2H和qPHE-7H为主效QTL,表型贡献率均大于10%,其中,贡献率最大的为qPHE-7H,位于大麦7H染色体 GMS056~GBM1297区间,表型贡献率为15.45%;另一个主效QTL(qPHE-2H)位于2H染色体Scssr03381~scssr07759区间,表型贡献率为12.32%。qPHE-4H、qPHE-5H为微效QTL,表型贡献率为5.69%和6.96%。qPHE-2H、qPHE-5H和qPHE-7H的加性效应均为负值,表明其增效基因来自父本Schooner,而qPHE-4的加性效应为正值,表明增效基因来自母本紫光芒裸二棱。综上可知,大麦籽粒苯丙氨酸含量是由主效和微效基因共同控制的数量 性状。
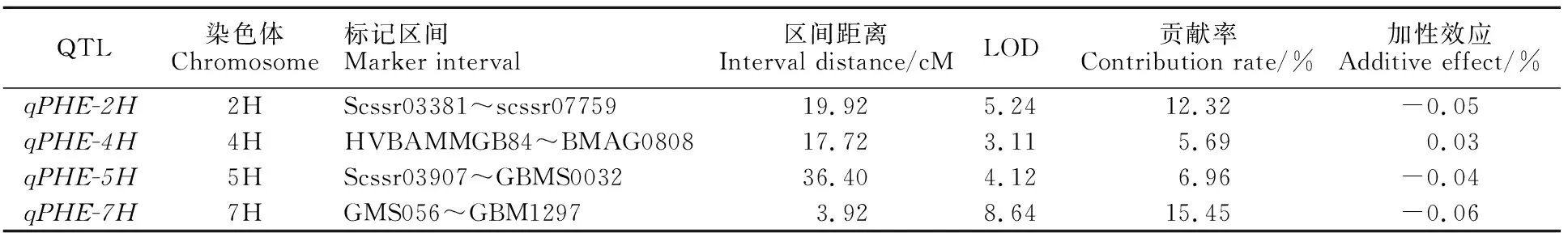
表2 大麦籽粒苯丙氨酸含量QTL的定位信息Table 2 Location information of QTL for phenylalanine content in barley grains
3 讨 论
大麦营养价值丰富,由大麦制成的全麦食品被认为是“健康食品”[22],对预防心血管疾病和癌症等慢性病有极其重要的作用[23]。利用RIL群体构建遗传连锁图谱,可分析QTL位点的加性效应,是植物QTL定位常用的作图适宜群体。Teulat等[24]以大麦Tadmor×Er/Apm RIL群体为材料,检测到12个控制有效分蘖、株高、穗粒数等7个农艺性状的QTL。游 静[25]利用栽培大麦和中东野生大麦构建的RIL群体为材料,检测到14个控制粒长、穗粒数、株高等农艺性状的QTL。杨 涛等[26]以云啤2号与大粒麦构建的RIL群体为材料,在两年间发现了2个与抗性淀粉含量相关的QTL。Tamang等[27]利用Tradition×Pinnacle构建的RIL群体为材料,在2H、3H、4H、6H和7H染色体上检测到12个控制大麦点状网斑病的QTL。
目前关于大麦籽粒蛋白质含量QTL[28-31]和γ-氨基丁酸含量QTL的相关报道[11,32-33]较多,而关于大麦籽粒苯丙氨酸含量QTL则未见报道,因此,本研究发现的4个苯丙氨酸含量QTL均为新位点,分别为qPHE-2H、qPHE-4H、qPHE-5H和qPHE-7H。通过与大麦参考基因组比对,发现2个主效 QTL(qPHE-2H和qPHE-7H)区间与其对应的物理位置有较好的一致性。进一步对苯丙氨酸含量QTL定位区间分析发现,本研究在2H染色体上定位到的控制大麦籽粒苯丙氨酸含量QTL(Scssr03381~scssr07759),与郭蕾蕾[34]在2H染色体上发现的控制大麦抽穗期QTL(Scssr03381~MzE8b)和成熟期QTL(M3E7C~scssr07759)以及杨晓梦等[35]在2H染色体上发现的控制大麦籽粒千粒重QTL(Scssr03381~scssr07759)存在相同的标记;本研究在4H染色体上定位到的控制大麦籽粒苯丙氨酸含量QTL(HVBAMMGB84~BMAG0808)与杨晓梦等[11]在4H染色体上发现的控制大麦籽粒蛋白质含量QTL(BMAG0740~BMAG0808)存在相同的标记;本研究在5H染色体上定位到的控制大麦籽粒苯丙氨酸含量QTL(Scssr03907~GBMS0032)与余春磊[36]在5H染色体上发现的控制大麦籽粒杨梅素含量QTL(MS002~Scssr03907)以及杨 涛[26]在5H染色体上发现的控制大麦籽粒抗性淀粉QTL(Scssr03907~Gm2)存在相同的标记;本研究在7H染色体上定位到的控制大麦籽粒苯丙氨酸含量QTL(GMS056~GBM1297)与杨晓梦等[35]在7H染色体上发现的控制大麦籽粒千粒重QTL(GBM1297~GMS056)存在相同的标记。推测这些性状可能与大麦籽粒苯丙氨酸含量之间存在关联或存在“一因多效”现象。控制大麦籽粒苯丙氨酸含量的QTL除受基因型影响之外,还受环境影响[5]。本研究仅进行了单年单点试验,下一步将进行多年多点试验,以期获得更准确的与苯丙氨酸含量相关的QTL。
