钛网表面Fe3O4/FeS2膜层制备及其类芬顿降解苯酚研究
2021-09-15姜艳丽陈昌举候现金姚忠平姜兆华
姜艳丽,张 笑,李 欣,陈昌举,候现金,姚忠平 ,姜兆华
(1.哈尔滨学院 化学系,哈尔滨 150086; 2.哈尔滨工业大学 化工与化学学院,哈尔滨 150001)
随着经济的快速发展以及工业化程度的不断提高,工业废水以及生活废水的排放量及排放种类也在不断加大,对生态环境及人们的身体健康构成了严重的威胁。其中,酚类化合物因其广泛存在于化工、纺织、医药等行业而导致其在工业废水中普遍存在,而具有简单结构的苯酚因其高毒性、强致癌性而被国内外许多组织机构,如美国环保署、欧盟等列入首要控制污染物黑名单中。为了解决严峻的环境污染问题,迫切要求对废水排放前作深度处理[1]。
尽管传统的废水处理技术如吸附、化学絮凝等手段已被用于苯酚的去除[2],然而,上述方式仅是实现了对苯酚的相转移,无法将其降解去除。而微生物技术作为常见的废水处理技术,尚不能实现对高毒性、 顽固性的有机污染物的降解去除[3]。因而, 迫切需要寻求新型的污水处理技术以实现对高毒性、 持久性有机污染物的矿化去除。
目前,一系列铁基异相芬顿催化剂如FeCu@C[6]、Fe纳米粒子[7]、FeCu双金属氧化物[8]、nFe2O3/MIL-53(Cu)[9]已被用于类芬顿降解有机污染物。尽管通过设计负载型催化剂以及构建多组分纳米杂化催化剂,在一定程度上改善了Fe基催化剂在pH近中性条件下的催化活性。然而,有机污染物降解效率仍较差,即无法在近中性条件下于60 min内实现对有机污染物的快速降解去除。针对零价铁及铁基氧化物异相芬顿催化剂在pH近中性条件下活性低的缺点,研究人员发现,采用硫改性铁氧化物[10-11]以及铁基硫化物[12],可显著改善材料在pH中性乃至碱性条件的催化活性。进一步分析发现,硫改性可在材料表面引入酸性微环境,为芬顿反应提供合适的微环境,进而促进·OH的产生,同时,硫物种可促进Fe3+/Fe2+的氧化还原循环,最终增强材料的类芬顿催化活性。然而,催化剂合成工序复杂、耗时长,且上述所合成的催化剂多以粉体形式存在,需通过过滤或离心实现对其的回收再利用,而繁杂的回收过程及其在回收过程中引起的催化剂损失,提高了整个废水处理成本,因而,限制了其广泛应用。
为此,本文将采用耗时短、成本低且易于大规模合成的电沉积法,在钛网表面沉积Fe3O4/FeS2固定化纳米结构膜层,其在pH=6.0的近中性条件下可在60 min内将98% 35 mg/L的苯酚去除。该催化剂简易的合成手段、固定化的纳米结构膜层特点以及在pH近中性条件下优异的苯酚降解效率,使其在废水处理领域显示出潜在的应用前景。
1 实 验
1.1 化学药品
五水合硫代硫酸钠(Na2S2O3·5H2O)、六水合硫酸亚铁铵((NH4)2Fe(SO4)2·6H2O)、苯酚(C6H6O)、过氧化氢(H2O2, wt.30%)均为分析纯,购自国药集团化学试剂有限公司。实验过程中配制溶液所用水均为去离子水。
1.2 催化剂制备
钛网表面Fe3O4/FeS2固定化纳米结构膜层的制备采用电沉积法实现。将酸洗后长方形钛网(3 cm2)作为工作电极,Pt片及Ag/AgCl电极分别作为对电极与参比电极,在含0.1 mol/L硫酸亚铁铵和不同浓度硫代硫酸钠(0、0.05、0.10、0.20、0.30 mol/L)的电解液中,于恒电位-0.78 V条件下沉积15 min,即可得Fe3O4/FeS2固定化纳米结构膜层。
1.3 催化剂表征
采用美国 FEI 公司的扫描电子显微镜(SEM, NanoLab 600i)观察催化剂微观形貌;采用日本RICOH公司的X-射线衍射仪(XRD, D/Max-2000)分析催化剂的物相组成;采用美国PE公司的X-射线光电子能谱仪(XPS,PHI 5400)表征催化剂表面元素组成及价态。
1.4 降解实验
在30 ℃条件下将所合成的催化剂(2 cm2)浸入50 mL含35 mg/L苯酚的水溶液中,而后加入6 mmol/L的H2O2,进而引发苯酚降解反应,反应一定时间后,移取0.25 mL的降解液,采用4-氨基安替比林分光光度法于510 nm波长下分析苯酚浓度的变化,降解液中铁离子含量分析采用邻菲罗啉分光光度法测定。
2 结果与讨论
2.1 催化剂表征
不同硫源含量下所制备的Fe3O4/FeS2样品的微观形貌如图1所示。

图1 不同硫源含量下制备的Fe3O4/FeS2样品SEM图
图1(a)显示,当电解液中未加入硫源时,一些块状致密物沉积于钛网表面,且表面存在少许微裂缝;而图1(b)显示,当向电解液中引入0.05 mol/L硫源时,样品表面存在大量不太明显的纳米片状结构;图1(c)~(e)显示,随着硫源含量进一步提高,膜层表面纳米片逐渐长大,且相互交联,最终呈现出明显的多孔结构。由纳米片交联形成的多孔结构有利于提高催化剂的比表面积,进而提供更多的活性位点参与苯酚降解,同时,可增强传质,最终改善苯酚降解效率。由EDS能谱仪得到各样品的元素组成如表1所示,研究发现,随着硫源含量的提高,膜层中S与Fe元素含量逐渐提高,说明硫的引入可促进铁物种沉积于钛网表面,而样品中S与Fe含量的提高,有利于改善材料的类芬顿降解苯酚性能;同时,Ti元素含量显著降低,这可能是由于膜层增厚导致采集的基底Ti信号减少所致;另外,硫源的引入可显著提高膜层中O元素的含量,但硫源含量的提高,对O含量无明显影响。
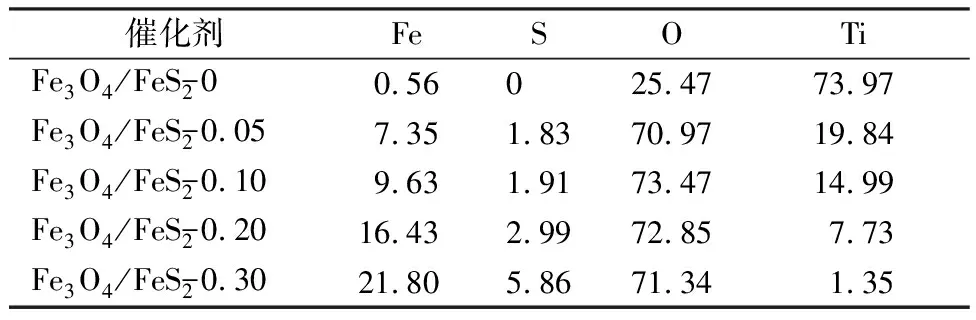
表1 不同硫源含量下制备的Fe3O4/FeS2样品的元素含量(原子分数/%)
不同硫源含量下制备的Fe3O4/FeS2样品的XRD谱图如图2所示。
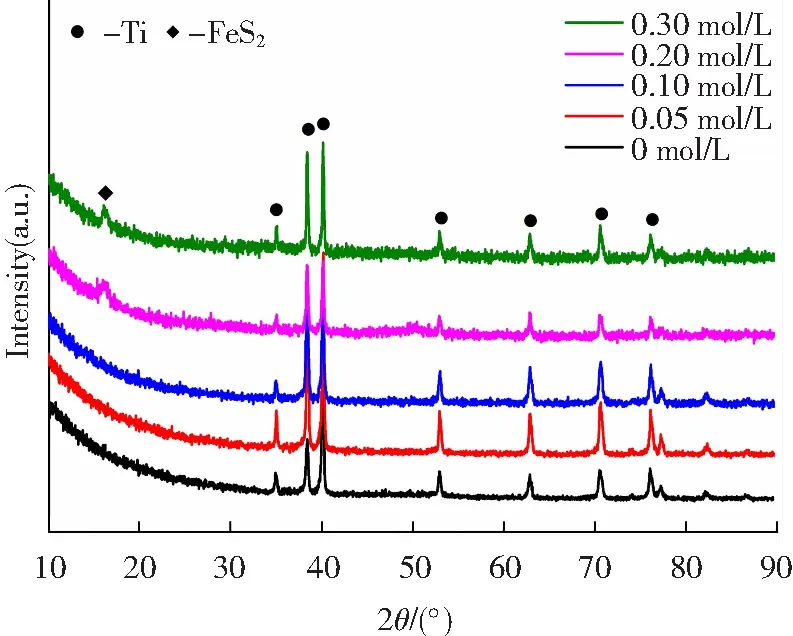
图2 不同硫源含量下制备的Fe3O4/FeS2样品的XRD谱图
图2结果显示:在硫源含量为0、0.05及0.10 mol/L时所合成样品的XRD谱图中仅存在基体钛的衍射峰,这可能是由于膜层结晶性差或膜层较薄使得膜层衍射峰无法显示;当硫源含量为0.20与0.30 mol/L时,除基体钛的衍射峰外,在16.3°处出现一新的衍射峰,分析发现,该峰与标准物FeS2的最强衍射峰相对应,因而,当向电解液中引入硫源后,可导致FeS2物相的产生。为了确定膜层的表面元素组成及价态,在此基础上进行了XPS分析,所得结果如图3所示。
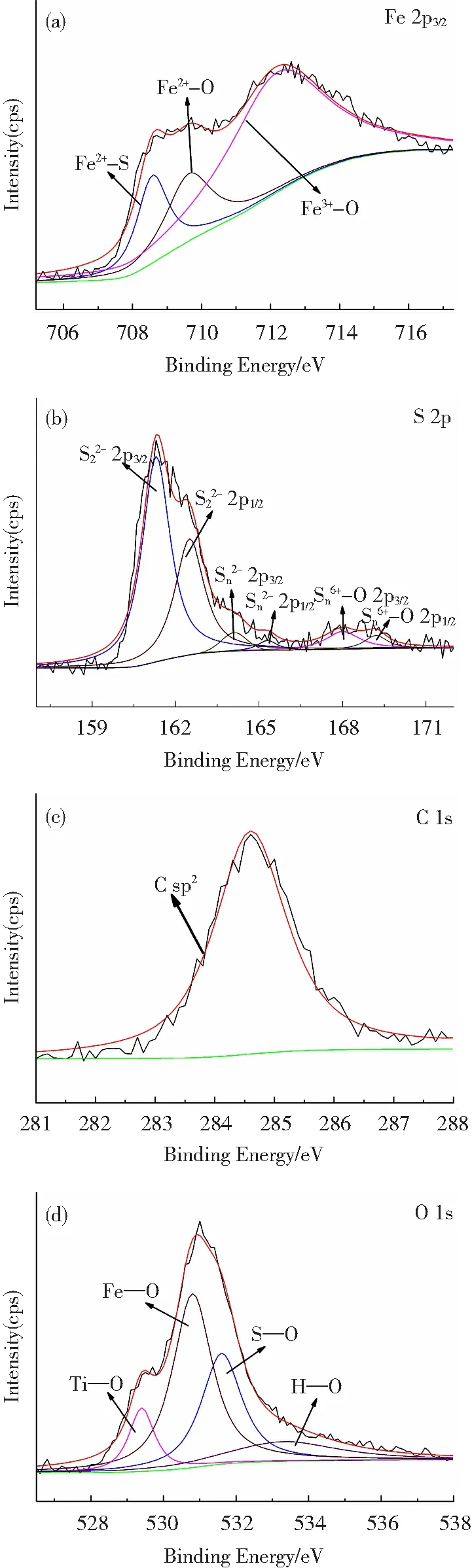
图3 在0.2 mol/L硫源含量下制备的Fe3O4/FeS2样品表面Fe 2p (a)、S 2p (b)、C 1s (c)及O 1s (d)的高分辨XPS谱图
经拟合发现,图3(a)Fe 2p3/2XPS高分辨谱图可拟合出3个峰,位于708.6、709.6和 712.2 eV,其中, 708.6 eV 对应于FeS2中的Fe2+[13],而709.6和 712.3 eV 分别对应于Fe3O4中的Fe2+和 Fe3+[14]。图3(b)S 2p XPS谱图经分峰拟合,可分出6个峰,其中,位于162.3和 163.5 eV的峰分别对应于FeS2中S2-的2p3/2和2p1/2[15],而位于168.5和 169.7 eV的峰对应于SO42-中S6+的2p3/2和2p1/2[16]。图3(c)C 1s XPS谱图在284.6 eV处的主峰,对应于污染碳的特征峰。图3(d)O 1s XPS谱图可分出4个峰,位于529.4、530.7、531.6和533.3 eV,分别归因于Ti—O、Fe—O、S—O以及H—O键[17-19]。
通过SEM、XRD以及XPS分析可知,在含硫源的电解液中所合成的样品物相组成为Fe3O4与FeS2,且膜层表面微观结构为由纳米片彼此交联形成的多孔结构。
电沉积产生Fe3O4与FeS2的过程可能包括以下步骤:1)硫酸亚铁铵在水中按式(1)解离产生NH4+与Fe2+离子;2)NH4+与H2O结合生成NH3·H2O(式(2)),而部分Fe2+被溶液中溶解的氧气氧化(式(3)),进而产生Fe3+;3)剩余Fe2+、Fe3+与产生的NH3·H2O按照式(4)反应生成Fe3O4,而部分Fe2+与S2O32-及H+在电场作用下反应产生FeS2(式(5))。

(1)

(2)

(3)

(4)

(5)
2.2 苯酚降解性能研究
本研究团队前期的研究发现[20],当苯酚质量浓度为35 mg/L以及H2O2含量为6.0 mmol/L时催化剂表现出优异的苯酚降解性能,而酸性pH尽管会提高苯酚降解效率,但金属离子溶出加大会引发二次污染,同时废水处理前的酸性调节会额外增加废水处理成本,因而,直接对未调节pH的废水作降解处理更符合实用化需求及绿色发展理念。基于此,为了评价所合成催化剂的类芬顿降解性能,本文在苯酚质量浓度35 mg/L、pH6.0 (未调节)、H2O2含量6.0 mmol/L以及温度30 ℃条件下,研究了所合成催化剂的苯酚降解性能,所得结果如图4所示。其中,图4(a)为不同硫源含量下在钛网表面沉积的Fe3O4/FeS2样品类芬顿降解苯酚曲线,而图4(b)为其相应的反应动力学曲线,图中C0与C分别表示降解初始时刻与t时刻时苯酚的浓度。图4(a)显示:当电解液中不含有硫源时,所得膜层无法引起溶液中苯酚浓度的变化,即无降解能力;当向电解液中加入0.05 mol/L硫源时,所得膜层具有一定的类芬顿催化活性,可引起苯酚浓度的少许变化;而当进一步提高电解液中硫源含量至0.10 mol/L时,液相中苯酚浓度显著降低,降解150 min,苯酚去除率可达90%以上;当硫源含量增至0.15与0.20 mol/L时,苯酚降解效率进一步提高,两者类芬顿降解60 min,苯酚去除率可达98%以上。而图4(b)反应动力学曲线显示,苯酚降解反应遵循准一级反应动力学过程,且反应分为2个阶段,即诱导期和快速降解期,并且,随着硫源含量的提高,诱导期时间显著缩短且斜率提高,同时,快速降解期的斜率也显著提高,在硫源含量为0.10与0.20 mol/L的条件下,所制备的催化剂降解苯酚的反应动力学常数(k)分别为 0.036 9与0.077 3 min-1。

图4 不同硫源浓度下制备的Fe3O4/FeS2降解苯酚曲线(a)及在0.10与0.20 mol/L硫源下合成的Fe3O4/FeS2降解苯酚的动力学曲线(b)
不同硫源含量下所得膜层降解苯酚结束后的铁溶出量如图5所示,研究发现,除在0.05 mol/L硫源含量下所合成的催化剂表现出最低的铁溶出(0.16 mg/L)外,其余条件下所得催化剂均表现出高的铁溶出量,在硫源含量为0.10、0.20与0.30 mol/L条件下制备的催化剂降解苯酚反应结束后,铁溶出量分别为4.02、2.25与3.36 mg/L。
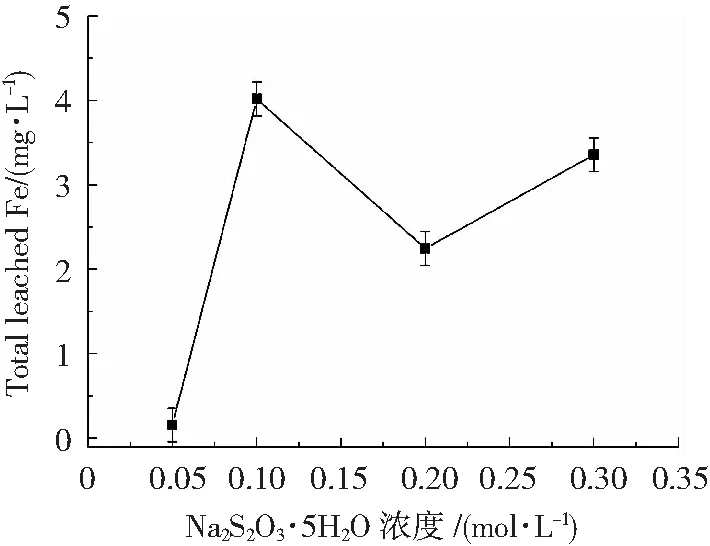
图5 不同硫源下制备的Fe3O4/FeS2首次降解苯酚后的铁溶出量
基于上述研究结果并结合文献[21],提出了Fe3O4/FeS2膜层类芬顿降解苯酚的反应机制,结果如下。
(6)
(7)
(8)
(9)

(10)

(11)

(12)

(13)
(14)
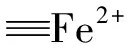
硫源含量的提高,使得所合成Fe3O4/FeS2膜层催化活化显著改善的原因可归结于以下几方面:1)硫源含量提高,使得膜层呈纳米片间相互交联形成的多孔网状结构,进而显著提高了材料的比表面积,而比表面积提高可增强传质,同时提供更多的活性位点参与苯酚降解;2)随着硫源含量的提高,膜层中Fe、S元素含量也显著增大,而Fe位点可作为催化活性位,硫位点可促进Fe3+/Fe2+的氧化还原循环,同时,以硫酸根形式存在的硫物种可为类芬顿反应提高合适的酸性微环境,进而提高羟基自由基的产生速率及产生量,达到显著改善该催化剂在近中性条件下催化活性的目的[22-23]。
催化剂的稳定性是评价其性能优劣的重要指标之一。基于此,在pH6.0、 H2O2含量6 mmol/L、苯酚初始质量浓度35 mg/L、反应温度30 ℃条件下,研究了在硫源含量为0.20 mol/L下所合成的Fe3O4/FeS2催化剂的稳定性,结果如图6所示。研究发现,与第1次降解相比,第2次苯酚降解效率显著降低,即降解90 min后苯酚去除率仅为10%,因而,所合成催化剂表现出较差的稳定性,这可能是由于苯酚降解中存在较大的铁溶出,导致催化剂表面活性位点显著降低引起的。在后续的研究中将通过碳包覆、界面调控等措施来进一步改善催化剂的稳定性。
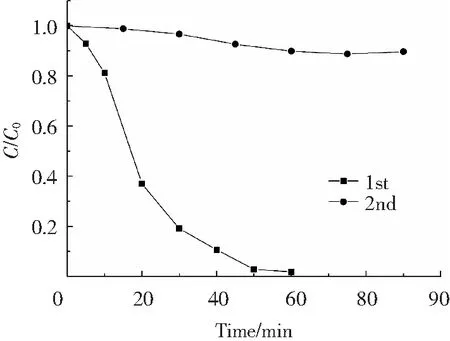
图6 在硫源含量为0.2 mol/L条件下制备的Fe3O4/FeS2降解苯酚循环实验
3 结 论
本文采用耗时短、成本低且易于大规模合成的电沉积技术在钛网上合成了Fe3O4/FeS2固定化膜层,膜层表面呈现纳米片间相互交联形成的多孔网状结构。该催化剂显示出优异的类芬顿降解苯酚性能,即在pH 6.0、H2O2含量6 mmol/L、苯酚初始质量浓度 35 mg/L、反应温度30 ℃的条件下降解60 min,可将98%的35 mg/L的苯酚去除。
