基于内皮细胞/周细胞构建大鼠视网膜血管新生体外三维模型
2021-09-15刘光辉杨田野洪雅军潘铭东徐朝阳
刘光辉,杨田野,洪雅军,王 航,潘铭东,孟 春,徐朝阳
0引言
视网膜新生血管性疾病是临床常见的眼病,如糖尿病视网膜病变(diabetic retinopathy,DR)、早产儿视网膜病变(retinopathy of prematurity,ROP)、年龄相关性黄斑病变(age-related macular degeneration,ARMD)等,其病理过程中均涉及由视网膜微血管内皮细胞(endothelial cells,ECs)和视网膜微血管周细胞(retinal microvascular pericytes,RMPs)共同参与的血管新生(angiogenesis)。构建体外血管新生模型是探索血管新生的生理病理过程、研究新生血管性疾病重要的工具。截至目前,已有不少学者建立了体外三维血管模型[1-2],但是大都仅以单一的血管ECs为基础,未能充分模拟ECs和RMPs相互配合的血管新生过程。本研究拟采用ECs和RMPs在内的全微血管成分细胞构建大鼠视网膜血管体外三维培养模型,以便为视网膜新生血管性疾病的机制研究提供一个有力的工具。
1材料和方法
1.1材料
1.1.1实验动物3周龄健康清洁级雄性初断乳SD大鼠20只,体质量40±5g,购买自上海斯莱克实验动物有限责任公司[许可证号SCXK(沪)2007-0005]。饲养环境温度为21℃~25℃,相对湿度为50%~55%。普通颗粒饲料喂养,自由饮水,12h/12h明暗交替光照。实验动物的使用遵循国家科学技术委员会1988年颁布的《实验动物管理条例》,并经过福州大学生物科学与工程学院实验动物伦理委员会批准。
1.1.2主要试剂及仪器内皮细胞专用培养基(endothelial cell medium,ECM,美国Scien Cell公司);DMEM培养基、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素双抗(10kU/mL青霉素+10mg/mL链霉素,美国HyClone公司);细胞示踪剂(美国Molecular Probes公司);Ⅰ型胶原酶(美国Sigma公司);人工基质胶Matrigel(美国BD公司);血管内皮生长因子A(vascular endothelial growth factor A, VEGF-A)抗体(武汉爱博泰克生物);24孔板及培养皿(美国Corning公司);倒置荧光显微镜(日本Nikon公司);CO2细胞培养箱(美国NUARE公司)。
1.2方法
1.2.1ECs分离培养按参考文献[3]描述方法分离、纯化、培养、鉴定大鼠视网膜微血管ECs。大鼠经乙醚麻醉后用颈椎脱臼法处死,摘取眼球转移至75%乙醇中浸泡1min,用预冷的PBS(含有1%青霉素-链霉素双抗)洗3遍。分离剥出视网膜,剪成1mm3大小的组织块。先用含有质量分数0.25%胰蛋白酶消化10min,然后再用含有质量分数0.2% Ⅰ型胶原酶消化20min。用ECM培养基重悬组织接种于培养瓶中,接种在明胶包被的培养瓶中,每3d换液1次。选用第3~7代经鉴定验证的ECs开展后续实验。
1.2.2RMPs分离培养按照我们之前研发的方法分离、纯化、培养、鉴定大鼠RMPs[4]。如前述,将1mm3大小的视网膜组织块先用含有质量分数0.25%胰蛋白酶消化10min,然后再用含有质量分数0.2% Ⅰ型胶原酶消化15min。用含有体积分数20% FBS的DMEM-L培养基重悬组织接种于培养瓶中,每3d换液1次。选用第3~7代经鉴定后的RMPs开展后续实验。
1.2.3三维共培养将Matrigel、移液管和24孔培养板放置4℃冰箱,预冷过夜。按照说明书稀释细胞示踪剂,分别用红色和绿色细胞示踪剂孵育ECs和RMPs 24h。将Matrigel用ECM培养基按照1∶1进行稀释,24孔板每个孔加入400μL稀释后的Matrigel胶,置入细胞培养箱孵育30min以上,待Matrigel胶凝固后备用。将标记后的细胞用PBS洗涤3次,消化成细胞悬液,将细胞浓度调至2×105cell/mL。将ECs和RMPs按9∶1进行混合,每孔加入400μL细胞悬液,置于细胞培养箱培养。倒置显微镜下动态观察。
1.2.4酶联免疫法检测在ECs/RMPs共培养体系培养12、24、48h后,收集细胞培养的上清,按照酶联免疫检测试剂盒说明书操作,检测上清液中VEGF-A的表达水平。
统计学分析:采用统计学软件SPSS 21.0进行数据处理,采用单因素重复测量方差分析进行检验,两两比较采用Bonferroni法。P<0.05为差异具有统计学意义。
2结果
2.1ECs/RMPs三维培养生长情况混合接种培养12h时,可以观察到RMPs能被ECs招募,聚集成为大小不等的细胞团块,并有部分ECs增殖与RMPs共同形成简单的条索样结构。24h时,ECs/RMPs共同形成具有复杂结构的血管样条索网。观察时,条索网各部分处于不同的焦平面,提示为三维立体网状结构。之后,血管样条索网逐渐出现崩解。48h时,网状三维结构已经出现明显崩解,仅保持少量不完整的简单的网状结构。至72h时,血管样条索网完全崩解,仅残留少量小的离散的细胞团,见图1。
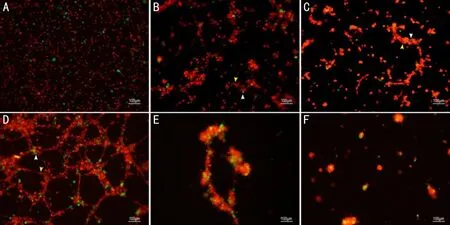
图1 ECs/RMPs三维共培养 A:ECs/RMPs以9∶1比例接种于三维共培养系统,ECs以红色细胞示踪剂标记,RMPs以绿色细胞示踪剂标记;B、C:12h时,ECs(黄色箭头)能招募RMPs(白色箭头)成为细胞团,并有部分形成简单的条索样结构;D:24h时,ECs/RMPs能形成广泛复杂的具有腔隙的三维网状结构,三维结构以ECs(黄色箭头)为主,RMPs(白色箭头)镶嵌其中;E:48h时,三维结构出现明显崩解,仅保持少量不完整的简单网状结构;F:72h时,三维结构完全崩解,仅残留少量小的离散的细胞团。
2.2三维培养时VEGF-A的表达水平在血管网逐渐发育完善过程中,VEGF-A表达量上升。血管网出现崩解时,VEGF-A表达量下降。检查显示,培养12、24、48h时的上清液中VEGF-A表达量分别为1.757±0.249、3.216±0.510、0.700±0.257μg/L,差异有统计学意义(F=82.802,P<0.01)。培养24h时的上清液中VEGF-A表达量较12h表达量显著增高,48h时的上清液中VEGF-A表达量较12、24h表达量均显著降低,差异均有统计学意义(P<0.01),见图2。
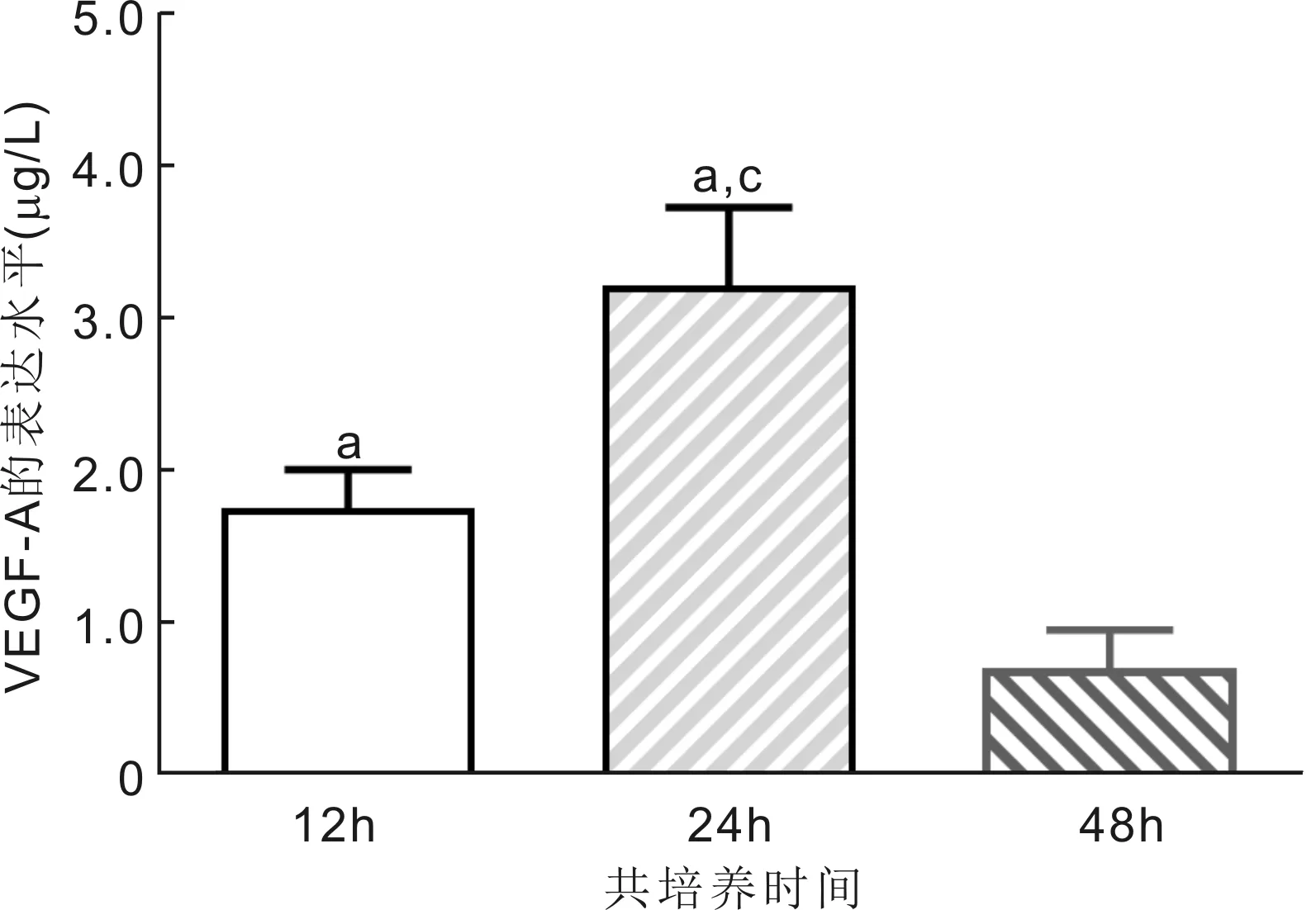
图2 三维培养不同时间点上清液中VEGF-A的表达水平 aP<0.05 vs 48h;cP<0.05 vs 12h。
3讨论
血管新生指在原有小静脉或其他毛细血管的基础上,ECs以芽生或非芽生的形式并在周细胞的配合下生成新生血管的过程,其一般包括基质降解、ECs移行、ECs增殖、ECs管道化分支形成血管环和新的基底膜形成等步骤[5-6]。血管新生是血管从少到多的生物学过程,常见于人体各种组织器官的生理或病理活动中,如视网膜、角膜等。
视网膜是人体微血管密度最高的组织之一,常因缺血、缺氧或其他因素诱发血管新生,导致视网膜新生血管性疾病,如DR、ROP、ARMD等。视网膜新生血管性疾病是眼科临床的致盲性疾病,相关研究是目前眼科研究的热点方向之一。在体内研究中,动物模型存在直接观察不便等不利因素,研究观察难度大。而体外三维培养既能够模拟ECs出芽、移行、增殖、分化等体内血管生成具体过程[7],又具有易于观察的优势,更具有研究价值。因此,构建简便、可靠、稳定的血管新生体外三维培养模型对于开展视网膜新生血管性疾病的基础研究工作具有重要的意义。
体外血管新生三维模型构建起始于1980年代。在1980年,Folkman等[8]首次观察到ECs在体外培养系统中能够形成血管样条索的趋势。Martins等[9]证实三维培养中的ECs生长与体内血管生成更为类似。其在硬度适中的胶原类基质中可以分化形成静态管状[10]。鼠尾胶、血浆凝块、纤维蛋白、水凝胶、Matrigel等均可以用于ECs三维培养的基质[11-12]。其中Matrigel是一种从EHS小鼠肿瘤中提取的细胞外基质混合物,含有层黏连蛋白、Ⅳ型胶原、巢蛋白、肝素糖蛋白、生长因子和基质金属蛋白酶等多种成分[13]。其在低温状态下呈液态;在37℃条件下,能聚合形成具有生物学活性的三维基质,模拟体内细胞基底膜的结构、组成、物理特性和功能。由于Matrigel成分与哺乳动物细胞基底膜成分类似,故常为体外三维培养研究所选用。
在种子细胞来源方面,学者们已经开发了多种来源的ECs用于血管新生体外三维模型的培养,如源自人、啮齿类动物、牛、犬等;所取ECs的血管如脐静脉、颈静脉、主动脉等处大血管及真皮等处微血管[2]。其中,人脐静脉ECs因为来源广泛、分离简单而被广泛应用。此外,内皮祖细胞见诸于培养报道[14]。然而需知,不同组织血管来源的ECs的生物学行为存在差异,在血管生成的潜能、血管张力和免疫耐受等方面表现不同[15],需要合理、审慎地选择培养种子细胞以适用不同研究目的需要。同时,血管新生所形成的成熟新生血管除了ECs这一主体细胞之外,还有一种重要的细胞成分——周细胞。周细胞是正常微血管管壁的构成细胞,在体内血管新生时具有血管基质降解、控制ECs增殖、调控新生血管生长的功能[16]。在血管新生体外三维培养模型构建时,我们需要考虑周细胞对血管新生复杂而多样的作用,合理、完善的血管新生体外三维培养模型应该包含以上两种细胞,而这正是既往研究所欠缺的——其往往仅采用单一的ECs作为种子细胞。在本次研究中,我们首次基于实验室最常用实验动物大鼠的视网膜微血管ECs作为主要种子细胞进行培养,以适用视网膜新生血管性疾病模型的需要。并加入了适量的RMPs进行联合培养,种子细胞较既往研究更为全面。本次研究结果显示ECs在培养的过程中能招募RMPs,彼此共同形成血管样条索结构。这一现象与体内血管新生时ECs招募RMPs形成新生血管的生物学行为类似[5-6],提示这种三维培养方式或将能更充分地模拟体内视网膜血管新生的真实生理或病理过程。
在培养方法方面,学者们既往提出了多种不同的方案,如动脉环培养法、表面培养法、夹心培养法、混和培养法、微载体培养法等,各种方法具有各自的优缺点[1],需要根据研究目的选择适用的方法。其中表面培养法指将种子细胞添加在凝固的基质凝胶表面进行培养的方法,能够较好模拟体内微血管成分细胞降解基质、相互招募形成新生血管的过程,具有形成管状、网状结构快的特点。本次研究选用表面培养法进行了培养,研究发现孵育后12h即可以形成简单的血管样条索,与既往单纯采用ECs作为种子细胞的约48h才能检测到管腔样结构的研究[17]要快,能够满足快速实验的需要。
如何判定模型的有效性是血管新生体外三维培养模型一个关键的所在。从生理学角度而言,理想的血管新生体外三维模型应能诠释体内有代表性的血管新生过程:原有微血管充血,ECs、周细胞激活;基底膜降解;ECs移行,穿过基底膜,向刺激原运动;ECs和周细胞迁移、分裂、增生;形成新的毛细血管腔,由周细胞围绕;新的基底膜形成,层黏连蛋白发育;毛细血管袢及网形成[5-6]。Folkman在体外首次观察到血管新生时,发现ECs形成的毛细血管样结构中存在腔隙[8],这种现象能被光镜所观察。后续血管新生体外三维培养研究报道参考了该报道,均以毛细血管样结构中是否存在腔隙来判定培养模型的有效性。在本次研究中,我们观察到12h时,ECs能招募RMPs成为细胞团,并形成简单的条索样结构。之后进程明显加速,在24h时能形成广泛复杂的具有腔隙的三维网状结构。三维结构以ECs为主,RMPs镶嵌其中,这种细胞构架与体内视网膜微血管结构类似。这表明本研究基于全微血管细胞成分(ECs和RMPs)所构建的血管新生体外三维培养模型具有充分的有效性。
同时,我们也观察到本次研究中三维网状血管样条索持续的时间较短,在孵育的第24h达到顶峰状态,之后开始出现崩解,48h时只保持少量不完整的简单的网状结构,72h后仅残留少量小的离散的细胞团。这一现象除与培养基内供细胞生存、增殖使用的营养物质有限相关外,还可能与VEGF等促血管生成的细胞因子含量下降相关[18]。VEGF是一种分泌型蛋白,可由ECs分泌,是血管新生过程中重要的细胞因子[19]。本研究观察到,随着ECs/RMPs三维血管样条索网的发生,VEGF-A的表达量升高。网状结构退化时,VEGF-A的表达量下降。这一结果表明VEGF-A在三维培养模型构建中参与了血管样条索网的生成过程。但是血管新生是受多重因素共同影响的复杂过程,如何维持三维血管样条索网的存在时间有待进一步研究。
本研究成功基于微血管全成分细胞ECs和RMPs构建了大鼠视网膜血管新生体外三维培养模型,可以作为视网膜新生血管相关性疾病体外研究的工具。
