海南17?a宿根巴西蕉园土壤微生物特征及土壤pH周年变化特征分析
2021-09-14郭素霞程志号孙佩光孙长君郭刚吴琼
郭素霞 程志号 孙佩光 孙长君 郭刚 吴琼


摘 要:香蕉是全球性的大宗经济水果,我国是香蕉生产大国也是消费大国,但产量和品质不能满足需求,每年仍需大量进口。香蕉枯萎病是影响我国香蕉产能的主要因素。巴西蕉在我国曾广泛种植,但易感香蕉枯萎病,罕有宿根蕉园。宿根蕉园栽培模式在成本控制、产期调节、环境友好等方面有巨大优势。前期研究结果显示,土壤pH以及土壤菌群与香蕉枯萎病的发生有紧密联系。本文以海南临高皇桐镇的17 a宿根巴西蕉园为样本,对该宿根蕉园、附近轮作蕉园及新开垦蕉园全生育期土壤pH及香蕉枯萎病孢子数量进行动态监测,结合土壤菌群宏基因组测序的方法对土壤中的菌群特征进行了初步探索。结果表明:宿根蕉园土壤pH高于轮作蕉园和新开垦蕉园,其pH周年变化幅度低于轮作蕉园和新开垦蕉园;宿根蕉园土壤中香蕉枯萎病孢子数目低于轮作蕉园和新开垦蕉园;在土壤细菌和真菌的菌群多样性和丰度方面,宿根蕉园均高于轮作蕉园和新开垦蕉园;宿根蕉园在全营养菌门、农杆菌门、毛霉亚门等11个细菌门级和6个真菌门级分类单位上与轮作和新垦蕉园存在显著差异;宿根蕉园在微单孢菌、芽胞杆菌、角菌根菌等土壤特征种群方面显著不同于其他2个蕉园;功能丰度热图显示,宿根蕉园土壤细菌和真菌与轮作蕉园、新开垦蕉园均有显著差异。代谢通路基因丰度分析方面显示,轮作蕉园和新垦蕉园土壤细菌在生物合成和次级代谢、转录、碳代谢、膜转运等通路明显活跃,宿根蕉园土壤真菌在细胞迁移、细胞生长和死亡、信号传导、核酸代谢、蛋白折叠储运和降解等通路显著活跃。本研究结果为阐明香蕉宿根栽培模式的内部机理奠定基础,也为废弃蕉园改造提供新的參考依据。
关键词:巴西蕉;宿根蕉园;土壤菌群特征;香蕉枯萎病;pH
Abstract: Banana is one of the most widely planted fruits in the world and is a staple for millions of people worldwide. China is a large banana production country but still needs to import huge amounts of banana to meet the demand. Brazil banana has been widely planted in China but it is very susceptible to Fusarium wilt (Panama disease). Ratoon banana filed (RTF) is common in foreign country and famous for its low cost, easy production period regulation and environmental friendliness. RTF is seldom used in China. In this study, the microbial community structure of 17-year Lingao RTF banana field was characterized through ITS and 16S rRNA gene sequencing and the reclaim banana field (RCF) and banana cane rotation field (BCF) nearby were used as the control. The results showed that the diversity and abundance of soil bacteria and fungi in RTF were significantly higher than that of RCF and BCF. The classification of soil microbial species showed that RTF were significantly different among 11 bacteria and 6 fungal taxonomic units such as Agrobacterium tumefaciens, actinomycetes and so on. RTF soil characteristic microorganism showed significantly different with RCF and BCF in Micromonospora, Bacillus and Ceratobasidium. The functional abundance heat map showed that the soil bacterial activity in RTF was significantly lower than that of RCF and BCF, while the fungal activity was significantly higher. Gene abundance analysis of metabolic pathways showed that soil bacteria in RCF and BCF were significantly more active in biosynthesis and secondary metabolism, transcription, carbon metabolism, membrane transfer and other pathways, while soil fungi in RTF was significantly more active in cell migration, cell growth and death, signal transduction, nucleic acid metabolism, protein folding, storage, transportation and degradation. Through the analysis of soil microbial characteristics of RTF, it would lay a foundation for clarifying the internal mechanism of banana ratoon model, and also provide a new reference for the renew of abandoned banana garden.
Keywords: Brazil banana; ratoon banana filed; soil flora characteristics; Fusarium wilt of banana; pH
香蕉是全球产量最高的热带水果,我国是香蕉生产大国也是消费大国,但国内的产量和品质不能满足需求,约有一半的香蕉需要进口[1]。香蕉枯萎病是土传性病害,近距离传播途径以土壤、水流为主,远距离传播通过带病芽、苗,研究发现其病原菌在无寄主的情况下仍可在土壤中存活30 a,因此极难防治,目前尚无理想的防治药剂和防治方法[2]。香蕉枯萎病对我国香蕉产业冲击巨大,导致大量蕉园荒废,不适宜继续种植香蕉。对于废弃蕉园,通过轮作甘蔗[3-5]、辣椒[6-7]、水稻[8-10],或通过套种韭菜[11-13]、花生[14]等,能有效降低土壤香蕉枯萎病孢子数量,实现废弃蕉园重新复垦种植香蕉。此外通过改种抗病品种,如‘南天黄[15-16]、‘宝岛蕉[17]等在一定程度上可以减轻香蕉枯萎病的危害。同时,通过新开垦蕉园的方式,也能有效降低香蕉枯萎病的爆发,但新开垦蕉园的潜力也比较有限。虽然通过轮作、土壤改良、更换抗病品种香蕉等方式,能使部分蕉园恢复种植,但由于成本居高不下、技术难度大、操作繁琐等原因,限制了相关技术的应用和推广。基于上述多方面原因,导致国内香蕉种植面积近5 a来持续下滑[18]。据报道,国外存在大量的宿根蕉园,部分宿根蕉园能连作70 a[19]。香蕉宿根种植在种植成本、抗病害、调节产期、产蕉的产量和质量上比国内现有种植模式有非常明显的优势[19-20],但目前国内对于香蕉宿根连作模式的研究报道还非常少见。
已有研究表明,蕉园土壤pH和土壤菌群与蕉园香蕉枯萎病发生有非常紧密的关系。对海南23个香蕉园土壤微生物数量与18个土壤因子的相关性研究发现,蕉园土壤5~30 cm土层可培养微生物的区系依次为细菌、放线菌、真菌;有效Fe、有效P、土壤pH分别是影响蕉园土壤真菌数量、放线菌数量和土壤微生物总数的关键因子[21]。研究表明,土壤pH分别与枯萎病发病率、病情指数呈极显著负相关[22],石灰、木薯渣、蔗渣等的施用提高了土壤pH,可以降低尖孢镰刀菌生理小种的致病力[23]。先前研究发现,虽然不同蕉园土壤理化性质及养分含量存在很大差异,但与香蕉枯萎病的发生无直接相关性;蕉园土壤微生物数量的改变是香蕉枯萎病发病的重要特征,枯萎病危害程度为中度、重度的土壤中细菌和放线菌数量明显低于危害程度为轻度和无危害的土壤,危害程度为中度、重度的土壤真菌数量明显高于危害程度为轻度和无危害的土壤[24]。
植物土传病害的生物防治与土壤微生物群落关系紧密,一定程度上依赖于调控土壤微生物群落及其功能多样性,土壤微生物群落结构越丰富,物种多样性越高,对病原菌的综合抗性能力越强[25]。对于土壤微生物群落特征的研究主要有下面几种方法:基于可培养微生物形态学和营养特征进行分离培养的方法,如平板稀释涂布法[26];基于可培养微生物化学成分差异进行分析的方法,如脂肪酸谱图法等[27];基于土壤微生物DNA的分子生物学技术,如高通量测序法的宏基因组学技术[28]。通过土壤微生物群落特征与土传病害发生之间的关系进行探索,可以发现一些可能与病害发生相关的微生物类群和相关表征通路,为更好地阐明土壤微生物变化对土传病害的影响提供了新的思路及方法[29]。
巴西蕉是我国早期引进的香蕉品种,综合性状明显优于其他主推品种,但由于极易感香蕉枯萎病导致种植面积大量萎缩。对海南省临高縣皇桐镇的一个面积达4 hm2的17 a宿根巴西蕉园经过多年田间跟踪调查发现,全蕉园未见真菌型香蕉枯萎病发生,蕉园香蕉品质特别是可溶性糖等的含量显著高于附近蕉园,蕉园成本也显著低于附近蕉园。该蕉园是国内难得的研究香蕉宿根模式的样本。本文以该宿根巴西蕉园、附近轮作蕉园及新开垦蕉园的土壤为材料,通过对土壤全年香蕉枯萎病孢子数目的动态统计,结合土壤菌群宏基因组测序的方法,对3处土壤菌群特征进行分析,探求不同种植模式下土壤菌群与香蕉枯萎病发生的关系,为解析宿根巴西蕉园模式成功运行的原因奠定基础,也为我国未来香蕉产业发展提供新思路和新方法。
1 材料与方法
1.1 材料
17 a宿根巴西蕉(Musa acuminata Colla)蕉园位于海南省临高县皇桐镇武维村,以该蕉园附近原种植香蕉,但由于枯萎病爆发,已改种3 a甘蔗的废弃蕉园(记为轮作蕉园)土样为对照(CK);武维村17 a宿根巴西蕉园附近新开垦土地种植巴西蕉园(记为新开垦蕉园),土样记为T1;武维村17 a宿根巴西蕉园(记为宿根蕉园)土样记为T2。各蕉园香蕉品种均为巴西蕉。
1.2 方法
1.2.1 土壤取样 海南蕉园田间香蕉枯萎病爆发时间集中在5~10片叶苗期和抽蕾期,蕉园留芽和定植的时间分别为2018年7月和4月,土壤pH和香蕉枯萎病孢子数目检测每个月取样1次,土壤菌群特征分析取样时间为2019年3月夏蕉抽蕾前。取样点尽量避免路边和行道及其附近,以减少边际效应。取样前刨去表层有机质含量丰富的表层土3~5 cm,按照“S”形采样路线,随机选取5个点进行取样,用采样器(直径为2.5 cm)采集0~20 cm耕作层土壤,取其下表层土壤检测土壤pH、肥力及香蕉枯萎病菌孢子含量,深层土壤检测土壤菌群[30]。每个取样点3次重复,各小区采集样品中随机取5份土壤样品破碎混匀,冰盒带回实验室后,取出一部分用于香蕉枯萎病菌孢子含量检测,留取部分微生物菌群分析的样品于-80 ℃冰箱保存备用。
1.2.2 土壤pH及香蕉枯萎病孢子数目检测 土壤pH检测参考国家标准GB 7859—1987;通过平板法对蕉园土壤香蕉枯萎病菌孢子含量进行检测,具体方法参考景晓辉等[31]、韩宝坤等[32]的文献。
1.2.3 土壤菌群16S rDNA测序和ITS DNA测序 土壤样品采集、制备和贮存参考国家标准GB 7830—2011;通过HiPure Soil DNA Kits(美吉生物,广州,中国)抽提土壤微生物总DNA含量;利用NanoDrop 2000和1%琼脂糖凝胶电泳检测DNA提取质量和浓度。用土壤细菌16S rDNA(V3-V4)基因的通用PCR引物:341F: 5-CCTACGGGNGGCWGCAG-3,806R: 5-GGA CTACHVGGGTATCTAAT-3;ITS rDNA测序(ITS2)基因的通用PCR引物:KYO2F: 5-GATGAAGAACGYAGYRAA-3,ITS4RT: 5- CCTCCGCTTATTGATATGC-3。经过2轮PCR扩增后,使用AM Pure XP Beads对第2轮扩增产物进行纯化,用ABI Step One Plus Real-Time PCR System(Life Technologies,美国)定量后,使用NovaSeq 6000的PE250模式进行序列测定。土壤样品文库的构建、测序以及数据分析委托广州基迪奥生物科技有限公司进行。
1.2.4 土壤菌群特征分析 对原始数据进行过滤、拼接并去除嵌合体后得到最终有效数据。使用QIIME(Version 1.91)对最终有效数据进行聚类,并基于细菌和真菌分类数据库进行注释和计算α多样性指数。使用Muscle(Version 3.8.31)软件进行β多样性分析,通过PICRUSt进行群落功能预测。在有效分组存在的情况下,进行组间差异比较及差异检验。
2 结果与分析
2.1 宿根蕉园土壤pH和香蕉枯萎病菌孢子含量
蕉园土壤香蕉枯萎病孢子数目与香蕉枯萎病爆发的几率以及发生的强度密切相关。本研究检测了宿根蕉园、轮作蕉园、新开垦蕉园的香蕉完整生长发育周期的土壤香蕉枯萎病孢子数目,3种蕉园的孢子数均在3月、8月、9月、10月相对含量较高(图1A)。进一步对比分析表明,3种蕉园的孢子数目之间存在极显著差异:宿根蕉园土壤香蕉尖孢镰刀菌数目最少,平均为(622±144)个/g土样,显著低于轮作蕉园和新垦蕉园;新开垦的蕉园土壤香蕉尖孢镰刀菌数目高于宿根蕉园,但低于轮作蕉园,为(884±119)个/g土样;轮作蕉园土壤香蕉枯萎病病菌孢子尖孢镰刀菌数目含量最高,平均为(1639±198)个/g土样(图1B)。
蕉园土壤pH也是影响香蕉枯萎病爆发的重要因素。本研究對宿根蕉园、轮作蕉园、新开垦蕉园的香蕉完整生长发育周期的土壤pH进行了动态监测(图2A),比较分析发现:宿根蕉园土壤pH最高,平均为5.91±0.13;新开垦蕉园土壤pH最低,平均为5.51±0.12,而轮作蕉园pH介于二者之间,为5.69±0.13(图2B)。
2.2 3种蕉园土壤微生物16S和ITS的OTU分析
OTU(operational taxonomic units)是指为了方便在系统发生学或群体遗传学研究,人为设定的分类单元。利用effective tags之间的序列相似性关系,可以将不同的tags聚类成OTU。获得OTU之后,利用相关软件,根据其丰度和序列信息,能够逐一开展物种注释、群落多样性、组间差异等多种核心分析。为了研究样品物种的组成多样性信息,用Uparse软件对所有样品的全部effective tags序列聚类,默认提供以97%的一致性将序列聚类成为OTUs结果,并计算出每个OTU在各样品中的Tags绝对丰度和相对信息。在OTUs构建过程中,对不同样品的effective tags数据,低频数的Tags数据和Tags注释数据等信息进行初步统计。通过对土壤微生物16S和ITS的测序结果进行统计,结果如图3所示:3种蕉园土壤样本的检测序列一致性和丰度均比较高,达到相关要求,可进行下一步分析。通过韦恩聚类分析各蕉园土壤的物种组成与分度进一步发现,各土壤采集点间多态性比较高,其中宿根蕉园土壤多态性最高。
2.3 3种蕉园土壤微生物物种的16S和ITS测序分析
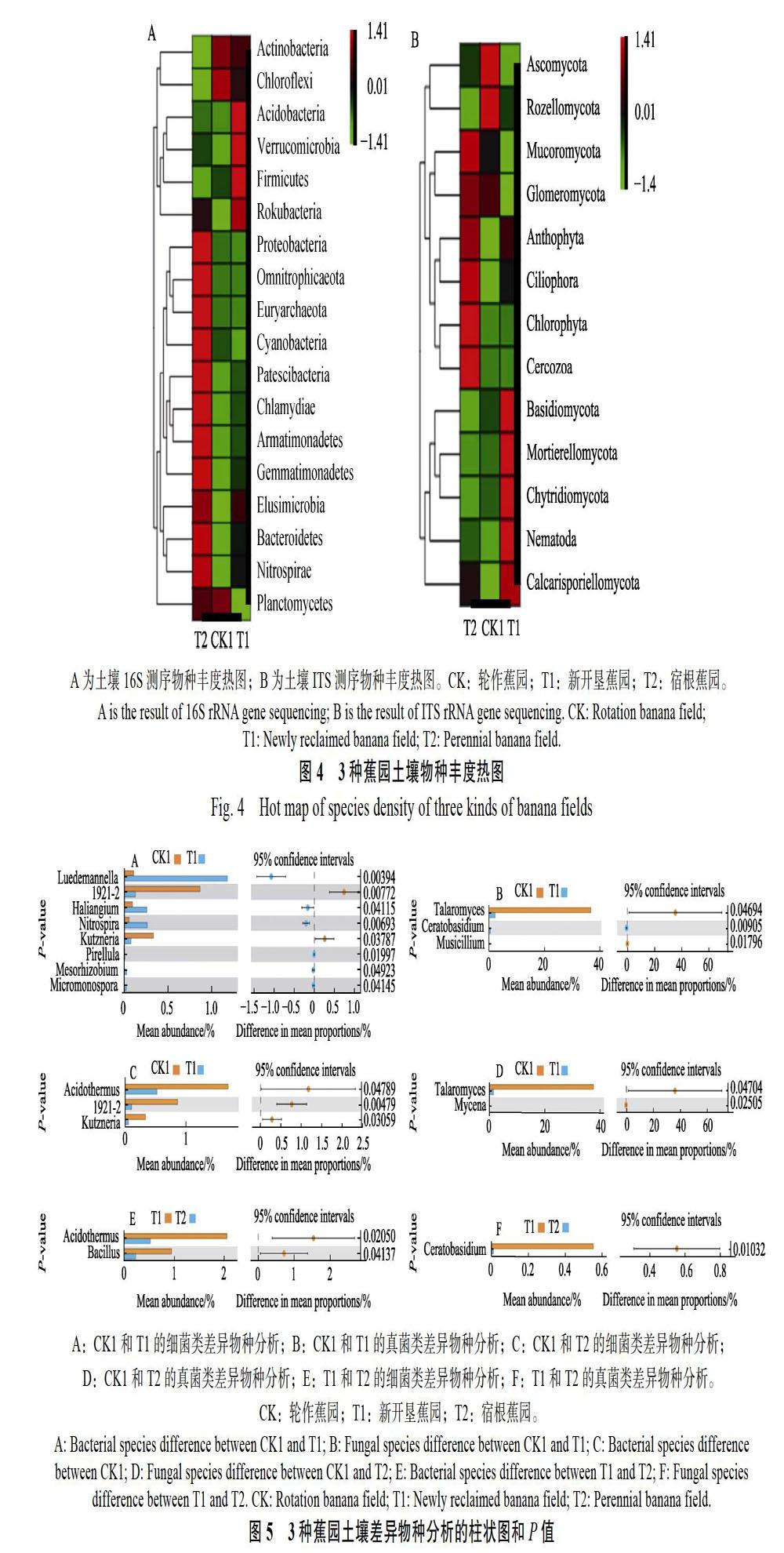
通过物种分类也可以分析不同样本的物种组成与物种丰度,用于比较不同样本的物种差异,结合物种分布堆叠图、物种丰度热图和差异物种分析等角度来分析不同样本的物种差异性。通过16S测序,物种丰度热图分析发现,新开垦蕉园与轮作蕉园更接近,宿根蕉园与轮作蕉园和新开垦蕉园均有显著差异;与新开垦蕉园和宿根蕉园相比,轮作蕉园在放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)2个门有明显富集;相对于轮作蕉园和宿根蕉园,新开垦蕉园在酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)有明显富集;与轮作蕉园和新开垦蕉园相比,宿根蕉园在变形菌门(Proteobacteria)、广古菌门(Euryarchaeota)、蓝细菌(Cyanobacteria)等11个门(属)有明显富集(图4A)。通过ITS测序,物种丰度热图分析发现,新开垦蕉园与轮作蕉园更接近,宿根蕉园与轮作蕉园和新开垦蕉园均有显著差异;与新开垦蕉园和宿根蕉园相比,轮作蕉园在子囊菌门(Ascomycota)、罗兹菌门(Rozellomycota)有明显富集;相对于轮作蕉园和宿根蕉园,新开垦蕉园在担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、壶菌门(Chytridiomycota)、线虫(Nematoda)、毛霉菌门(Mucoromycota)有明显富集;与轮作蕉园和新开垦蕉园相比,宿根蕉园在毛霉菌门(Mucoromycota)、球囊菌门(Glomeromycota)、Anthophyta、纤毛门(Ciliophora)、绿藻门(Chlorophyta)、丝足虫门(Cercozoa)等有明显富集(图4B)。
为了进一步分析宿根蕉园、轮作蕉园和新开垦蕉园各点的代表性物种,进行了指示物种分析。通过分析发现,轮作蕉园与新开垦蕉园相比,细菌类方面,小单孢菌属(Micromonospora)、1921-2、赭黄嗜盐囊菌(Haliangiu)、硝化螺旋菌(Nitrospira)、库茨涅尔氏菌(Kutzneria)、小梨形菌属(Pirellula)、中慢生根瘤菌属(Mesorhizobium)、小单孢菌(Micromonospora)有显著差异(图5A);真核微生物方面,篮状菌属(Talaromyces)、角菌根菌属(Ceratobasidium)、轮枝孢属(Musicillium)有显著差异(图5B)。轮作蕉园与宿根蕉园相比,细菌类方面,热酸菌属(Acidothermus)、1921-2、库茨涅尔氏菌(Kutzneria)存在显著差异(图5C);真核微生物方面,篮状菌属(Talaromyces)、小菇属(Mycena)存在显著差异(图5D)。新开垦蕉园与宿根蕉园相比,细菌类方面,热酸菌属(Acidothermus)、芽胞杆菌(Bacillus)存在明显差异(图5E);真核微生物方面,角菌根菌属(Ceratobasidium)存在显著差异(图5F)。上述结果为解析宿根蕉园连作成功的模式奠定了基础。
2.4 蕉园土壤细菌和真菌的基因功能分析
为了进一步分析3种蕉园土壤特征,通过功能分析构建物种与基因的网络,结合基因的KEGG通路信息来预测整个群落的通路情况。从细菌的功能丰度热图(图6A)可以看出,宿根蕉园组的大多数代谢通路的基因丰度显著低于轮作蕉园和新开垦蕉园,仅细菌迁移(cell mobility)一项高于另外2种蕉园,而轮作蕉园和新开垦蕉园在酶家族(enzyme families)、生物合成和次级代谢(biosynthesis of other metabolites)、转录(transcription)、碳代谢(carbohydrate metabolism)、膜转运(membrane transport)以及多糖的生物合成与代谢(glycan biosynthesis and metabolism)相关的基因丰度明显高于轮作蕉园(图6A)。从真菌的功能丰度热图(图6B)可以看出,宿根蕉园组的大多数代谢通路的基因丰度显著高于轮作蕉园和新开垦蕉园,而新开垦蕉园又低于轮作蕉园;宿根蕉园土壤真菌从代谢通路上看,在细胞迁移(cell mobility)、细胞生长和死亡(cell growth and death)、信号传导(signal transduction)、传染性病害(infectious diseases)、核酸代谢(nucleotide metabolism)、蛋白折叠储运和降解(folding, sorting and degradation)上有明显的优势;轮作蕉园真菌从代谢通路上看,在辅助因子和维生素代谢(metabolism of cofactors and vitamins)、其他次生代謝产物的生物合成(biosynthesis of other secondary metabolites)、氨基酸代谢(amino acid metabolism)、激素代谢方面有明显的优势;新开垦蕉园土壤真菌在碳代谢(carbohydrate metabolism)通路上有明显的富集。上述结果表明,土壤真菌菌群可能是影响香蕉枯萎病数量的关键因子。
3 讨论
海南是典型的热带亚热带气候,试验取材地点临高皇桐是典型的红壤,土壤酸性较强。前人研究也表明,蕉园香蕉枯萎病爆发的几率和发病程度与土壤酸碱度有较大关系,酸性越强,香蕉枯萎病爆发几率越高[33],蕉园病株又进一步酸化根际土壤[34],一旦陷入该种恶性循环,往往导致蕉园废弃。宿根蕉园土壤pH显著高于轮作蕉园和新开垦蕉园,全生育期变异范围也最小,可能是宿根蕉园能顺利运行的主要原因。全生育期蕉园土壤pH动态变化分析发现,pH在雨季下降明显,相对应的同期土壤香蕉枯萎病孢子数目也明显上升,表明二者有一定的关联性。此外,新开垦蕉园和轮作蕉园pH<6,不利于多数细菌和放线菌的生长,而较低的pH更利于香蕉枯萎病菌的生长,孢子相对数目较高;而宿根蕉园pH>6,不利于香蕉枯萎病菌的生长,孢子数相对含量低。
先前研究发现,虽然不同蕉园土壤理化性质及养分含量存在很大差异,但与香蕉枯萎病的发生无直接相关性;蕉园土壤微生物数量的改变是香蕉枯萎病发病的重要特征,枯萎病危害程度为中度、重度的土壤中细菌和放线菌的数量明显低于危害程度为轻度和无危害的土壤,危害程度为中度、重度的土壤真菌数量明显高于危害程度为轻度和无危害的土壤[24]。通过对3种蕉园土壤菌群特征分析发现:宿根蕉园土壤的细菌和真菌无论在种类上还是在丰度上均显著高于轮作蕉园和新开垦蕉园;宿根蕉园土壤细菌菌群活跃程度最低,轮作蕉园低于新垦蕉园;宿根蕉园土壤真菌菌群活跃程度最高,新垦蕉园低于轮作蕉园,表明真菌的活跃程度可能在维持土壤健康和抑制香蕉枯萎病爆发过程中有重要作用。邓晓等[21]通过分析海南23个香蕉园土壤微生物数量与18个土壤因子的相关性发现,蕉园土壤5~30 cm土层可培养微生物的区系依次为细菌、放线菌、真菌;有效Fe、有效P、土壤pH分别是影响蕉园土壤真菌数量、放线菌数量和土壤微生物总数的关键因子。新开垦蕉园和轮作蕉园对于宿根蕉园土壤细菌和真菌的丰度问题可能还需进一步结合其他土壤因子进行分析。通过间作韭菜、假花生和覆盖稻草处理可显著提高香蕉根区土壤可培养细菌和放线菌数量,降低尖孢镰刀菌数量[35]。宿根蕉园由于香蕉茎杆多堆于行间,经分解后还于蕉园,土壤有机质含量明显高于其他2种模式,部分特征与间作和覆草类似,因此无论是土壤细菌还是真菌的菌群数量和丰度均高于轮作和新开垦蕉园。黄珍等[36]对海南省福山香蕉园香蕉枯萎病发生地和正常种植园的土壤分析发现,正常香蕉种植区的土壤样品的细菌多样性较为丰富,其中变形菌门、厚壁菌门、酸杆菌门为主要细菌类群;而香蕉枯萎病发生地土壤以放线菌门和厚壁菌门为主要细菌类群。皇桐、南宝与美台3个地区蕉园土壤中主要优势细菌可能为枯草芽胞杆菌、葡萄球菌、反刍真杆菌等[37]。正常香蕉种植区土壤样品的细菌多样性较为丰富,以变形菌门、厚壁菌门、酸杆菌门为主要细菌类群;而香蕉枯萎病发生地土壤以放线菌门和厚壁菌门为主[36]。通过土壤特征菌群分析发现,宿根蕉园与新开垦蕉园相比,细菌类方面,热酸菌属、芽胞杆菌芽胞杆菌属存在明显差异,真核微生物方面,角菌根菌属存在显著差异;宿根蕉园与轮作蕉园相比,细菌类方面,热酸菌属、1921-2、库茨涅尔氏菌存在显著差异,真核微生物方面,篮状菌属、小菇属存在显著差异。上述研究结果中,热酸菌属、芽胞杆菌芽胞杆菌属等与先前报道相同,同时也发现一些新的菌属,为未来土壤改良和拮抗菌筛选提供新方向。同时,取材时间、使用化肥和生物肥、种植模式等诸多原因均可能导致菌群特征结果有较大差异。因此相关结果还需进一步的验证和研究。
参考文献
胡从九. 浅析世界香蕉市场变化及趋势[J]. 中国热带农业, 2020(6): 39-41, 11.
付 岗, 叶云峰, 杜婵娟, 等. 香蕉枯萎病菌群体多样性研究进展[J]. 植物检疫, 2016, 30(2): 1-6.
曾莉莎, 林威鹏, 吕 顺, 等. 香蕉-甘蔗轮作模式防控香蕉枯萎病的持续效果与土壤微生态机理(Ⅰ)[J]. 中国生态农业学报(中英文), 2019, 27(2): 257-266.
林威鹏, 曾莉莎, 吕 顺, 等. 香蕉-甘蔗轮作模式防控香蕉枯萎病的持续效果与土壤微生态机理(Ⅱ)[J]. 中国生态农业学报(中英文), 2019, 27(3): 348-357
刘文清, 崔广娟, 王 芳, 等. 香蕉-甘蔗轮作对土壤养分含量及酶活性的影响[J]. 广东农业科学, 2019, 46(8): 86-96.
剧虹伶. 辣椒-香蕉轮作联合生物有机肥减轻高发枯萎病蕉园连作障碍机制研究[D]. 海口: 海南大学, 2017.
李梦辉. 辣椒对香蕉枯萎病的防控作用效果[D]. 海口: 海南大学, 2017
耿建建. 稻秆还田淹水联合水稻轮作对高发枯萎病蕉园土壤修复效应研究[D]. 海口: 海南大学, 2016.
辛 侃. 水稻—香蕉轮作并向土壤中添加有机物料防控香蕉枯萎病的研究[D]. 海口: 海南大学, 2014.
辛 侃, 赵 娜, 邓小垦, 等. 香蕉-水稻轮作联合添加有机物料防控香蕉枯萎病研究[J]. 植物保护, 2014, 40(6): 36-41, 52.
黄永红. 韭菜对香蕉枯萎病的防控效果及其作用机理的研究[D]. 长沙: 湖南农业大学, 2011.
柳 影, 丁文娟, 曹 群, 等. 套种韭菜配施生物有机肥对香蕉枯萎病及土壤微生物的影响[J]. 农业环境科学学报, 2015, 34(2): 303-309.
黄永红, 魏岳荣, 李春雨, 等. 韭菜对香蕉枯萎病菌4号生理小种的抑制作用及对香蕉枯萎病的防控研究(英文)[J]. 果树学报, 2011, 28(5): 857-862, 943.
吴宇佳, 杨 春, 雷 菲, 等. 套种花生对香蕉园小气候和土壤理化性质的影响[J]. 福建农业学报, 2020, 35(3): 337-343.
许林兵, 黄秉智, 肖维强. 抗枯萎病香蕉新品种‘南天黄的特征与栽培技术要点[J]. 中国热带农业, 2016(4): 24-27.
许林兵, 张锡炎, 李华平, 等. 抗枯萎病香蕉新品种‘南天黄选育[J]. 热带作物学报, 2017, 38(6): 998-1004.
王贵花. 香蕉枯萎病菌侵染巴西蕉和宝岛蕉差异转录组分析[D]. 海口: 海南大学, 2016.
李华平, 李云锋, 聂燕芳. 香蕉枯萎病的发生及防控研究现状[J]. 华南农业大学学报, 2019, 40(5): 128-136.
李绍鹏, 陈文河. 厄瓜多尔香蕉产业经营经验考察报告[J]. 热带农业科学, 2000(6): 42-45, 56.
周兆禧, 马蔚红, 李敬阳, 等. 海南宿根一代蕉高产栽培管理技术[J]. 中国热带农业, 2011(6): 74-76.
邓 晓, 洪 葵, 李勤奋, 等. 海南香蕉园土壤微生物与土壤因子的关系[J]. 热带作物学报, 2010, 31(4): 530-535.
樊小林, 李 进. 碱性肥料调节香蕉园土壤酸度及防控香蕉枯萎病的效果[J]. 植物营养与肥料学报, 2014, 20(4): 938-946.
黄建凤, 张发宝, 逄玉万, 等. 酸性土壤改良剂与生防制剂协同防控香蕉枯萎病的效果[J]. 热带作物学报, 2017, 38(3): 545-550.
邓 晓, 李勤奋, 侯宪文, 等. 香蕉枯萎病区土壤可培养微生物生态特征[J]. 热带作物学报, 2011, 32(2): 283-288.
杜 浩, 只佳增, 李宗锴, 等. 我国土壤微生物菌群构建防控香蕉枯萎病研究进展[J]. 热带农业科学, 2020, 40(2): 90-98.
付 琳, 阮云泽, 沈宗专, 等. 生物有机肥对连作香蕉根际土壤可培养细菌区系的影响[J]. 南京农业大学学报, 2012, 35(6): 82-88.
齐鸿雁, 薛 凯, 张洪勋. 磷脂脂肪酸谱图分析方法及其在微生物生态学领域的应用[J]. 生态学报, 2003(8): 1576-1582.
孙建波, 邹良平, 李文彬, 等. 香蕉不同生育期根际土壤细菌群落变化研究[J]. 热带作物学报, 2016, 37(6): 1168-1171.
邓 晓, 李勤奋, 武春媛, 等. 健康香蕉(Musa paradisiaca)植株与枯萎病患病植株根区土壤细菌多样性的比较研究[J]. 生态环境学报, 2015, 24(3): 402-408.
漆艳香, 张 欣, 彭 军, 等. 不同抗、感枯萎病香蕉种质根际土壤的微生物数量[J]. 江苏农业科学, 2019, 47(13): 110-114.
景曉辉, 吴伦英, 区小玲, 等. 一种简便分离香蕉枯萎病菌的选择性培养基[J]. 热带作物学报, 2009, 30(11): 1671-1673.
韩宝坤, 杜艳华. 非无菌操作下分离尖孢镰刀菌的培养基[J]. 植物病理学报, 2001(4): 373.
李 进, 张立丹, 刘 芳, 等. 碱性肥料对香蕉枯萎病发生及土壤微生物群落的影响[J]. 植物营养与肥料学报, 2016, 22(2): 429-436.
杨绍琼, 张光勇, 孙寅虎, 等. 香蕉枯萎病区感病与健康植株根系附近土壤养分及土壤酶活性差异性研究[J]. 安徽农业科学, 2020, 48(4): 141-145.
王丽霞, 井 涛, 殷晓敏, 等. 不同种植模式对香蕉根区土壤养分及可培养微生物数量的影响[J]. 中国南方果树, 2020, 49(4): 80-86, 89.
黄 珍, 谭志琼, 阮云泽. 香蕉园土壤16S rDNA文库分析[J]. 热带作物学报, 2010, 31(6): 989-993.
陈 波, 张锡炎, 黄 霄, 等. 香蕉枯萎病区土壤真菌多样性分析[J]. 江苏农业科学, 2013, 41(11): 354-357.
责任编辑:谢龙莲
