ALA对刺葡萄愈伤组织生长及主要抗氧化物质积累的影响
2021-09-14张静潘红赖呈纯赖恭梯黄贤贵王琦高慧颖陈桂信
张静 潘红 赖呈纯 赖恭梯 黄贤贵 王琦 高慧颖 陈桂信
摘 要:以刺葡萄红色愈伤组织为材料,研究不同浓度ALA处理对刺葡萄愈伤组织生物量及主要抗氧化物质(黄酮类化合物、原花青素和花色苷)积累量的影响,明确ALA与刺葡萄愈伤组织生长、主要抗氧化活性物质合成的相关性。结果表明:中低浓度(0.05~1.0 mg/L)ALA可促进刺葡萄愈伤组织生长,显著增加刺葡萄愈伤组织的生物量;同时,中低浓度ALA能显著增加刺葡萄细胞中黄酮类化合物、原花青素和花色苷的含量;高浓度(2.0~5.0 mg/L)ALA会抑制刺葡萄愈伤组织生长,并最终导致褐变死亡;刺葡萄愈伤组织主要抗氧化物质积累也存在显著的培养阶段差异,在ALA最适浓度0.05 mg/L时,刺葡萄细胞中黄酮类化合物含量最高可达272.48 μg/g(培养45 d)、花色苷含量最高达107.24 μg/g(培养35 d)、原花青素含量最高达1630.16 μg/g(培养45 d)。由结果可知,ALA可以定向调控刺葡萄愈伤组织细胞中主要抗氧化物质的生物合成。
关键词:刺葡萄;愈伤组织;抗氧化物质;花色苷;5-氨基乙酰丙酸(ALA)
Abstract: In order to determine the correlation between ALA (5-aminolevulinic acid) and the growth of spine grape callus and the synthesis of its main antioxidant bioactive substances, the effects of different ALA concentrations on the biomass of spine grape callus and its main antioxidants content, including flavonoids, proanthocyanidins, and anthocyanins, were investigated using the red callus of spine grape. The results showed that medium or low ALA concentration (0.05 to 1.0 mg/L) could promote the growth of spine grape callus and increase the biomass significantly. Meanwhile, the content of flavonoids, proanthocyanidins and anthocyanins in the cells of the spine grape callus could be significantly increased at medium or low concentrations of ALA. But the growth of spine grape callus was strongly inhibited under high levels of ALA concentrations (2.0 to 5.0 mg/L), and eventually browning to death. The main antioxidants were also significant differences in the cell cultures of spine grape callus at different stages of culture. At the optimal ALA concentration of 0.05 mg/L, the maximum flavonoids content in the cells of spine grape callus was 272.48 μg/g (cultured for 45 days), the maximum anthocyanins content was 107.24 μg/g (cultured for 35 days), and the maximum proanthocyanidins content was 1630.16 μg/g (cultured for 45 days). It indicated that ALA can regulate the biosynthesis of main antioxidants in the cells of spine grape callus.
Keywords: spine grape [Vitis davidii (Roman. du Caill.) Fo?x.]; callus; antioxidants; anthocyanins; 5-aminolevulinic acid (ALA)
刺葡萄[Vitis davidii (Roman. du Caill.) Fo?x.]為葡萄科(Vitaceae)葡萄属(Vitis)的木质藤本植物,其果肉呈紫黑色,富含酚类化合物、黄酮类化合物、白藜芦醇、齐墩果酸、鞣质等天然生物活性物质[1],其中刺葡萄皮中的花色苷不仅是优良的天然色素,与刺葡萄籽中的原花青素一样,是优良的天然抗氧化剂[2],在食品、医药和化妆品等工业有广泛的应用。随着人们对植物天然生物活性物质有利于人类身体健康生理功能重视,市场对于植物天然活性物质,尤其是花青素和原花青素等抗氧化生物活性物质的需求越来越大,需要寻找一种可以持续不断规模化生产提取原料的途径。研究表明,植物细胞培养是获取植物天然生物活性物质的有效技术手段,并已在商业化应用上得以实施[3]。因此,通过葡萄细胞的周年培养是获取葡萄花色苷及其他天然生物活性物质的可行途径之一[4-5]。然而,在葡萄细胞培养中,稳定提高细胞中花色苷和原花青素等生物活性物质含量的技术措施还有待进一步优化和完善。前人的研究表明,葡萄幼果期和转色期喷布不同浓度的5-氨基乙酰丙酸(5-aminolevulinic acid,ALA)对葡萄果皮花青素含量、果实生长和品质[6-8]及抗逆性[9]等都有显著影响。
ALA是四氢吡咯的前缀化合物,是叶绿素、血红素、维生素B12等生物体合成不可或缺的物质[10-11]。ALA是一种天然、无毒、可生物降解且对环境友好的新型植物生长调节物质,在农业实践生产中有着重要的应用价值,可作为植物生长促进剂或抗逆增强剂[12]。近年来国内外关于ALA生物学功能的研究很多,主要在植物光合作用、抗低温、耐盐等生理方面[13]。ALA具有生长素和细胞分裂素的双重性质,在组织培养实验中具有良好的应用前景[14],有研究表明,ALA能促进紫杉愈伤组织生长并增加紫杉醇的产量[15]。本研究以刺葡萄松散型红色愈伤组织为材料,用不同浓度的ALA处理刺葡萄愈伤组织,以期筛选出ALA诱导刺葡萄愈伤组织花色苷积累的最适浓度,并研究ALA对刺葡萄愈伤组织生长状态及主要抗氧化活性物质含量的影响。以期为刺葡萄愈伤组织花色苷等次生代谢产物的生产与开发,及葡萄果实色泽调控提供理论基础与技术支撑,具有重要的理论意义和实践价值。
1 材料与方法
1.1 材料
以福建省农业科学院农业工程技术研究所诱导并长期继代保存的具高产花青素和原花青素的刺葡萄红色愈伤组织细胞系[16]为实验材料。
主要试剂:5-氨基乙酰丙酸、原花青素、矢车菊-3-葡萄糖苷,Sigma-Aldrich公司;芦丁,BBI公司;其他试剂为国产分析纯。
主要仪器设备:CLARIOstar多功能酶标仪,德国BMG Labtech;800KDE超声波仪,昆山市超声仪器有限公司;Heraeus Multifuge X3R高速冷冻离心机,美国Thermo Fisher Scientific;BSG-12水浴锅,上海一恒科学仪器有限公司。
1.2 方法
1.2.1 培养基配制 本研究所用培养基为附加2,4-D 1.0 mg/L、蔗糖30.0 g/L、琼脂粉6.0 g/L和不同浓度ALA的固体MS培养基。
ALA母液配制:准确称取50 mg的ALA粉末,加入100 mL的蒸馏水进行溶解,配制浓度为0.5 mg/mL的ALA母液,将配制好的ALA母液于超净工作台内采用0.22 μm过滤器过滤灭菌,备用。
将灭菌好的附加2,4-D 1.0 mg/L的MS培养基置于超净工作台内冷却至50 ℃左右,然后用移液器加入一定量的ALA母液,配制成ALA浓度分别为0(CK)、0.05、0.1、0.25、0.5、1.0、2.0、3.0、4.0、5.0 mg/L的MS固体培养基。
1.2.2 刺葡萄愈伤组织的培养与处理 刺葡萄红色愈伤组织培养20 d后,选取形态一致的细胞团转接到新鲜的培养基中,每瓶接种6团大小均匀一致的细胞团,细胞团大小为0.1 g左右,每个浓度梯度各接30瓶,然后将培养瓶置于光照强度2000~2500 lx、温度为(25±1)℃、相对湿度50%~ 60%、每天光照12 h的条件下培养。各处理的刺葡萄愈伤组织培养到25、35、45 d分别取样,取样时进行拍照,称重,收集过程去除培养基,用滤纸吸附多余水分,装入自封袋,放在液氮中速冻,贮藏于–80 ℃超低温冰箱内,备用。
1.2.3 黄酮类化合物含量测定 刺葡萄愈伤组织黄酮类化合物含量测定采用亚硝酸钠-硝酸铝比色法,在周丹蓉等[17]的基础上稍作改动。黄酮类化合物提取:准确称取细胞鲜重样品0.2 g,加入80%(V/V)的乙醇水溶液1.0 mL。混匀,置于超声波仪器中(功率100%,温度30 ℃)超声45 min。7000 r/min离心5 min,取上清至新的10 mL离心管中。重复提取3次,混合3次上清,待测。
分别精确吸取300 μL提取液,各加入5%亚硝酸钠溶液300 μL,摇匀后静置6 min;分别加入10%硝酸铝溶液300 μL,摇匀后静置6 min;再分别加入4%氢氧化钠溶液400 μL,摇匀;最后用50%乙醇稀释至刻度,静置15 min。以试剂空白为空白对照,利用酶标仪于510 nm下测定各待测样品的吸光度。以芦丁为标准品绘制标准曲线,回归方程为y=0.0036x+0.0012,R2=0.9934,根据回归方程计算出样品提取液黄酮类化合物浓度。
1.2.4 原花青素含量测定 原花青素含量测定采用正丁醇-盐酸法,在董瑞霞等[18]的方法上进行改动,采用超声波-乙醇提取法对刺葡萄愈伤组织的原花青素进行提取,原花青素提取液反应后于546 nm处测定其吸光值。以原花青素标准品(UV≥95%)绘制标准曲线,回归方程为y=0.0063x + 0.0158,R2=0.9937,根据回归方程计算出样品提取液原花青素浓度;然后根据公式计算原花青素含量:
原花青素含量=(CV/W)×10式中,C为样品花色苷提取液的浓度(μg/mL);V为反应液体积(mL);10为提取液总体积与反应液体积的比值;W为提取时所用的细胞鲜重(g)。
1.2.5 花色苷含量测定 参考马志本等[19]的方法,并适当改进。采用超声波-乙醇甲酸提取法对刺葡萄愈伤组织细胞中花色苷进行提取。以定溶剂做空白调零,于酶标仪中测定波长530、620、650 nm下的吸光值,用Greey公式准确计算出花色苷的吸光值:
1.3 数据处理
用Excel 2010软件进行数据整理,采用DPS对数据进行方差分析和显著性检验,使用Excel 2010作图。
2 結果与分析
2.1 不同浓度ALA对刺葡萄愈伤组织生物量的影响
刺葡萄愈伤组织在不同浓度ALA培养基中生物量的变化情况见图1。由图1可以看出,随ALA浓度增加,其对刺葡萄愈伤组织生物量增长总体的变化趋势是先增加后略微下降,再增加后迅速下降,直至愈伤组织褐变死亡。从图1还可以看出,ALA处理浓度在0~1.0 mg/L时,与对照相比能显著促进刺葡萄愈伤组织的生长,同时培养早期(25 d)、中期(35 d)中浓度ALA(0.5 mg/L和1.0 mg/L)更有利于刺葡萄愈伤组织生物量的增加,25 d时,刺葡萄愈伤组织生物量分别为11.75 g和11.26 g,是对照(ALA浓度0 mg/L)的1.26倍和1.21倍;35 d时,生物量分别为13.33 g和13.40 g,是对照的1.25倍和1.26倍。而在培不同小写字母表示同一时间不同ALA浓度处理的样品差异显著(P<0.05)。
养后期(45 d)低浓度ALA(0.05 mg/L)更有利于刺葡萄愈伤组织生物量的增长,生物量为15.32 g,是对照的1.11倍;ALA浓度达到或超过2.0 mg/L,与对照相比会显著抑制愈伤组织的生长,培养中能明显观察到愈伤组织出现褐变和水渍状,并且这种情况会随ALA浓度的增大而迅速增多;ALA浓度达到4.0 mg/L及以上时,对刺葡萄愈伤组织致死率达到100%。以上分析表明,若仅考虑刺葡萄愈伤组织生物量,采用不同ALA处理刺葡萄愈伤组织时,短中期培养以0.5 mg/L的使用浓度较为合适,如果是较长时间培养,则以低浓度0.05 mg/L较为宜。由于高浓度ALA(2.0 mg/L及以上)会强烈抑制刺葡萄愈伤组织生长,并最终致死,所以后续分析选用ALA处理浓度为0~1.0 mg/L。
2.2 不同浓度ALA处理对刺葡萄愈伤组织黄酮类化合物含量的影响
2.2.1 刺葡萄愈伤组织细胞中黄酮类化合物含量变化 刺葡萄愈傷组织在不同ALA浓度下培养,细胞中黄酮类化合物含量变化情况见图2。从培养时间看,相同ALA浓度下,刺葡萄愈伤组织细胞中黄酮类化合物含量随培养时间延长而不断增加。从不同ALA处理浓度看,与对照(ALA浓度0 mg/L)相比,低浓度ALA能较明显地促进刺葡萄愈伤组织细胞中黄酮类化合物的生物合成,在早期培养阶段(25 d),ALA处理浓度为不同小写字母表示同一时间不同ALA浓度处理的样品差异显著(P<0.05)。0.05、0.1、0.25 mg/L时,黄酮类化合物含量分别为148.45、150.53、135.64 μg/g,对照黄酮类化合物含量为124.64 μg/g,其他处理浓度黄酮类化合物含量均略低于对照;在培养的中、后期(35 d和45 d),0.05 mg/L ALA处理的刺葡萄愈伤组织细胞中黄酮类化合物含量均高于对照,培养35 d时为202.72 μg/g,45 d为272.48 μg/g,对照则分别为196.57、250.64 μg/g,其他ALA处理浓度低于或略低于对照。由此可见,仅从刺葡萄愈伤组织细胞中黄酮类化合物含量考察,以ALA处理浓度为0.05 mg/L为佳。
2.2.2 刺葡萄愈伤组织黄酮类化合物产量的变化 将刺葡萄愈伤组织细胞中黄酮类化合物含量结合生物量考察黄酮化合物产量,结果见图3。在刺葡萄愈伤组织培养早期(25 d),不同浓度ALA(0.05~1.00 mg/L)处理的愈伤组织黄酮类化合物产量均显著高于对照(0 mg/L)。培养中期(35 d),除了ALA浓度为1.00 mg/L处理时黄酮类化合物产量显著低于对照,其他处理黄酮类化合物产量虽略高于对照,但没有达到显著水平。培养后期(45 d),低浓度ALA(0.05 mg/L)处理下的刺葡萄愈伤组织黄酮类化合物产量显著高于对照,达到4173.48 μg,对照为3448.81 μg,而其他浓度处理的黄酮类化合物产量略低于对比,但没有达到显著水平。这说明,在刺葡萄愈伤组织培养早期,在一定的ALA浓度范围内,ALA可显著增加刺葡萄愈伤组织黄酮类化合物产量,但培养到中后期,尤其是培养后期,只有低浓度的ALA处不同小写字母表示同一时间不同ALA浓度处理的样品差异显著(P<0.05)。理才能有效地增加葡萄愈伤组织黄酮类化合物产量,这可能与中高浓度ALA促进细胞加速老化有关。从刺葡萄愈伤组织黄酮类化合物产量看,ALA浓度以0.05 mg/L为佳。
2.3 不同ALA浓度处理对刺葡萄愈伤组织花色苷含量的影响
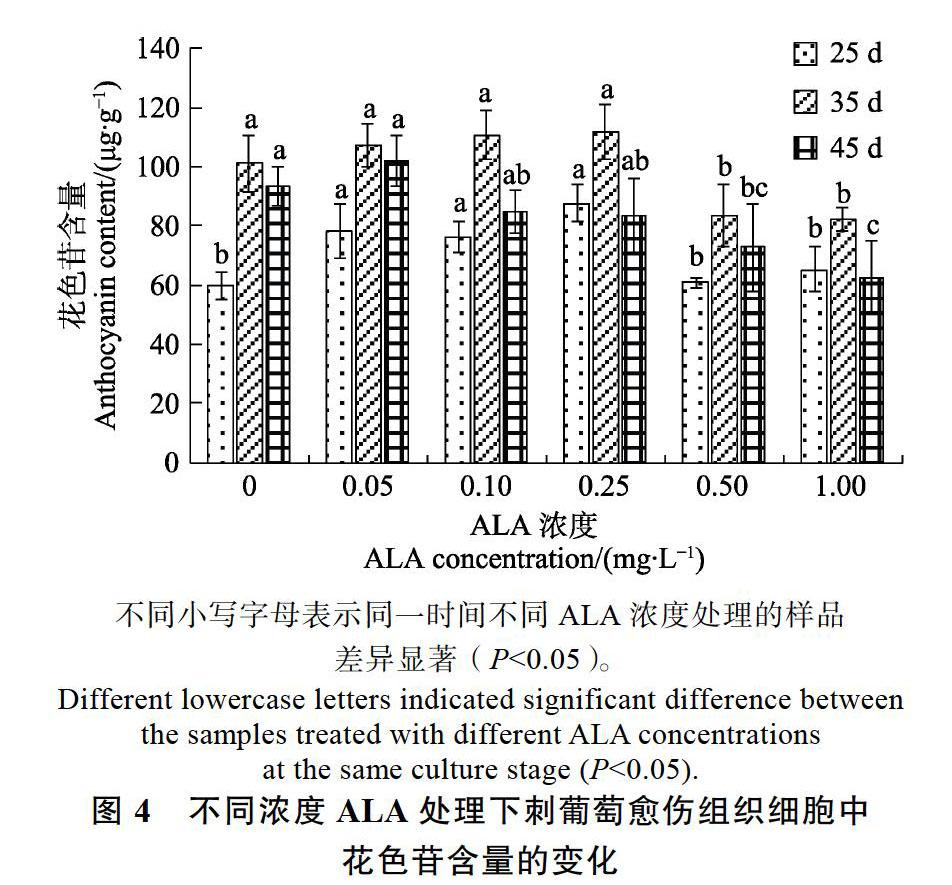
2.3.1 刺葡萄愈伤组织细胞中花色苷含量的变化 将刺葡萄愈伤组织在附加不同浓度ALA的培养基中培养,刺葡萄愈伤组织细胞中花色苷含量变化情况见图4。在刺葡萄愈伤组织培养早期(25 d),与对照相比,中低浓度ALA(0.05、0.10、0.25 mg/L)处理能显著提高刺葡萄愈伤组织细胞中花色苷含量,其中浓度0.25 mg/L ALA处理后的花色苷含量最高,为87.70 μg/g;较高浓度ALA(0.50、1.00 mg/L)处理与对照差异不显著。在培养的中期(35 d),不同浓度ALA处理及对照的刺葡萄愈伤组织细胞中花色苷含量均达到3个培养阶段的最高值;同时,中低浓度ALA处理的细胞中花色苷含量均略高于对照,分别为107.24、110.77、112.07 μg/g,但与对照(101.07 μg/g)相比,差异不显著;较高浓度ALA处理则显著低于对照。在培养后期(45 d),不同浓度ALA处理及对照细胞中花色苷含量与35 d对比都不同程度的下降;中低浓度ALA处理细胞中花色苷含量与对照相比差异不显著,但都显著高于较高浓度ALA处理。以上分析表明,培养早期,适当浓度不同小写字母表示同一时间不同ALA浓度处理的样品差异显著(P<0.05)。
花色苷含量的变化的ALA(0.05~0.25 mg/L)处理,能显著促进刺葡萄细胞中花色苷的合成;刺葡萄愈伤组织培养中期,ALA处理对其花色苷合成的促进作用不明显;培养后期,低浓度的ALA(0.05 mg/L)处理与其他处理浓度相比,能有效的延缓刺葡萄细胞中花色苷含量的下降。
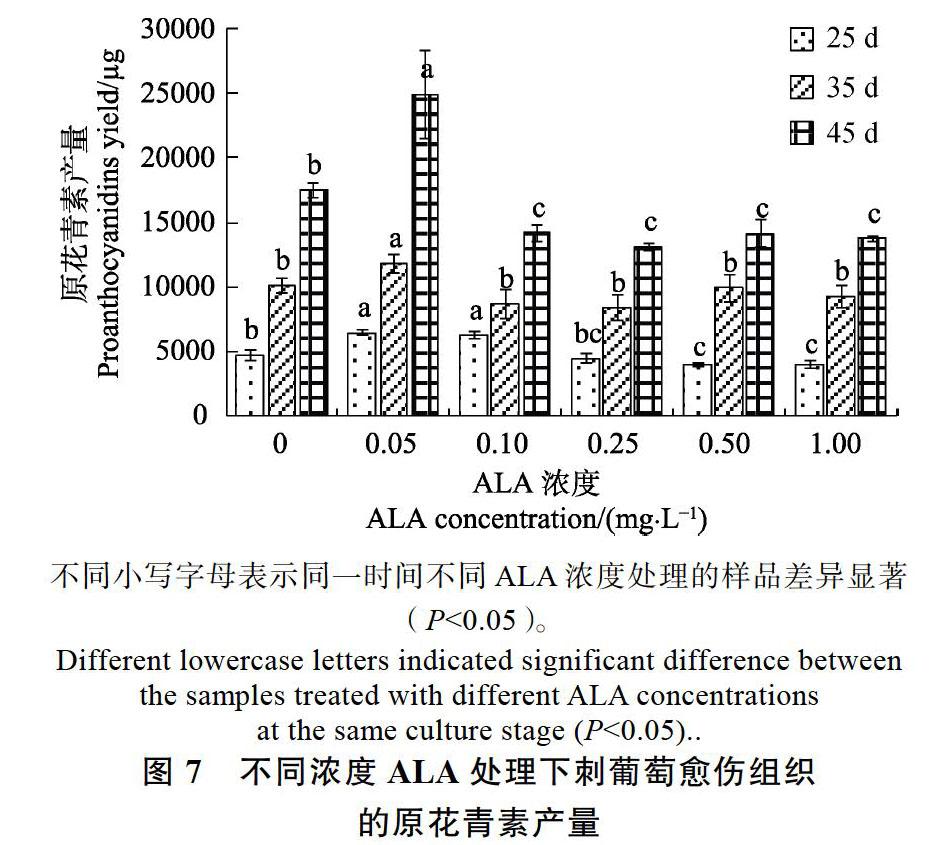
2.3.2 刺葡萄愈伤组织花色苷产量的变化 将刺葡萄愈伤组织细胞花色苷含量结合生物量进行考察,获得刺葡萄愈伤组织花色苷产量,结果见图5。在刺葡萄愈伤组织培养早期(25 d),不同浓度ALA处理的刺葡萄愈伤组织花色苷产量均显著高于对照,并且中低浓度ALA(0.05、0.10、0.25 mg/L)处理的花色苷产量显著高于较高浓度ALA(0.50、1.00 mg/L)处理。培养中期35 d时,中浓度ALA(0.10、0.25 mg/L)处理的刺葡萄愈伤组织花色苷产量分别为1412.69、1408.35 μg,显著高于对照及较高浓度ALA处理,而与低浓度ALA(0.05 mg/L)处理差异不明顯。培养后期45 d时,低浓度ALA处理和对照刺葡萄愈伤组织花色苷产量比35 d时有较大幅度增加,而中高浓度ALA处理的却呈现一定幅度的下降,此时期产量最高的为ALA 0.05 mg/L处理的刺葡萄愈伤组织,为1561.94 μg,显著高于对照及中高浓度ALA处理。以上分析表明,若考虑刺葡萄愈伤组织花色苷产量和培养时间,短中期培养(25 d或35 d)以中低浓度ALA处理为佳,而较长时间培养(45 d)则以低浓度ALA处理为宜。
不同小写字母表示同一时间不同ALA浓度处理的样品差异显著(P<0.05)。
2.4 不同ALA浓度处理对刺葡萄愈伤组织原花青素含量的影响
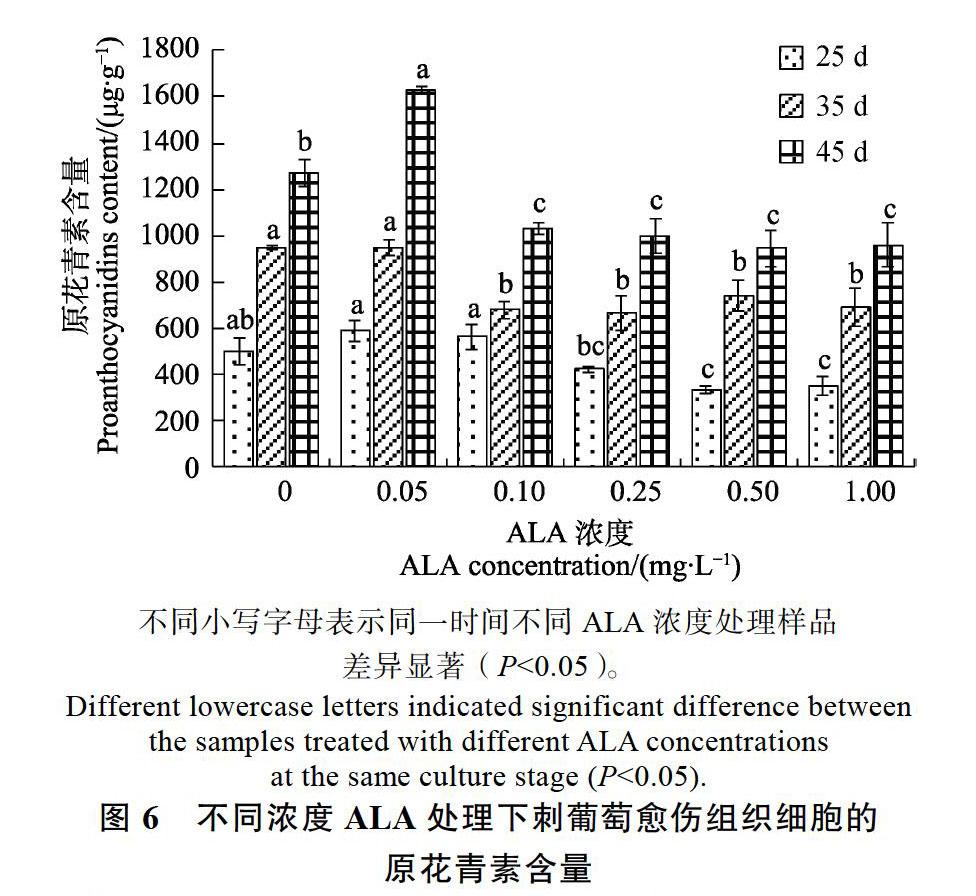
2.4.1 刺葡萄愈伤组织细胞中原花青素含量的变化 将刺葡萄愈伤组织培养于附加不同浓度ALA的培养基中,细胞中原花青素含量变化情况见图6。刺葡萄愈伤组织培养至25 d时(早期),0.05 mg/L和0.10 mg/L ALA处理的细胞中原花青素含量略高于对照且与对照相比差异不显著,但显著高于其他ALA浓度处理。培养至中期35 d,0.05 mg/L浓度ALA处理的刺葡萄细胞中原花青素含量与对照相比无显著差异,但显著高于其他浓度ALA处理,此时0.05 mg/L浓度ALA处理的原花青素含量为950.26 μg/g。培养到后期45 d时,0.05 mg/L ALA处理的刺葡萄愈伤组织细胞中原花青素含量显著高于对照,含量为1630.16 μg/g,其他浓度ALA处理的显著低于对照。分析结果表明,低浓度ALA(0.05 mg/L)有利于刺葡萄愈伤组织原花青素的合成。
2.4.2 刺葡萄愈伤组织原花青素产量的变化 刺葡萄愈伤组织细胞中原花青素含量结合愈伤组织生物量来考察其原花青素产量,结果见图7。刺葡萄愈伤组织培养早中晚期,不同浓度ALA处理变化趋势与刺葡萄愈伤组织细胞中原花青素含量变化高度一致。培养中期(35 d),低浓度ALA(0.05 mg/L)处理的原花青素产量为11821.27 μg,显著高于对照和其他浓度ALA处理。培养后期(45 d),低浓度ALA(0.05 mg/L)处理的原花青素产量高达24968.62 μg,显著高于对照(17516.66 μg),其他浓度ALA处理均显著低于对照。这说明低浓度ALA(0.05 mg/L)能有效地增加刺葡萄愈伤组织原花青素产量。
3 讨论
植物仍然是许多重要天然活性物质的主要来源,现代天然活性药物成分有25%~28%来源于高等植物,尤其是抗癌药物有60%直接或间接来源于植物[20]。虽然植物细胞培养是获取植物天然活性物质的可行手段,但真正通过植物细胞培养获取植物天然活性物质并商业化应用的并不多,主要有花青素、熊果苷、黄连素、甜菜红素、紫锥菊多糖、香叶醇、皂苷、紫杉醇等[21]。许多植物的细胞培养规模还达不到商业化应用的要求,主要原因在于这些植物细胞产生的天然活性产物含量低且不稳定,为了克服这些问题,研究人员通常采用添加诱导子来定向调控植物细胞培养物中的天然活性物质含量,并保证细胞持续稳定高产,取得了良好的效果[22]。本研究发现ALA作为诱导子,可有效的定向调控刺葡萄愈伤组织主要抗氧化生物活性物质的合成,如黄酮类化合物、花色苷和原花青素等。ALA作为诱导子调控刺葡萄主要抗氧化生物活性物质合成有两个方面,一方面,ALA作为一种激素类物质,低浓度下能促进刺葡萄细胞增殖,显著增加刺葡萄细胞培养物的生物量;这在其他作物上有类似的报道,如黄瓜[23]、水稻[24]、花椰菜[25]、草莓[26]和苹果[27]等作物施用ALA后可促进植物光合作用、枝叶和果实生长、增加生物量,同时ALA还可以增加植物生物活性物质含量[28-29];在植物细胞培养方面,研究表明ALA可促进紫杉[15]、海带孢子体[30]和苹果[31]愈伤组织的生长和增殖。另一方面,合适浓度的ALA能增强刺葡萄细胞花色苷和原花青素等生物活性物质的合成能力,当ALA浓度在0.05 mg/L时,类黄酮、原花青素和花色苷的积累量达到最大;类似的情况也出现在其他作物上,苹果着色研究发现,采收前喷施ALA,能够促进果实着色[32],同时无论是大田或是离体的苹果,ALA都能显著促进果皮花青素积累[33]。
本研究还发现,不同浓度ALA处理和不同培养阶段对刺葡萄愈伤组织次生代谢产物的积累具有显著影响。ALA处理浓度过高,会显著抑制刺葡萄愈伤组织生长,并最终导致褐变死亡;同时,刺葡萄愈伤组织主要抗氧化生物活性物质也会随培养时间延长而较大幅度增加,不同ALA浓度处理增加的幅度存在显著差异。研究结果表明,ALA浓度为0.05 mg/L时,对主要抗氧化生物活性物质花色苷、原花青素和黄酮类化合物等的促进效果最佳,但在0~0.05 mg/L之间ALA浓度还存在研究空白,在后续的研究中,将进一步考察该ALA浓度范围对刺葡萄细胞生长和主要抗氧化生物活性物质合成的影响。本研究结果为刺葡萄愈伤组织花色苷等次生代谢产物的积累及葡萄果实色泽调控提供理论基础与技术支撑,具有重要的理论意义和实践价值。
参考文献
Meng J F, Fang Y L, Qin M Y, et al. Varietal differences among the phenolic profiles and antioxidant properties of four cultivars of spine grape (Vitis davidii Foex.) in Chongyi County (China)[J]. Food Chemistry. 2012, 134(4): 2049-2056.
Han F, Ju Y, Ruan X, et al. Color, anthocyanin, and antioxidant characteristics of young wines produced from spine grapes (Vitisdavidii Foex.) in China[J]. Food & Nutrition Research, 2017, 61(1): 1339552.
Ochoa-Villarreal M, Howat S, Hong S, et al. Plant cell culture strategies for the production of natural products[J]. BMB Reports, 2016, 49(3): 149-158.
Zhang W, Furusaki S. Production of anthocyanins by plant cell cultures[J]. Biotechnology and Bioprocess Engineering, 1999, 4(4): 231-252.
Ananga A, Georgiev V, Ochieng J, et al. Production of anthocyanins in grape cell cultures: a potential source of raw material for pharmaceutical, food, and cosmetic industries[M]//Poljuha D, Sladonja B. The mediterranean genetic code - grapevine and olive. 2013: 247-287.
Watanabe K, Nishihara E, Watanabe S, et al. Enhancement of growth and fruit maturity in 2-year-old grapevines cv. Delaware by 5-aminolevulinic acid[J]. Plant Growth Regulation, 2006, 49(1): 35-42.
張梦燕, 孙军利, 赵宝龙, 等. 外源ALA对葡萄果实品质及PAL活性的影响[J]. 中外葡萄与葡萄酒, 2017(3): 16-19.
张梦燕, 孙军利, 赵宝龙. 外源ALA对克瑞森无核葡萄叶片光合特性及果实品质的影响[J]. 西北植物学报, 2018, 38(3): 493-500.
赵宝龙, 刘 鹏, 王文静, 等. 5-氨基乙酰丙酸(ALA)对盐胁迫下葡萄叶片中AsA-GSH循环的影响[J]. 植物生理学报, 2015, 51 (3): 385-390.
Wu Y, Liao W, Dawuda M M, et al. 5-Aminolevulinic acid (ALA) biosynthetic and metabolic pathways and its role in higher plants: A review[J]. Plant Growth Regulation, 2019, 87: 357-374.
Zhao A, Zhai M. Production of 5-aminolevulinic acid from glutamate by overexpressing HemA1 and pgr7 from Arabidopsis thaliana in Escherichia coli[J]. World Journal of Microbiology and Biotechnology, 2019, 35: 175.
Akram N A, Ashraf M. Regulation in plant stress tolerance by a potential plant growth regulator, 5-aminolevulinic acid[J]. Journal of Plant Growth Regulation, 2013, 32(3): 663-679.
谢 荔, 成学慧, 冯新新, 等. 氨基酸肥料对‘夏黑葡萄叶片光合特性与果实品质的影响[J]. 南京农业大学学报, 2013, 36(2): 31-37.
Bindu R C, Vivekanandan M. Hormonal activities of 5-aminolevulinic acid in callus induction and micropropagation[J]. Plant Growth Regulation, 1998, 26(1): 15-18.
Yamamoto S, Hayashi S, Furusaki S, et al. 5-Aminolevulinic acid promotes callus growth and paclitaxel production in light-grown Taxus cuspidata suspension cultures[J]. Engineering in Life Sciences, 2015, 15(1): 116- 121.
赖呈纯, 范丽华, 黄贤贵, 等. 刺葡萄幼胚愈伤组织诱导及其高产原花青素细胞系筛选[J]. 植物生理学报, 2014, 50 (11): 1683-1691.
周丹蓉, 方智振, 廖汝玉, 等. 李果皮花色素苷、类黄酮和类胡萝卜素含量及抗氧化性研究[J]. 营养学报, 2013, 35(6): 571-576.
董瑞霞, 李立祥, 王 茜, 等. 植物中原花青素含量测定[J]. 茶业通报, 2008, (2): 67-69.
马志本, 程玉娥. 关于苹果果实表面花青素含量的化学测定方法[J]. 中国果树, 1984, (4): 49-51.
Gon?alves S and Romano A. Production of plant secondary metabolites by using biotechnological tools [M]//Vijayakumar R, Raja S S S. Secondary metabolites-sources and applications. 2018: 81-99.
Espinosa Leal C A, Puente Garza C A, García Lara S. In vitro plant tissue culture: means for production of biological active compounds[J]. Planta, 2018, 248: 1-18.
Wang J, Li J, Li J, et al. Production of active compounds in medicinal plants: From plant tissue culture to biosynthesis[J]. Chinese Herbal Medicines, 2017, 9(2): 115-125.
Anwar A, Yan Y, Liu Y, et al. 5-Aminolevulinic acid improves nutrient uptake and endogenous hormone accumulation, enhancing low-temperature stress tolerance in cucumbers[J]. International Journal of Molecular Sciences, 2018, 19(11): 3379.
Nunkaew T, Kantachote D, Kanzaki H, et al. Effects of 5-aminolevulinic acid (ALA)-containing supernatants from selected Rhodopseudomonas palustris strains on rice growth under NaCl stress, with mediating effects on chlorophyll, photosynthetic electron transport and antioxidative enzymes [J]. Electronic Journal of Biotechnology, 2014, 17(1): 19-26.
Ahmad R, Ali S, Hannan F, et al. Promotive role of 5-aminolevulinic acid on chromium-induced morphological, photosynthetic, and oxidative changes in cauliflower (Brassica oleracea botrytis L.)[J]. Environmental Science and Pollution Research, 2017, 24: 8814-8824.
Sun Y P, Liu J, Cao R X, et al. Effects of 5-aminolevulinic acid treatment on photosynthesis of strawberry[J]. Photosynthetica, 2017, 55(2): 276-284.
Zheng J, An Y Y, Feng X X, et al. Rhizospheric application with 5-aminolevulinic acid improves coloration and quality in ‘Fuji apples[J]. Scientia Horticulturae, 2017, 224: 74-83.
Liu L, Xiong L, An Y, et al. Flavonols induced by 5-aminolevulinic acid are involved in regulation of stomatal opening in apple leaves[J]. Horticultural Plant Journal, 2016, 2(6): 323-330.
An Y, Feng X, Liu L, et al. ALA-induced flavonols accumulation in guard cells is involved in scavenging H2O2 and inhibiting stomatal closure in Arabidopsis cotyledons[J]. Frontiers in Plant Science, 2016, 7: 1713.
Tabuchi K, Mizuta H, Yasui H. Promotion of callus propagation by 5-aminolevulinic acid in a Laminaria japonica sporophyte[J]. Aquaculture Research, 2009, 41: 1-10.
Zheng J, An Y, Wang L. 24-Epibrassinolide enhances ALA-induced anthocyanin and flavonol accumulation in calli of ‘Fuji apple flesh[J]. Plant Cell, Tissue and Organ Culture, 2018, 134: 319-330.
汪良駒, 王中华, 李志强, 等. 5-氨基乙酰丙酸促进苹果果实着色的效应[J]. 果树学报, 2004(6): 512-515.
王中华, 汤国辉, 李志强, 等. 5-氨基乙酰丙酸和金雀异黄素促进苹果果皮花青素形成的效应[J]. 园艺学报, 2006(5): 1055-1058.
责任编辑:崔丽虹
