基于二维红外技术研究氧化羧甲基纤维素钠/胶原的相互作用及热稳定性
2021-09-14田振华何静瑄李从虎
田振华,何静瑄,王 颖,段 炼,李从虎
1. 陕西科技大学轻工科学与工程学院, 陕西 西安 710021 2. 轻化工程国家级实验教学示范中心(陕西科技大学), 陕西 西安 710021 3. 西南大学桑蚕纺织与生物质科学学院, 重庆 400715 4. 安庆师范大学生命科学学院, 安徽 安庆 246133
引 言
作为细胞外基质的主要成分, 胶原的主要生理机能是结缔组织的粘合物质, 起到保护机体与支撑器官的作用。 胶原分子特有的三股螺旋结构赋予其优异的生物学功能, 因此广泛应用于组织工程、 药物控释、 美容护肤等领域[1-2]。 然而, 三股螺旋结构易受到热、 酶、 外力等因素的影响, 可采用化学交联或共混对胶原进行改性以优化其性能。
羧甲基纤维素(CMC)是目前用量最大的纤维素种类, 其结构中含有大量的─COOH和─OH, 因此可与胶原形成氢键、 静电作用, 但由于两者之间仅存在非共价键作用, 所得复合材料部分性能仍有不足, 需辅以化学交联对胶原与CMC的复合材料进行改性。 氧化羧甲基纤维素(OCMC)是CMC经氧化后得到的产物, 分子中含有醛基(如图1所示), 能与胶原的自由氨基形成希夫碱反应、 引入共价键, 从而实现对胶原的共混与交联双改性。 在前期研究中, 考察了OCMC改性胶原水凝胶[3]及胶原膜的热稳定性[4], 发现OCMC显著提高不同相态胶原的热稳定性且热稳定性与交联键的数量密切相关。 然而, 曾有报道指出交联键在胶原变性过程中依然保留完整[5], 因此考察交联前后胶原的结构变化及温度效应对于研究OCMC对胶原结构及稳定性的影响具有重要的理论指导意义。
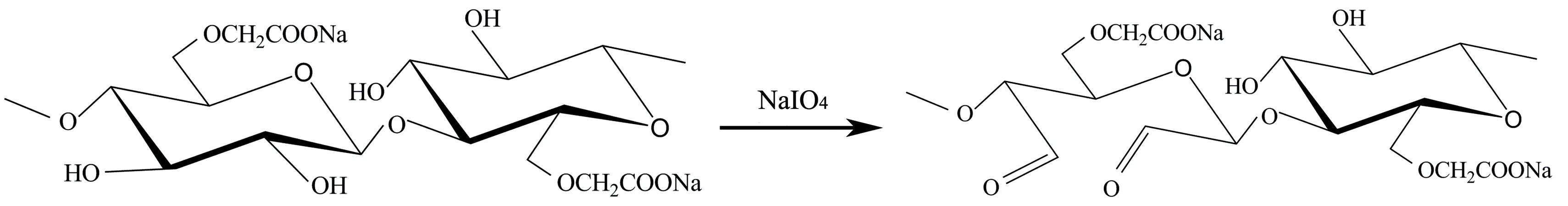
图1 氧化羧甲基纤维素制备原理示意图Fig.1 Schematic diagram of the preparation of OCMC
二维红外技术(2D-IR)是由Isao Noda提出的对一系列相关的红外光谱图进行分析, 得到分子化学键振动模式间相互关系的一种数学方法。 此技术不仅可以提高光谱的分辨率, 而且可以判断外扰条件改变时分子结构的响应顺序, 已被用于研究蛋白质的结构、 变性、 折叠和去折叠变化[6-7]。 Duan等[8]通过2D-IR分析了丝胶蛋白与胶原间的相互作用及其对胶原螺旋结构的影响, 证实2D-IR是分析胶原结构的一种有效手段。 2D-IR分析胶原结构方面的前期研究主要关注纯胶原在不同环境中的结构变化或小分子交联剂对胶原结构的影响, 而采用此技术研究天然大分子交联剂与胶原之间相互作用及其对胶原结构、 热稳定性等的影响鲜见报道。 本工作通过2D-IR技术分析OCMC与胶原间的相互作用, 以及改性前后胶原结构的温度效应以此表征OCMC对胶原稳定性的影响。
1 实验部分
1.1 材料与仪器
胶原海绵、 氧化羧甲基纤维素钠(OCMC), 实验室自制; Na2HPO4, NaH2PO4和NaCl, 分析纯, 广东光华科技有限公司。 傅里叶变换红外光谱仪, Vector-22, 德国Bruker公司。
1.2 OCMC改性胶原膜的制备
用PBS缓冲溶液(10 mmol·L-1Na2HPO4/NaH2PO4, 100 mmol·L-1NaCl, pH ~7.4)溶解胶原海绵、 OCMC, 分别配置6 mg·mL-1的胶原溶液和250 mg·mL-1的OCMC溶液。 随后将OCMC分次滴加至胶原溶液中, 最终OCMC与胶原的质量比分别为0∶1, 1∶1, 2∶1, 3∶1, 4∶1和5∶1, 依次命名为C0, C1, C2, C3, C4和C5; 反应24 h后将所得改性样品离心脱泡后倒入聚四氟乙烯圆盘中, 室温下自然干燥, 待成膜后用超纯水进行清洗以除去盐和未结合的OCMC等干扰物, 自然干燥后置于干燥器中平衡水分, 待测。
1.3 红外光谱图采集及2D-IR谱图绘制
将纯胶原C0与改性胶原C5置于培养箱中, 25~125 ℃范围内每升高10 ℃培养30 min后采集不同温度下的样品红外光谱。 分辨率为4 cm-1、 扫描信号64次。 基于所采集的红外光谱数据, 利用软件2D shige (Kwansei Gakuin University)计算生成二维红外数据, 基于Origin 8.0绘制2D-IR谱图。 图中实线和虚线分别代表正相关峰和负相关峰。
2 结果与讨论
2.1 OCMC与胶原间的相互作用
2.1.1 一维红外谱图分析
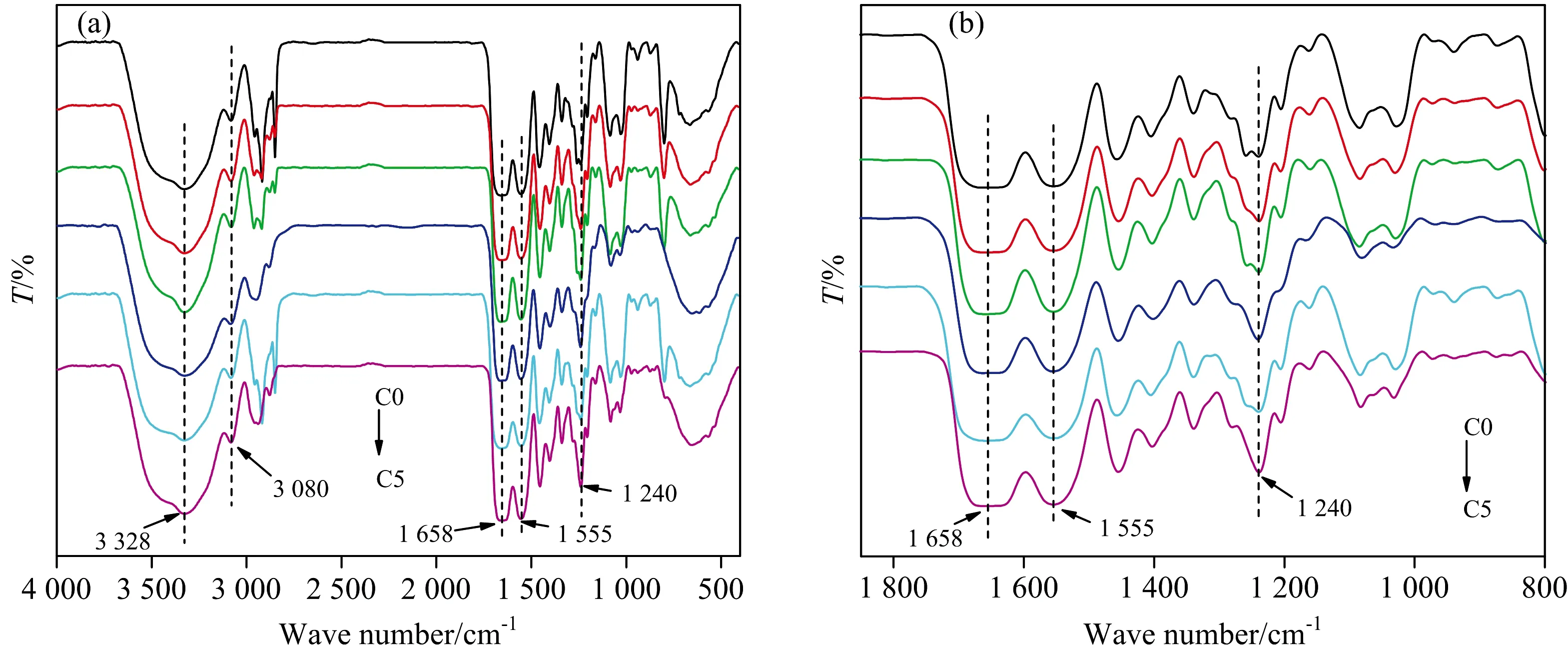
图2 不同量OCMC改性胶原的红外全谱图(a)和放大谱图(b)Fig.2 FITR spectra (a) and enlarge spectra (b) of collagen cross-linked with OCMC
为0.980, 而C1, C2, C3, C4和C5分别为0.997, 1.022, 1.002, 1.014和1.016, 均接近于1.000, 可知改性后胶原保留了完整的螺旋结构[11]。 然而, 改性后胶原的特征吸收峰并没有发生明显频移, 无法获知两者间的相互作用。
2.1.2 二维红外谱图分析OCMC与胶原间的相互作用
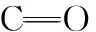
为了进一步证实两者之间发生上述相互作用的可能性, 对各反应基团所对应的自相关峰的强度变化及响应顺序以及实验条件下胶原、 OCMC的带电情况进行分析。
通过自相关峰的强度评判所对应结构对外扰的敏感程度: 1 730 cm-1>1 320 cm-1>1 500 cm-1>1 435 cm-1>1 236 cm-1>1 610 cm-1, 可知OCMC醛基和胶原N─H和C─N结构变化较大, 表明两者间相互作用以OCMC醛基与胶原氨基的交联反应为主。
图3(b)即异步谱由复杂的异步交叉峰Ψ(ν1,ν2)组成, 可辅助提供物质结构对外扰条件的响应信息。 结合同步谱与异步谱, 根据野田规则[当Φ(ν1,ν2) 和Ψ(ν1,ν2)同为正或同为负时,ν1先于ν2; 当两者一正一负时,ν1后于ν2]可判断吸收峰的响应顺序(如表1所示)[14]。 在OCMC用量增加时, 胶原中各吸收峰的响应顺序为1 500 cm-1>1 236 cm-1>1 610 cm-1, 胶原的N─H和C─N结构最先响应; OCMC各吸收峰的响应顺序为1 320 cm-1>1 435 cm-1>1 730 cm-1, 羧基的响应先于醛基; 换言之, OCMC首先通过羧基与胶原发生相互作用, 随后醛基与胶原氨基发生希夫碱交联反应。

表1 交叉峰的特征及OCMC改性胶原结构的响应顺序Table 1 Cross-peaks intensities and the response order of cross-linked collagens
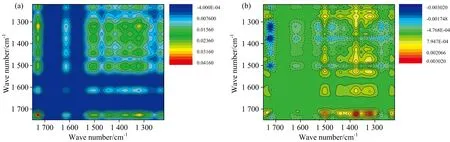
图3 不同量OCMC改性胶原的二维红外同步图(a)和异步图(b)Fig.3 2D synchronous (a) and asynchronous (b) spectra of collagens cross-linked by OCMC
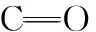
2.2 OCMC对胶原热稳定性的影响
2.2.1 一维红外谱图分析
图4是纯胶原(C0)与改性胶原(C5)在不同温度下的红外全谱图[图4(a,c)]及1 850~800 cm-1范围内的放大谱图, 如图4(b,d)所示。 随温度的升高, 纯胶原的酰胺A带和B带分别降低了7和5 cm-1; 而改性胶原[图4(c)]的酰胺A带和B带仅降低了4和3 cm-1。 此外, 纯胶原[图4(b)]酰胺Ⅰ, Ⅱ和Ⅲ带分别向低波数移动3, 10和4 cm-1; 对于改性胶原[图4(d)], 酰胺Ⅰ带没有发生明显的移动, 酰胺Ⅱ、 Ⅲ带分别向低波数移动5和2 cm-1。 综上所述, 改性前后胶原的特征吸收峰均发生红移; 此外, 酰胺Ⅰ, Ⅱ和Ⅲ带吸收峰的峰形由尖峰逐渐变为宽峰, 表明分子间缔合氢键减弱, 而胶原螺旋结构的稳定性归功于氢键, 由此可知升温过程中胶原结构发生了变化[10]; 然而后者的红移程度小于前者, 说明改性胶原的热稳定性高。 通过AⅢ/A1 455值判断胶原三股螺旋结构的完整性。 如表2所示, 纯胶原的AⅢ/A1 455值由0.980降低至0.663, 说明三股螺旋结构发生解旋; 改性胶原的AⅢ/A1 455值也呈现下降趋势, 但同一温度下, 改性胶原的AⅢ/A1 455值略大于纯胶原, 证实了OCMC提高了胶原的热稳定性。
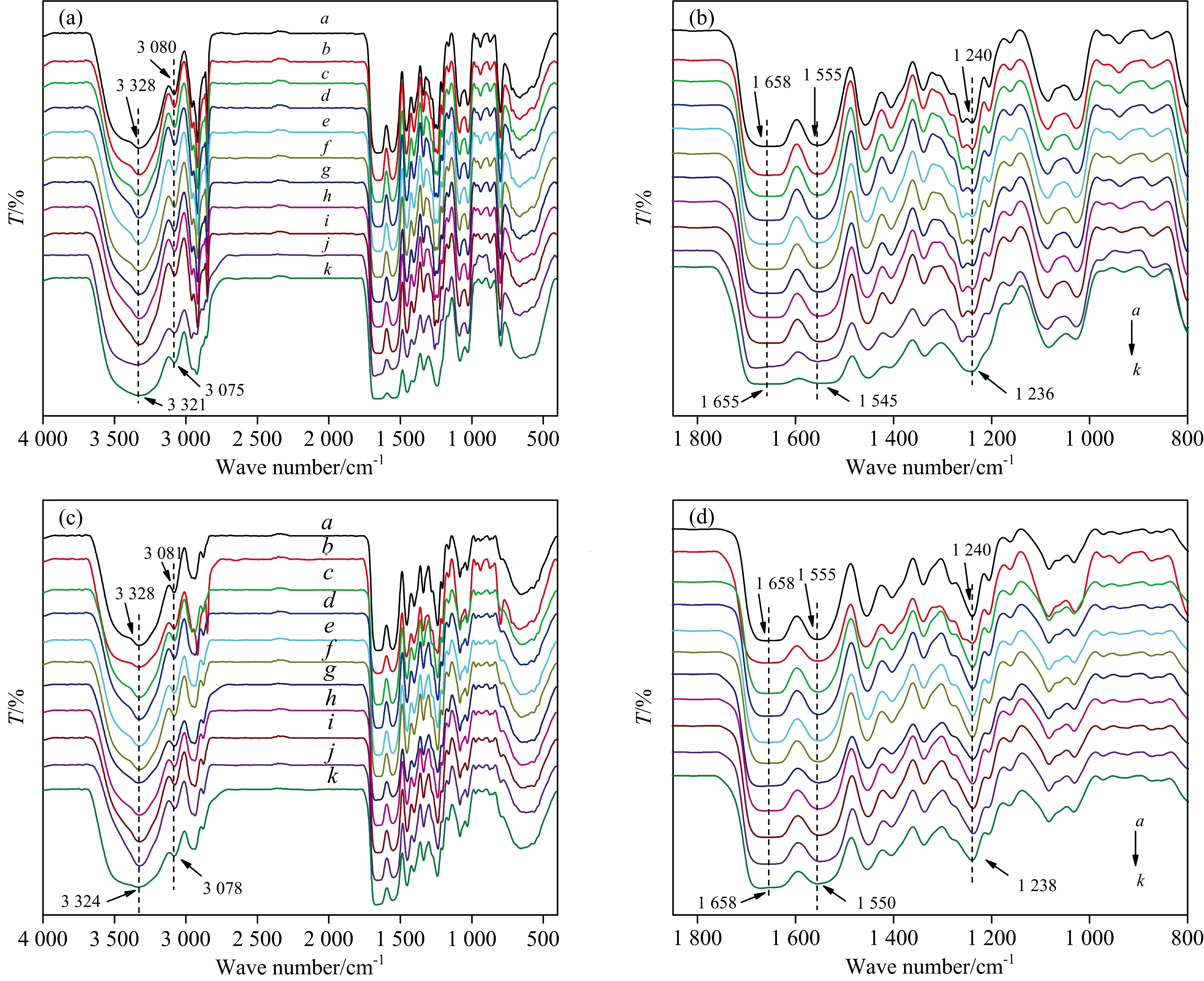
图4 不同温度下纯胶原(a,b)与改性胶原(c,d)的红外全谱图及放大谱图a→k: 25~125 ℃Fig.4 Temperature-dependent infrared spectra and enlarge spectra of native collagen (a,b) and cross-linked collagen (c,d)a→k: 25~125 ℃
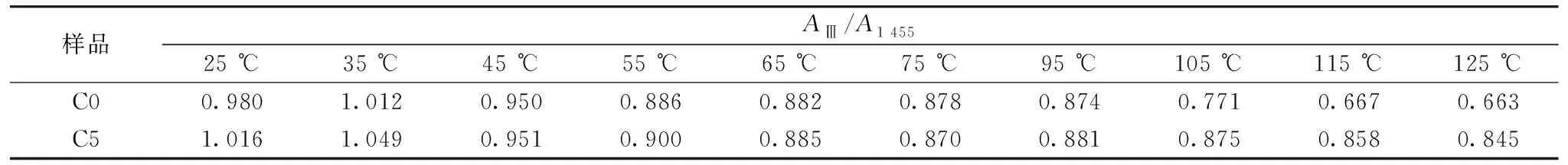
表2 不同温度下纯胶原与改性胶原的AⅢ/A1 455值Table 2 AⅢ/A1 455 values of native and cross-linked collagens at various temperatures
2.2.2 二维红外谱图分析OCMC对胶原热稳定性的影响
图5为以温度为外扰、 1 750~1 220 cm-1范围内纯胶原与改性胶原的二维同步图与异步图。 图5(a)中, 1 655,1 555,1 500,1 455和1 240 cm-1处自相关峰的出现说明升温过程中胶原二级结构发生了明显变化[11]。 其中1 655,1 555和1 240 cm-1处吸收峰来自于胶原的螺旋结构; 1 500 cm-1处来自于胶原无规卷曲结构。 与图5(a)相比, 图5(c)中除了上述自相关峰外, 1 730,1 610,1 435和1 320 cm-1处也出现了明显的自相关峰。
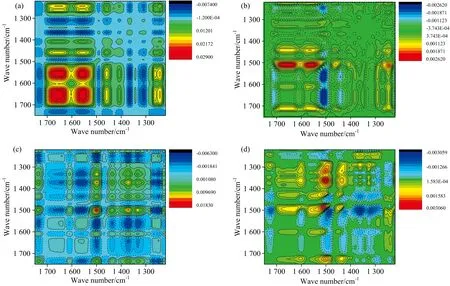
图5 不同温度下胶原(a,b)与改性胶原(c,d)的二维红外同步图与异步图Fig.5 Temperature-dependent 2D synchronous and asynchronous infrared spectra of native (a,b) and cross-linked collagen (c,d)
正交叉峰Φ(1 655, 1 555),Φ(1 555, 1 240)与负交叉峰Φ(1 655, 1 610),Φ(1 555, 1 500)的出现说明来源于螺旋结构的酰胺Ⅰ, Ⅱ, Ⅲ带(1 655, 1 555和1 240 cm-1)的变化方向一致, 但与来源于无规卷曲结构的酰胺Ⅰ和Ⅱ带(1 610, 1 500 cm-1)相反。 由此得到如下结论: 升温过程中, 改性前后胶原二级结构的崩塌均表现为螺旋结构转变为无规卷曲结构。 此外, 对比自相关峰的强度可知, 胶原对温度最为敏感的结构是来自螺旋结构的酰胺Ⅰ和Ⅱ带(1 655, 1 555 cm-1)、 最后为来自无规卷曲结构的酰胺Ⅱ带(1 500 cm-1)。 然而, 对于改性胶原, 其强度大小顺序发生了明显变化, 最为敏感的是胶原无规卷曲结构的酰胺Ⅱ带(1 500 cm-1), 而螺旋结构(1 655 cm-1)最不敏感, 反映出改性胶原的螺旋结构得到稳定。
结合同步图[图5(a,c)]与异步图[图5(b,d)]判断吸收峰的响应顺序, 如表3所示。 升温过程中胶原无规卷曲结构的酰胺Ⅱ带首先响应, 其次为螺旋结构的酰胺Ⅲ带和Ⅰ, Ⅱ带, 最后响应的是CH3反对称弯曲振动; 改性后仍然是胶原无规卷曲结构的酰胺Ⅰ和Ⅱ带发生响应, 其次为OCMC中的结构响应, 最后为胶原螺旋结构的酰胺Ⅰ和Ⅱ带, 说明改性胶原螺旋结构的响应发生滞后, 可证实OCMC对胶原的稳定作用主要归功于三股螺旋结构的加固。

表3 交叉峰的特征及升温过程中胶原及改性胶原结构的响应顺序Table 3 Cross-peaks intensities and the response order of native and cross-linked collagens
3 结 论
交联剂氧化羧甲基纤维素钠(OCMC)的加入不会破坏胶原的三股螺旋结构, 而且随着用量的增多, OCMC首先通过羧基与胶原中精氨酸的胍基或赖氨酸的氨基发生静电作用, 随后醛基与胶原氨基之间发生希夫碱反应并且两者之间的相互作用以希夫碱交联反应为主。 此外, OCMC的引入稳定了胶原的螺旋结构, 因此在升温过程中, 改性后胶原的螺旋结构对温度的敏感度降低, 且螺旋结构对温度的响应发生滞后。
