山银花总黄酮提取工艺优化及抑制α-葡萄糖苷酶活性研究
2021-09-14易灿周新崇王亚举刘进兵
易灿,周新崇,王亚举,刘进兵
(邵阳学院 食品与化学工程学院,湖南 邵阳,422000)
山银花为忍冬科植物灰毡毛忍冬、红腺忍冬、华南忍冬或黄褐毛忍冬的干燥花蕾或带初开的花[1],主要分布在长江以南的湖南、四川、广东、贵州、广西、云南、江西、浙江及海南等省份。山银花是我国传统的药食两用植物,含有丰富的绿原酸、黄酮类、酚类物质等生物活性物质[2],具有显著的抗氧化、抗菌、抗炎、抗肿瘤、抗病毒、降血糖和降血脂等功能[3-4]。
山银花的有效成分提取方法主要有水提法[5]、回流醇提法[6]、超声波提取法[7]、微波提取法[8]、酶解法[9]和超临界提取法等[10]。水提法操作简单、安全、环保、生产成本低,但杂糅、蛋白质等杂质较多,后续提纯较为复杂[5]。超声、微波提取法与水提、醇提法提取率较高,但操作步骤繁琐,不利于工业生产[11]。
研究发现,山银花除了在制药行业有开发价值外,在食品和化妆等领域也有市场价值。本实验利用微波辅助法提取山银花总黄酮并进行优化,并测定了其α-葡萄糖苷酶的抑制活性,运用酶动力学探讨了微波辅助提取物对α-葡萄糖苷酶的抑制机制,为进一步综合利用山银花资源提供参考。
1 材料与仪器
隆回山银花(湖南省隆回县农贸市场);阿卡波糖(上海阿拉丁生化科技股份有限公司);芦丁对照品(纯度≥98%)(中国食品药品检定研究院);α-葡萄糖苷酶(α-glucosidase,G5003-100UN),对硝基-α-D-吡喃葡萄糖苷(pNPG)(美国Sigma化学公司),其他均为国产分析纯。
SF-130型高速中药粉碎机(中南制药机械厂);MCR-3常压微波化学反应器(巩义市中天仪器科技有限公司);UV-2600型紫外可见分光光度计(岛津(上海)实验器材有限公司;Thermo U3000高效液相色谱仪(赛默飞世尔科技(中国)有限公司);PT-3502C全波长酶标分析仪(北京普天新桥技术有限公司);Cary Edipse荧光分光光度计(安捷伦科技有限公司)。
2 方法
2.1 总黄酮含量的测定
2.1.1 山银总黄酮的提取
将去杂后的山银花花蕾摊平于瓷盘中,置于60 ℃电热鼓风干燥箱中,恒温干燥24 h至干燥。将烘干的山银花花蕾样品于中草药粉碎机中粉碎,过 60 mm,样品装入磨口瓶中,置于4 ℃冰箱中保存备用。
精确称取1.00 g经石油醚脱脂12 h的粉末,按一定料液比,加入适量一定浓度的乙醇,在一定时间内进行微波辅助提取,提取完成后过滤,将滤液减压浓缩,再用70%乙醇定容至25 mL,作为待测液备用。
2.1.2 黄酮提取率的测定
黄酮类化合物的测定采用硝酸铝比色法[12]。精密吸取待测液200 μL于10 mL EP管中,加5%的亚硝酸钠溶液200 μL,静置6 min后加入10%的硝酸铝溶液200 μL,静置6 min后再加4%的氢氧化钠溶液2 mL,摇匀,静置15 min,最后,以75%的乙醇溶液定容至10 mL。在波长为510 nm处用紫外分光光度计测吸光值,将吸光度(A)代入芦丁回归方程公式:C=0.012 86A-0.008 14,R2=0.999 02中,可得测定的供试样品溶液的总黄酮浓度(C),再计算出样品中的总黄酮提取率η:
式中:C为粗提取样液中总黄酮的浓度,mg/mL;V为提取液体积,mL;N为稀释倍数;M为山银花粉末样品质量,mg。
2.2 山银花总黄酮工艺优化
2.2.1 单因素试验设计
分别对影响山银花总黄酮微波辅助提取过程中的 4 个因素(料液比(g/mL)、微波功率(W)、提取时间(min)和乙醇浓度(%))进行单因素实验。
2.2.2 响应面试验设计
在完成上述4种单因素实验的基础上,本实验以料液比、微波功率、提取时间和乙醇浓度为自变因素,设计四因素三水平L9(34)的正交试验,利用Design-Expert软件进行响应面试验设计和数据分析,进一步得出微波辅助法优化提取山银花总黄酮的最佳工艺条件。响应面试验设计因素水平见表 1。

表1 响应面试验设计因素水平Table 1 The level of response surface test design factors
2.3 山银花提取物的抑制α-葡萄糖苷酶研究
山银花提取物的抑制α-葡萄糖苷酶酶活性及抑制动力学参照文献[13-14]中方法选择。
3 结果与讨论
3.1 山银花总黄酮的工艺优化
3.1.1 单因素试验结果
山银花单因素试验结果见图1。
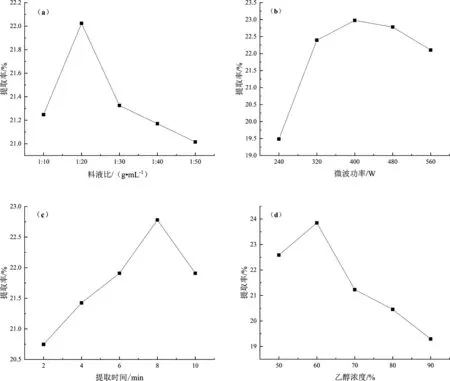
图1 山银花总黄酮的单因素实验Fig.1 Single factor experiment of total flavonoids in Lonicerae Flos
3.1.2 响应面试验结果及方差分析
在单因素试验的基础上,利用响应面分析法优化辅助山银花总黄酮的提取工艺。响应面试验因素结果见表 2。利用 Design-Expert 软件对实验数据进行分析,得到二次多项回归方程:
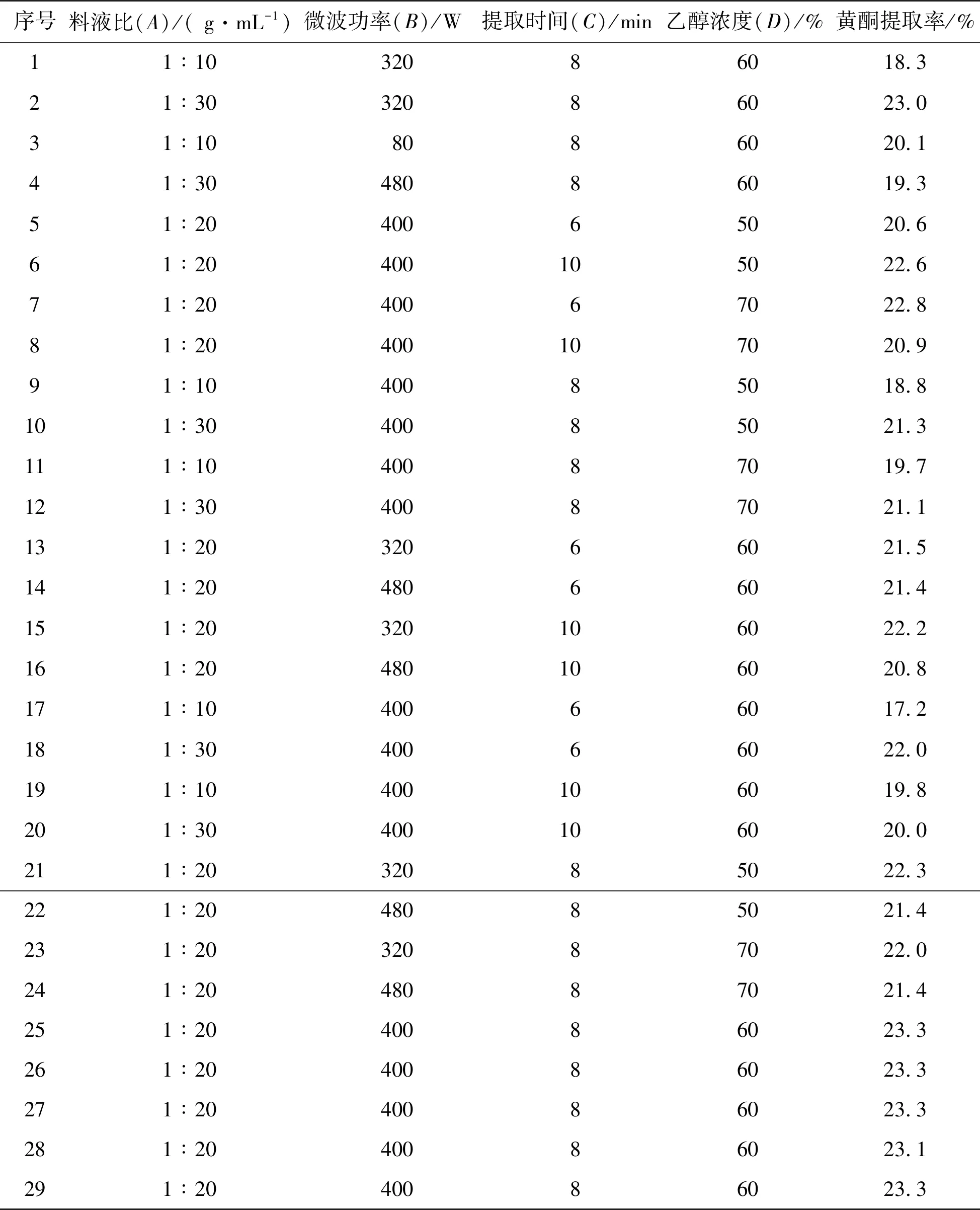
表2 响应面分析法结果Table 2 The results of response surface analysis
R=23.26+1.07A-0.415 8B+0.073 2C+0.070 3D-1.37AB-1.13AC-0.248 5AD-0.323 5BC+
0.082 0BD-0.965 0CD-2.42A2-0.785 4B2-0.988 6C2-0.632 6D2
其中:R为黄酮提取率;A,B,C和D分别为液料比、微波功率、提取时间和乙醇浓度。
由表3可知,对单因素来说,料液比、微波功率对总黄酮提取率影响比较差异均有统计学意义(P<0.05),影响程度为A(料液比)>B(微波功率)>C(提取时间)>D(乙醇浓度)。

表3 回归分析结果Table 3 The results of variance analysis
乙醇浓度、提取时间、料液比、微波功率交互作用对山银花总黄酮提取率影响的响应曲面图见图2。对于交互作用来说,AB,AC,AD,BC以及CD的交互效应对总黄酮提取率的影响比较差异有统计学意义(P<0.05),BD的交互效应对总黄酮提取率的影响比较差异无统计学意义(P>0.05),但对于模型的二次项的影响比较差异有统计学意义(P<0.05)。
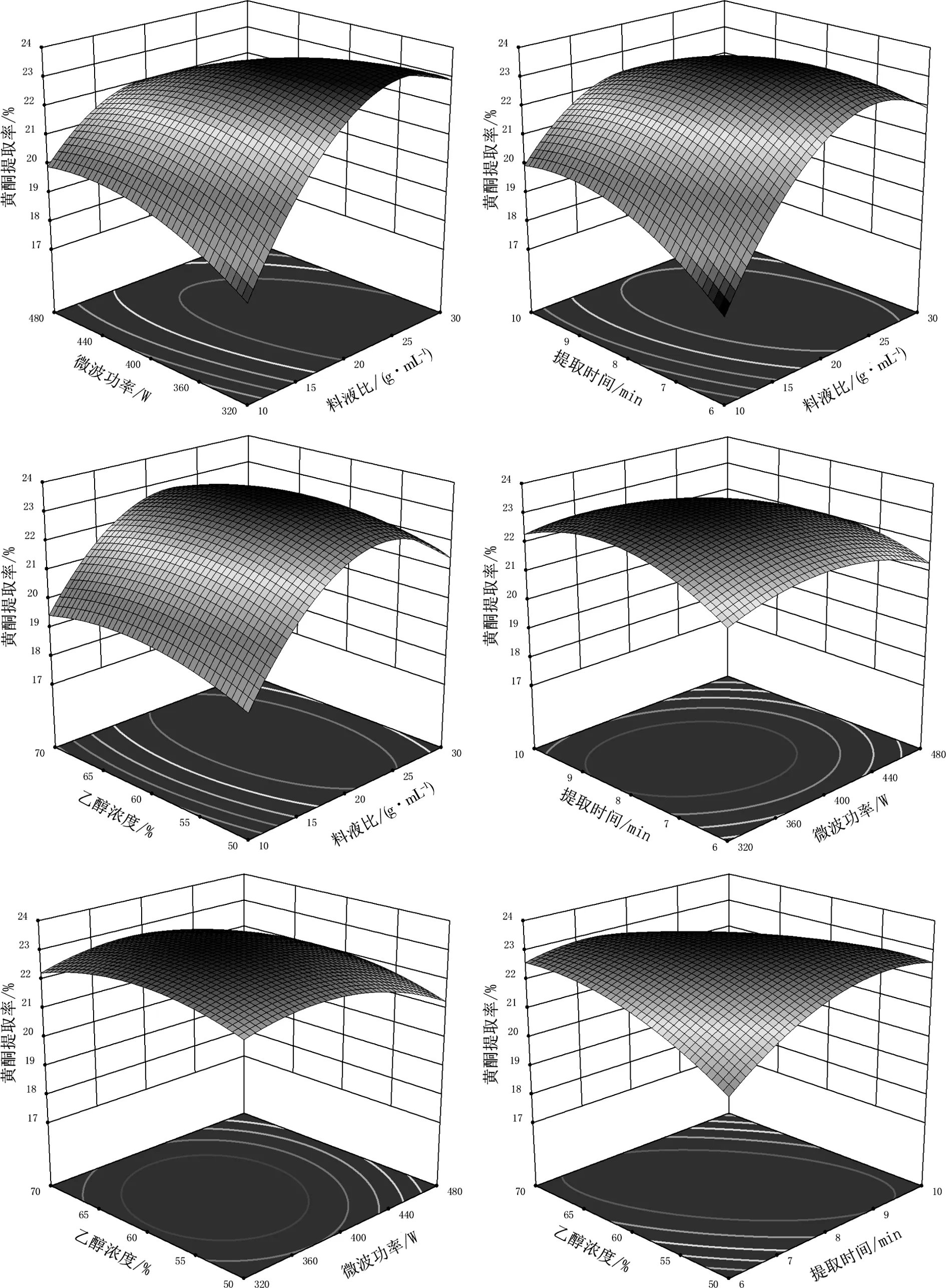
图2 两两因素交互作用对山银花总黄酮提取率影响的响应面图Fig.2 Response surface map of the interaction of two factors on the extraction rate of total flavonoids from Lonicerae Flos
3.1.3 预测模型和方法验证
用Design-Expert 12软件得出山银花总黄酮的最佳提取条件如下:料液比为1∶20.5 g/mL,时间为 8.0 min,乙醇体积分数为60.5%,功率为394 W,在此条件下模型预测的总黄酮提取率为 23.3%。根据实验室条件以及模型预测结果确定微波最佳提取条件如下:料液比为1∶20.5 g/mL,提取时间为8 min,乙醇体积分数为 60%,微波功率为400 W,并在此提取条件下检测响应面的最佳响应适宜性。实验结果表明,山银花总黄酮提取率为23.1%,与预测值的相对误差为1.22%。这个实际山银花总黄酮的提取率与所建立模型预测的山银花总黄酮提取率相差不大,说明构建的模型是有效的。表明利用响应面法优化工艺条件准确可靠,且在实际操作中具备一定的可行性。
3.2 山银花提取物对α-葡萄糖苷酶的影响
3.2.1 山银花总黄酮提取物对α-葡萄糖苷酶活性的抑制作用
糖尿病是一种可预防的代谢紊乱,其特征是血液中葡萄糖含量异常高,胰岛素分泌失调[15]。α-葡萄糖苷酶是一种小肠消化酶,是人体内主要的代谢酶之一,能迅速降解膳食中的淀粉,导致血糖水平迅速升高[16],目前,天然α-葡萄糖苷酶抑制剂研究得到广泛关注。以阿卡波糖为对照,得到山银花提取物对对α-葡萄糖苷酶的抑制作用结果见图3。

图3 阿卡波糖和山银花提取物对α-葡萄糖苷酶的抑制作用Fig.3 Inhibition of acarbose and Lonicerae Flos extract on α-glucosidase
3.2.2 山银花提取物对α-葡萄糖苷酶抑制动力学分析
山银花微波辅助醇提取物对α-葡萄糖苷酶抑制的Lineweaver-Burk曲线见图4。文献[17]最大反应速率Vmax减小,米氏常数Km增大,表4结果与此结果一致。由此推断它对α-葡萄糖苷酶的抑制作用类型为混合型抑制。
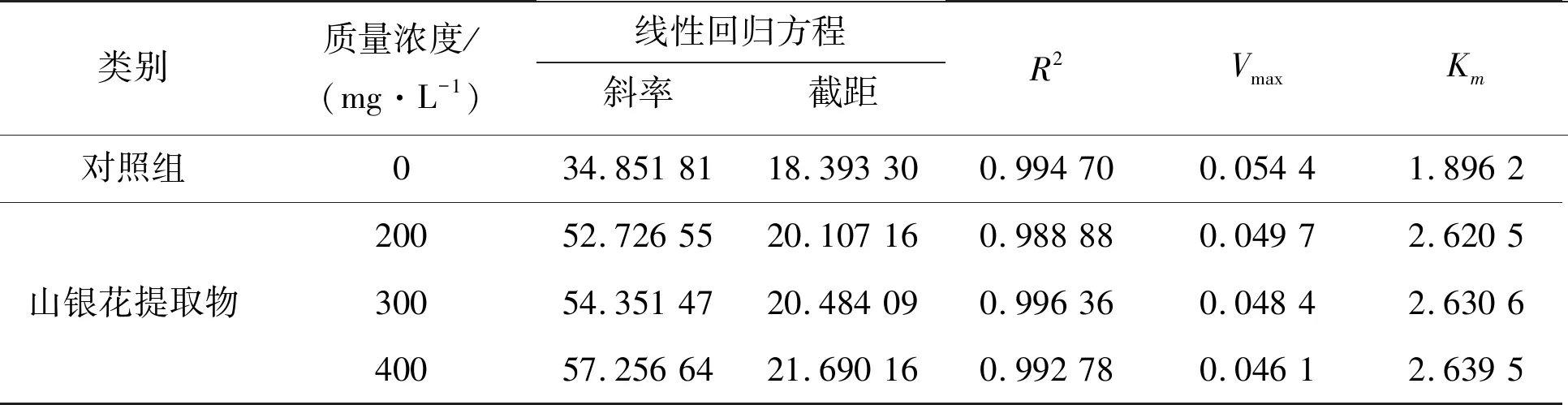
表4 山银花提取物对α-葡萄糖苷酶抑制作用的Lineweaver-Burk方程Table 4 Lineweaver Burk equation of inhibition of Lonicerae Flos extract on α -glucosidase

图4 山银花微波辅助醇提取物对α-葡萄糖苷酶抑制的Lineweaver-Burk曲线Fig.4 Lineweaver Burk curve of α-glucosidase inhibition by microwave-assisted ethanol extract of Lonicerae Flos
3.2.3 山银花提取物对α-葡萄糖苷酶的荧光淬灭作用
荧光猝灭滴定法被广泛应用于研究小分子与蛋白质的相互作用[18]。如图5所示,小分子物质在α-葡萄糖苷酶荧光峰附近有荧光发射峰,随着山银花微波辅助醇提取物浓度增大,α-葡萄糖苷酶的荧光发射峰的强度逐渐降低,可以推断山银花微波辅助醇提取物与α-葡萄糖苷酶之间发生了相互作用。

图5 在310 K下山银花提取物对α-葡萄糖苷酶的荧光作用Fig.5 Fluorescence of Lonicera Flos extract on α-glucosidase at 310 K
3.2.4 山银花提取物对α-葡萄糖苷酶的荧光猝灭机理
根据式(1)Stern-volmer 方程,将山银花微波辅助醇提取物浓度对F0/F作图,结果见图6。由图6可知:F0/F与[Q]呈良好的线性关系。山银花提取物与α-葡萄糖苷酶相互作用的 Stern-Volmer 方程参数见表5,可知随着温度升高,淬灭常数Ksv减小,从而可判断山银花波辅助醇提取物对α-葡萄糖苷酶的荧光淬灭方式属于静态淬灭。

表5 山银花提取物与α-葡萄糖苷酶相互作用的 Stern-Volmer 方程参数Table 5 Parameters of stern Volmer equation for interaction between Lonicera Flos extract and α-glucosidase
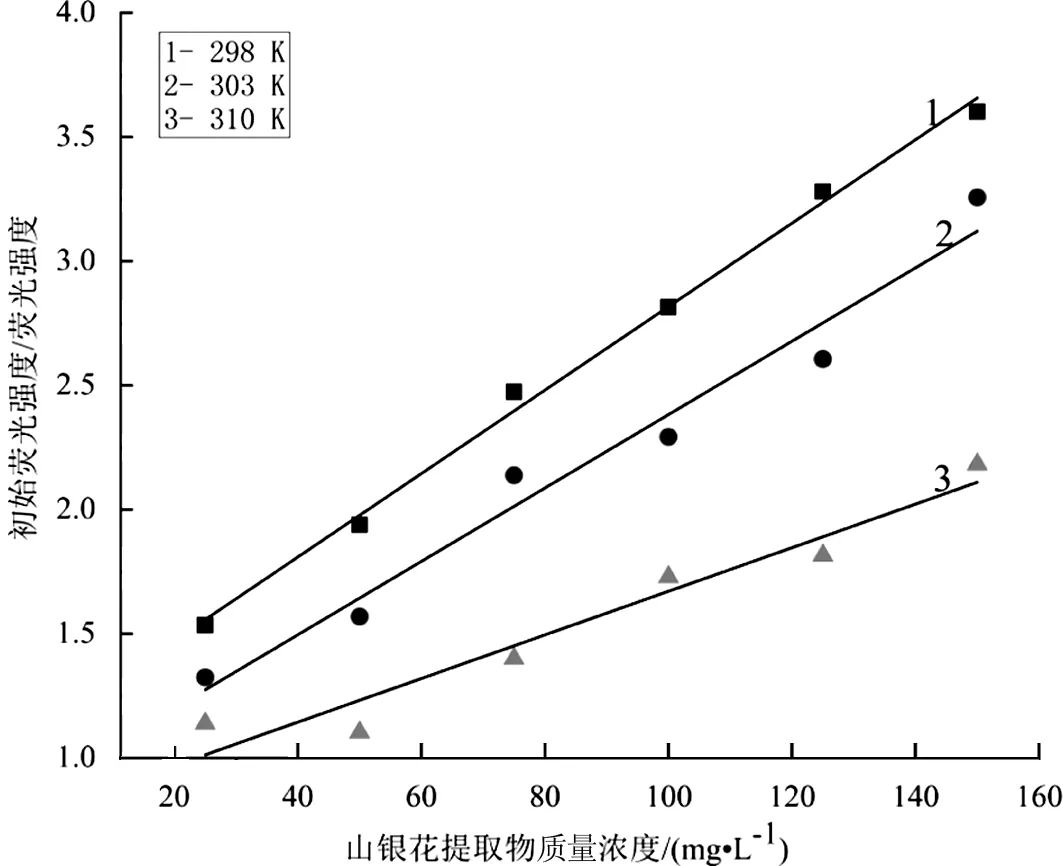
图6 不同温度下山银花提取物对α-葡萄糖苷酶荧光猝灭的Stern-Volmer图Fig.6 Stern Volmer plots for the fluorescence quenching of α-glucosidase by Lonicera Flos extract at different temperatures
(1)
式中:F0为荧光物质的初始荧光强度;F为相互作用后荧光物质的荧光强度;Kq为双分子猝灭过程的速率常数;Ksv为Stern-Volmer方程猝灭常数;τ0为猝灭剂不存在时,生物大分子的荧光平均寿命,一般为10-8s;[Q]为荧光淬灭剂浓度。
4 结论
采用微波辅助法提取山银花总黄酮,并用响应面法优化其工艺条件,得到最佳工艺条件为料液比为1∶20.5 g/mL,时间为8.0 min,乙醇体积分数为60.5%,功率为394 W,该优选的工艺操作简单,提取时间短,预测性强。山银花提取物对α-葡萄糖苷酶具有一定的抑制作用,半数抑制浓度为378.44 mg/L,抑制效果低于阳性对照阿卡波糖(半数抑制浓度为200.10 mg/L)。山银花提取物和α-葡萄糖苷酶的相互作用按照静态淬灭进行,其抑制类型为混合型抑制。
