揭阳市新发HIV感染者免疫印迹条带分型与免疫抑制的关系
2021-09-14林耿辉方桂真
林耿辉,方桂真
(揭阳市疾病预防控制中心 检验科,广东 揭阳 522031)
近年来,伴随社会发展以及人们生活习惯的改变,艾滋病蔓延速度有所增快,对人们的健康造成威胁[1]。尽管抗反转录病毒药物的应用已得到普及,使此病成为可以控制的慢性传染病,但患者的预后和长期生存质量仍不容乐观。大量研究显示,CD4+T淋巴细胞计数能够较为客观地反映患者机体免疫功能衰退情况[2]。抗病毒治疗能够通过提升CD4+T淋巴细胞水平,以调整CD4+/CD8+比值水平。免疫印迹试验作为目前人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染中最常用的确证实验之一,已在各级疾病预防控制中心广泛开展[3]。由于新发HIV感染者尚未接受临床干预,其分子生物学改变能够更为真实地反映病毒感染后的病理生理变化,故本研究选取2017年1月至2019年12月揭阳市疾病预防控制中心确诊的共计1 168例新发HIV感染者,探讨HIV印迹条带与CD4+T淋巴细胞水平的相关性。
1 资料与方法
1.1 一般资料选取2017年1月至2019年12月揭阳市疾病预防控制中心确诊的共计1 168例新发HIV感染者作为研究对象,其中2017年620例,2018年400例,2019年148例。(1)纳入标准:①年龄≥18岁;②依据《全国艾滋病检测技术规范(2020年修订版)》中相关诊断标准[4],首次确诊为HIV感染;③确诊HIV感染后即接受相关检查,且临床资料完整。(2)排除标准:①合并其他免疫性疾病;②合并重要器官器质性病变;③无法配合完成抗病毒治疗;④处于妊娠或哺乳期。本研究经疾病预防控制中心医学伦理委员会审批,研究对象均签署知情同意书。
1.2 检测及分组方法HIV感染确诊当日,使用BD FACS Calibur流式细胞仪以及该公司的Tritest-CD4-FITC抗体,采用单平台法检测感染者CD4+T淋巴细胞计数。根据CD4+T淋巴细胞计数进行分组。依据第8版《内科学》[4],将CD4+T≥500个·μL-1者纳入无免疫抑制组,CD4+T≥200个·μL-1且<500个·μL-1者纳入轻中度免疫抑制组,CD4+T<200个·μL-1者纳入重度免疫抑制组。进行免疫印迹试验。使用HIV 1+2型抗体免疫印迹试剂盒(HIV BLOT 2.2)对上述标本抗体进行带型分析。试剂盒购于MP生物医学亚太有限公司,实验操作过程严格按照试剂盒产品说明书进行。
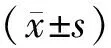
2 结果
2.1 新发HIV感染者免疫印迹带型新发HIV感染者免疫印迹带型见表1。

表1 新发HIV感染者免疫印迹带型(n=1 168)
2.2 新发HIV感染者CD4+T淋巴细胞计数无免疫抑制组、轻中度免疫抑制组、重度免疫抑制组分别有246例(21.06%)、526例(45.03%)、396例(33.90%),CD4+T淋巴细胞计数分别为(576.34±103.42)、(354.29±92.30)、(99.04±23.41)个·μL-1。
2.3 不同免疫功能HIV感染者免疫印迹带型分布3组感染者env和pol抗体阳性率差异无统计学意义(P>0.05)。在gag蛋白抗体检测中,p55阳性率组间差异无统计学意义(P>0.05),p24和p17阳性率组间差异有统计学意义(P<0.05),其中重度免疫抑制组p24阳性率低于轻中度免疫抑制组(P<0.017),p17阳性率高于其他两组(P<0.017)。见表2。

表2 不同免疫功能HIV感染者的免疫印迹带型分布[n(%)]
3 讨论
HIV感染诊断的金标准是HIV抗体检测,免疫印迹法对HIV抗体检测的价值已得到广泛认可[5]。作为HIV病毒的主要基因结构,gag、pol和env这3个编码区能够编码若干特异性蛋白,这些蛋白进入机体后会通过免疫反应产生相应抗体,这是HIV抗体检测的生物分子学依据[6]。
在本研究中,经过对免疫印迹带型分析,发现如下特征:(1)抗env基因编码的gp120一般与gp160相伴出现,这与前人研究结果相符,gp160是包膜糖蛋白前体,能够通过裂解产生gp120,且gp120只有1条产生途径,因而gp120不可能脱离gp160而单独存在[7];(2)抗pol基因编码抗体p31、p51和p66的检出率较高,均在95%以上,而抗gag基因编码抗体p17、p24和p55的检出率较低,这种差异的内在原因及分子生物学机制有待于进一步研究;(3)全条带和次条带在本研究选取的1 168例新发HIV感染者中占比最高,其中gp120和gp160均无缺失,但其余基因抗体均有不同程度的缺失,其中缺失率最高的抗体为p55,之后依次为p17、p51及p31。以上特征基本符合我国其他省市HIV抗体免疫印迹带型分布特征[8]。
CD4+T淋巴细胞是人体被HIV病毒侵袭后主要受攻击细胞,且伴随CD4+T淋巴细胞绝对数量的进行性下降,患者免疫功能缺陷愈发严重,机会性感染以及恶性肿瘤的发生风险均大幅增加,健康和生命安全受到严重威胁[9]。因此,对于新发HIV感染者而言,其确诊时的CD4+T淋巴细胞水平是评价患者免疫功能的重要指标[10]。本研究根据研究对象的CD4+T淋巴细胞计数将其分为无免疫抑制组、轻中度免疫抑制组和重度免疫抑制组,其中无免疫抑制组感染者占比最小,提示在HIV确诊早期,感染者免疫功能大多已受到不同程度的损害。对3组感染者的免疫印迹带型分布进行比较,结果显示3组感染者env、pol带型分布差异无统计学意义,提示这2种带型很少受病程影响,在免疫功能受损程度不同的感染者中均有较高的表达率,其抗体水平对感染者免疫系统破坏程度的评估价值相对有限[11]。gag蛋白抗体中,除p55以外,p24和p17抗体阳性率组间差异有统计学意义,提示这2种蛋白的缺失与机体免疫功能受损程度密切相关,这与国外学者的研究结果[12]基本相符,其具体机制目前尚无定论,可能与HIV大量复制对抗体的消耗有关。
综上所述,免疫印迹带型分布能够在一定程度上反映新发HIV感染者的疾病进展和免疫功能受损程度,为临床确定疾病分期、监测疾病进展提供一定参考。
