MicroRNA-409-3p通过靶向ZEB1促进HCMV感染的胶质瘤细胞迁移的机制研究
2021-09-13余波张丙旭钟文静王斌钱冬萌胡明
余波 张丙旭 钟文静 王斌 钱冬萌 胡明


摘要:近年来的临床研究显示人巨细胞病毒(HCMV)与神经胶质瘤关系密切,但HCMV促进胶质瘤进展的机制仍未阐明,而microRNA(miRNA)在神经胶质瘤中被检测到异常表达,因此提出潜伏感染的HCMV会通过调节宿主细胞miRNA从而影响神经胶质瘤发生发展的假设。首先通过转录组分析和细胞实验,证实miR-409-3p在HCMV感染后显著下调。生物信息学预测显示锌指结合蛋白1(ZEB1)为其下游靶基因。miR-409-3p过表达后的细胞划痕实验以及Transwell迁移实验证实,miR-409-3p的过表达会导致ZEB1下调并抑制胶质瘤U87细胞迁移,而外源性过表达ZEB1可恢复U87细胞迁移能力。研究结果表明,潜伏感染的HCMV能够通过下调宿主细胞中miR-409-3p,从而上调ZEB1表达,促进神经胶质瘤细胞迁移。
关键词:人巨细胞病毒;microRNA-409-3p;ZEB1;胶质瘤
中圖分类号:R373.9
文献标志码:A
文章编号:1006-1037(2021)03-0056-07
人巨细胞病毒(HCMV),也称为人疱疹病毒5(HHV-5),属于疱疹病毒科的β亚科,是一种大多数人体内均存在的双链DNA病毒[1]。据报道,40%和95%的人被HCMV感染,但由于HCMV的复制受到自身免疫系统的限制,所以在人体中常为潜伏状态[2]。但作为重要的临床病原体,HCMV可以在免疫抑制或免疫功能低下的患者体中重新激活,导致患者疾病进一步发展,甚至死亡[3]。神经胶质瘤是世界上最常见的恶性脑肿瘤,其显著特点是弥漫性浸润,转移率高,生存结果极差[4],且临床治疗效果不佳,预后差,复发率高。2002年,Cobbs首次报道HCMV可能与神经胶质瘤有关[5],随后研究人员发现更昔洛韦(一种病毒DNA合成抑制剂)对神经胶质瘤患者有明显的治疗作用[6],以及HCMV感染可通过调节关键致癌信号通路的活性来促进神经胶质瘤细胞的增殖,迁移和侵袭[7-8],并通过干扰p53和视网膜母细胞瘤(Rb,一种抑癌基因)抑制HCMV感染的细胞的凋亡[9]。然而,HCMV感染与神经胶质瘤的具体发生机制仍不明确。越来越多的研究表明,微小RNA(miRNA)作为一种单链非编码RNA,一类新的内分泌因子[10-11],在所有真核细胞或病毒中表达,并在转录后通过与下游靶mRNA互补结合,负调控基因表达[12-13]。研究表明神经胶质瘤中miRNA表达失调[14],miRNA与HCMV之间也有着密切的关联[15]。在HCMV感染后的胶质瘤细胞中miRNA的表达显著改变[16],但关于HCMV感染期间的神经胶质瘤细胞中miRNA的表达和功能的认识还相对缺乏。ZEB1是一个以锌指簇结构为特征,负责与CAGGTA盒状启动子元件相互作用的转录因子[17-18],ZEB1在调节癌细胞功能(例如细胞存活、分化、增殖、衰老和凋亡)中起着至关重要的作用[19]。ZEB1在人类癌症组织中异常表达与细胞迁移、侵袭、肿瘤转移密切相关[20]。本研究拟讨论miR-409-3p/ ZEB1信号通路在HCMV感染的神经胶质瘤细胞U87中的作用,为神经胶质瘤的基础诊断和治疗提供新的可能性。
1 材料与方法
1.1 材料
1.1.1 细胞和病毒 神经胶质瘤细胞系U251,U87,T98由本实验室保存。于37℃,5%CO2无菌条件下培养细胞,待细胞状态稳定后开始实验。HCMV为ADl69株,使用人胚肺成纤维细胞(HELF)扩增病毒,并使用软琼脂法定量病毒滴度。
1.1.2 主要试剂与仪器 胎牛血清(FBS,Biological Industries),DMEM/F12(Biological Industries),MEM(Biological Industries),二甲基亚砜(DMSO,索莱宝),细胞RNA提取试剂盒(天根),cDNA合成试剂盒(诺唯赞),Transwell小室(康宁),IE86抗体(abcam),ZEB1抗体(博奥森),ACTIN抗体(博奥森),pp65抗体(博奥森) ,Real-time PCR仪(Bio-Rad iQ5)。
1.2 实验方法
(1)细胞培养。在37°C,5%CO2的培养箱中,使用含10%胎牛血清的MEM(培养液进行人神经胶质瘤细胞系(T98,U251和U87)培养。
(2)RNA提取,文库构建和测序。使用TRIzol提取每个样品的总RNA。通过PAGE凝胶纯化特定大小的microRNA分子。RNA-seq文库通过6个步骤构建:连接5'RNA接头;连接3’RNA适配器;通过反转录反应获得cDNA测序文库;通过高保真聚合酶扩增构建测序文库; DNA扩增;在Illumina HiSeq2500上测序。
(3)萤光素报告测定。分别构建包含ZEB1 3'-UTR区域或3'-UTR突变区域的荧光素酶报告基因质粒(pMIR-3'-UTRWt和pMIR-3'-UTRMut)。将pMIR-3'-UTRWt或pMIR-3'-UTRMut质粒与miRNA模拟物共转染到U87细胞中。48小时后,用荧光素酶活性检测试剂盒检测miR-409-3p和ZEB1之间的结合效率。
(4)细胞划痕实验。将胶质瘤细胞接种在6孔板中,并培养至70%汇合,转染质粒,48小时后,用200μL吸头刮擦细胞层,然后用PBS冲洗,无血清MEM培养基培养24小时,在倒置显微镜下拍摄。
(5)Transwell试验。将含有20%FBS的MEM添加到24孔板的底部,用无血清MEM将细胞重悬,接种于24孔板中的Transwell小室中,密度为5×105个细胞/mL,培养6小时后,将Transwell小室膜用甲醇固定15分钟,然后用结晶紫染色,在显微镜下随机选择五个视野(100倍),拍照计数。
(6)总RNA提取和定量RT-PCR(qRT-PCR)。用总RNA提取试剂盒从细胞系中提取总RNA。使用SYBR qPCR Master Mix进行实时PCR,以GAPDH表达标准化。ZEB1(forward:5'- AGGCAATAGGTTTTGAGGGCCAT -3',reverse:5'-TGCACCTTCTGTCTCGGTTTCTT -3')和GAPDH(forward:5'-GAGTCAACGGATTTGGTC G-3', reverse:5'-TGGAAGATGGTGATGGGA-3')。使用2-ΔΔCt方法计算表达倍数变化。
(7)Western blot。将细胞总蛋白液与上样缓冲液混合,95°C加热5分钟。在聚丙烯酰胺凝胶上电泳分离样品后,将蛋白质转移到PVDF膜上,5%的奶粉封闭2小时,一抗4℃过夜:兔抗ZEB1(1∶1 000),兔抗IE86(1∶1 000),兔抗pp65(1∶1 000)和兔抗ACTIN(1∶1 000)。用辣根過氧化物酶(HRP)偶联的抗兔二抗1∶5 000的稀释,室温结合一抗2小时,最后使用ECL化学发光试剂进行显影,ImageJ软件分析蛋白质条带。
2 实验结果与讨论
2.1 RNA-Seq揭示miR-409-3p在HCMV感染的神经胶质瘤细胞中的表达
为了研究HCMV感染后的神经胶质瘤中miRNA的表达情况,采用RNA-Seq技术对HCMV感染后的U87细胞中miRNA进行测序。使用small RNA Sample Pre Kit试剂盒构建文库,由于Small RNA的5'端有磷酸基团,3'端有羟基,利用T4 RNA Ligase 1和T4 RNA Ligase 2(truncated)分别在small RNA 5'端和3'端连接上接头,反转录合成cDNA,再以cDNA作为模板,进行PCR扩增,采用Illumina HiSeq2500(单端50 nt)将构建好的测序文库进行测序。每个样品的clean data均大于11 M,Q30百分率超过97.79%。将过滤后的clean data与Silva,GtRNAdb和Rfam比对,去除核糖体RNA和转运RNA。然后使用miRDeep2程序将未注释的与由人(GRCh38_100,Ensembl)和HCMV菌株AD169完整基因组(gb:FJ527563)组成的索引进行比对,确定每种miRNA的表达量,并使用每百万转录本(TPM)标准化表达量。DEGseq用于分析组之间的差异。
以| log2(FC)|≥1和FDR≤0.01作为差异表达miRNA的筛选标准,倍数变化(FC)代表两个样品组之间表达水平的比率。共鉴定出1 395个miRNA,为了研究HCMV感染对U87细胞中miRNA表达的潜在影响,在感染和模拟感染的细胞中鉴定出了差异表达的miRNA。根据两组的miRNA表达的火山位点图可知(图1),与模拟感染组相比,感染后,有30个miRNA被下调,4个miRNA被上调。在全面分析LogFC,FDR和miRNA功能预测后,选择了miR-409-3p(log2FC = -4.38,FDR = 0)。此外,通过靶基因预测(TargetScan:http://www.targetscan.org/)分析,ZEB1与miR-409-3p种子序列能够结合,且最小自由能小,结合稳定性高,ZEB1很可能是 miR-409-3p的靶基因(图2)。
2.2 在胶质瘤U87中验证HCMV感染后miR-409-3p的表达,及靶向调节ZEB1
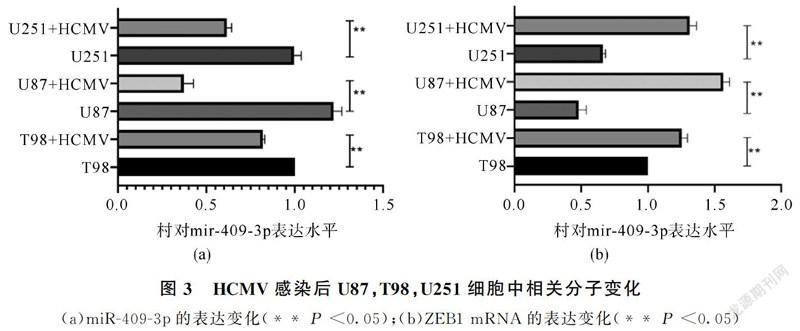
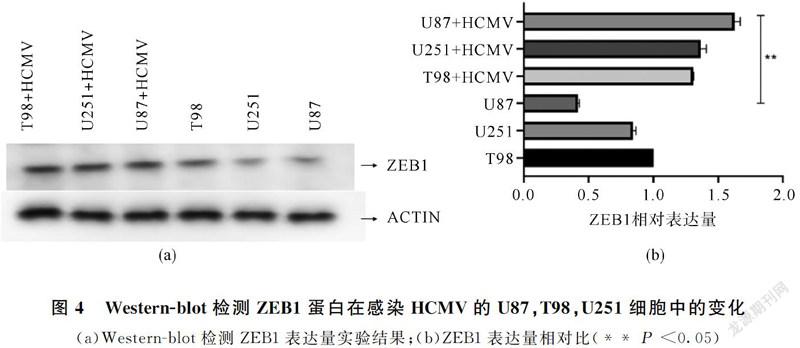
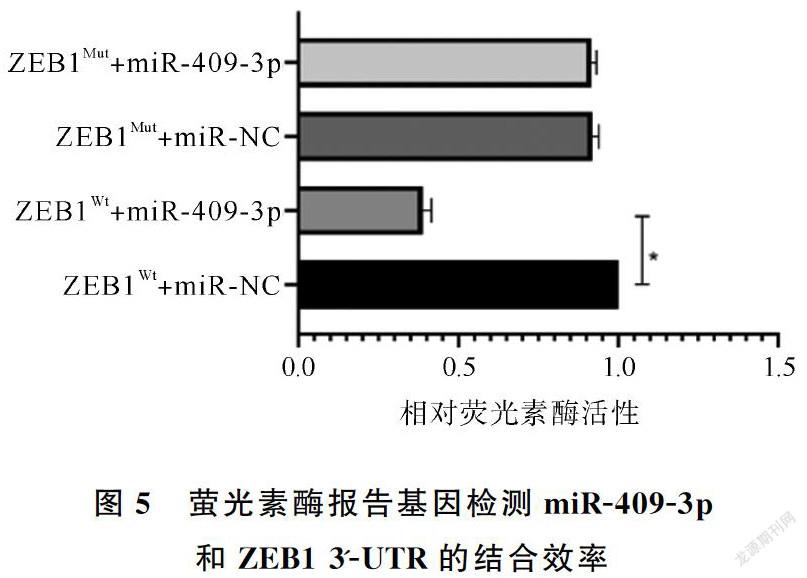
通过qRT-PCR检测miR-409-3p、ZEB1分别在HCMV感染与未感染的U251,U87和T98细胞中的表达水平。miR-409-3p在HCMV感染的U251,U87和T98细胞中显示低水平(图3(a),P <0.05),而ZEB1 mRNA(图3(b),P <0.05)和蛋白质(图4(a)、图4(b),P <0.05)表达显著增加,这些观察结果表明miR-409-3p的下调与HCMV感染的神经胶质瘤细胞中的ZEB1表达可能相关。接下来,在U87细胞中,将野生型/突变型ZEB1荧光素酶报告载体(pEF1α-3'-UTRWt和pEF1α-3'-UTRMut)与miR-409-3p mimic/miR-NC共转染并培养48小时,然后进行荧光素酶报告基因检测,显示pEF1α-3'-UTRWt与miR-409-3p mimic共转染组萤光素酶活性最低(图5),萤光素酶活性在3'-UTRMut组中没有受到影响。这些结果证实,miR-409-3p直接靶向U87细胞中ZEB1的3'-UTR。
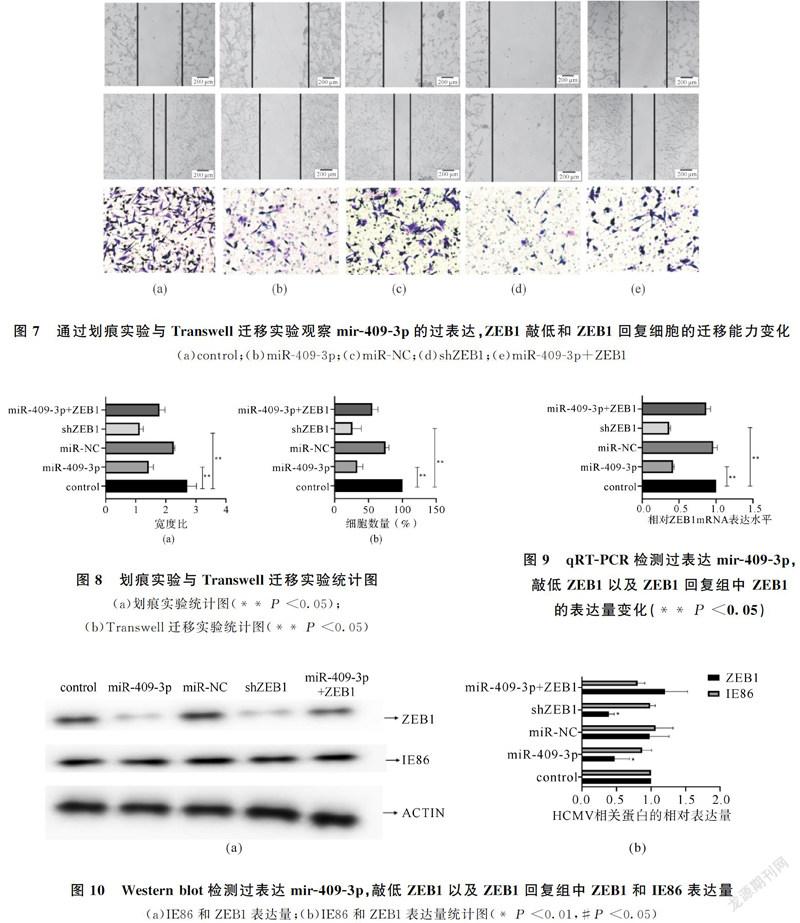
2.3 MiR-409-3p的过表达和ZEB1的回复显著改变了HCMV感染的U87细胞的迁移能力
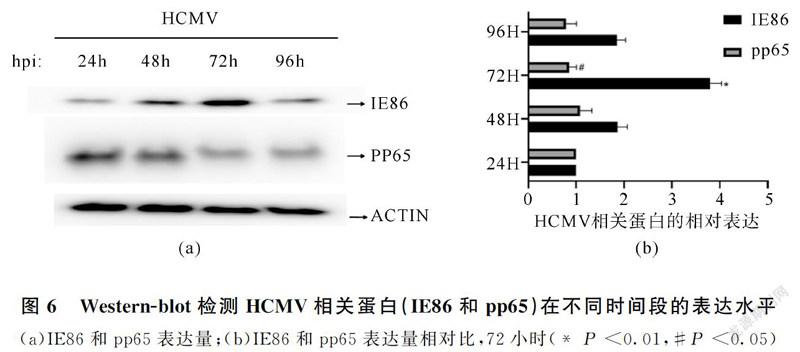
IE86是HCMV感染后表达的重要即刻早期调控蛋白。通过IE86最高表达量选择最佳感染时间点,实验结果显示72小时为最佳感染时间点(图6)。在HCMV感染的U87细胞中过表达miR-409-3p,划痕试验显示,miR-409-3p过表达组细胞迁移能力降低(图7、图8(a)),相似的,Transwell迁移实验结果显示,miR-409-3p过表达组细胞的迁移能力降低(图7、图8(b))。此外,qRT-PCR(图9)和Western blot(图10)显示,miR-409-3p过表达组ZEB1的mRNA和蛋白水平显著降低;随后,将没有3'-UTR的全长ZEB1克隆与miR-409-3p共转染到HCMV感染的U87细胞中,对ZEB1进行qRT-PCR和Western blot分析,发现ZEB1表达得以恢复(图9、图10)。同时,Transwell和划痕试验的结果表明ZEB1回复组的迁移能力也被明显恢复(图7、图8)。这些结果表明恢复ZEB1表达可以逆转由miR-409-3p过表达引起的迁移能力抑制现象。
2.4 讨论
随着研究的深入,miRNA在致癌和肿瘤恶性进展中的作用受到越来越多的关注[21-22],miRNA在多种因素影响下均可异常表达,病毒是其中重要的影响因素之一,而HCMV病毒对神经干细胞、神经元及神经胶质细胞普遍易感。根据研究报道,miR-409-3p在不同类型的癌症中发挥重要作用,例如通过调节Beclin-1来增强结肠癌细胞的化学敏感性[23],靶向并抑制胃癌中的PHF10作为肿瘤抑制因子[24],靶向c-Met抑制膀胱癌细胞的迁移[25],靶向连环蛋白δ1抑制骨肉瘤转移[26]等。实验发现miR-409-3p在HCMV感染的神经胶质瘤中也异常表达,并且可以通过作用于ZEB1进而调控胶质瘤细胞的迁移能力。
3 结论
在HCMV感染胶质瘤U87细胞的体外实验中,转录组测序结果提示miR-409-3p的表达下降,并发现ZEB1为miR-409-3p靶基因,过表达miR-409-3p和导敲低ZEB1均可以使细胞迁移能力降低,而在miR-409-3p过表达中回复ZEB1表达的细胞中,细胞迁移能力得到一定程度恢复,综上表明,HCMV感染的U87细胞可以通过降低miR-409-3p表达导致ZEB1表达增强从而使细胞迁移能力增强。有研究表明ZEB1可以抑制E-cadherin的表达[27],并进一步诱导EMT,EMT被认为是促进癌细胞迁移并导致转移的重要机制,而该机制是否也存在于HCMV感染的神经胶质瘤细胞中,还需要进行进一步研究。
参考文献
[1]ALARCON A, MARTINEZ-BIARGE M, CABAAS F,et al. A prognostic neonatal neuroimaging scale for symptomatic congenital cytomegalovirus infection[J]. Neonatology ,2016, 110(4): 277-285.
[2]HAHN F, NIESAR A, WANGEN C et al. Target verification of artesunate-related antiviral drugs: assessing the role of mitochondrial and regulatory proteins by click chemistry and fluorescence labeling[J/OL]. Antiviral Research, 2020: 104861[2020-12-15]. https://www.ncbi.nlm.nih.gov/pubmed/32590041. DOI:10.1016/j.antiviral. 2020.104861.
[3]COLLINS-MCMILLEN D, CHESNOKOVA L, LEE B J,et al. HCMV infection and apoptosis: How do monocytes survive hcmv infection?[J]. Viruses,2018, 10(10), 533.
[4]OSTROM Q T, GITTLEMAN H, XU J,et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the united states in 2009-2013[J]. Neuro-Oncology,2016, 18: v1-v75.
[5]COBBS C S, HARKINS L, SAMANTA M,et al. Human Cytomegalovirus infection and expression in human malignant glioma[J]. Cancer Research,2002, 62(12): 3347-3350.
[6]DROPULIC L K, COHEN J I. Update on new antivirals under development for the treatment of double-stranded dna virus infections[J/OL]. Clinical Pharmacology and Therapeutics, 2010, 88(5): 610-619[2021-01-15]. https://www.ncbi.nlm.nih.gov/pubmed/20881959. DOI:10.1038/clpt.2010.178.
[7]COBBS C S, SOROCEANU L, DENHAM S,et al. Modulation of oncogenic phenotype in human glioma cells by cytomegalovirus IE1-mediated mitogenicity[J]. Cancer Research,2008, 68(3): 724-730.
[8]王心惠,錢冬萌,王斌,等. HCMV感染对下调ATF5的人胶质瘤U251细胞干性的影响.[J].青岛大学学报(自然科学版)2017,30(2):40-44.
[9]CASTILLO J P, YUROCHK A D, KOWALIK T F. Role of human cytomegalovirus immediate-early proteins in cell growth control[J]. Journal of Virology,2000, 74(17): 8028-8037.
[10] PENG C,WANG Y L. Editorial: MicroRNAs as new players in endocrinology[J]. Frontiers in Endocrinology,2018, 9:459.
[11] ZHANG J, LI S, LI L, et al. Exosome and exosomal microrna: Trafficking, sorting, and function[J]. Genomics Proteomics Bioinformatics, 2015, 13(1):17-24.
[12] TREIBER T, TREIBER N. MEISTER G. Publisher correction: Regulation of microrna biogenesis and its crosstalk with other cellular pathways[J]. Nature Reviews Molecular Cell Biology,2019, 20(5): 321.
[13] JI C, GUO X. The clinical potential of circulating micrornas in obesity[J/OL]. Nature Reviews Endocrinology, 2019, 15(12): 731-743[2021-01-20]. http://dx.doi.org/10.1038/s41574-019-0260-0. DOI:10.1038/s41574-019- 0260-0.
[14] SUN J, ZHENG G, GU Z,et al. MiR-137 inhibits proliferation and angiogenesis of human glioblastoma cells by targeting ezh2[J]. Journal of Neuro-Oncology,2015, 122(3): 481-489.
[15] NAQVI A R, SHANGO J, SEAL A,et al. Viral mirnas alter host cell mirna profiles and modulate innate immune responses[J]. Frontiers in Immunology,2018, 9: 433.
[16] LIANG Q, WANG K, WANG B,et al. HCMV-Encoded mir-ul112-3p promotes glioblastoma progression via tumour suppressor candidate 3[J]. Scientific Reports, 2017, 7: 44705.
[17] FUNAHASHI J, KAMACHI Y, GOTO K,et al. Identification of nuclear factor delta ef1 and its binding site essential for lens-specific activity of the delta 1-crystallin enhancer[J]. Nucleic Acids Research,1991, 19(13): 3543-3547.
[18] TAKAGI T, MORIBE H, KONDOH H,et al. DeltaEF1, a zinc finger and homeodomain transcription factor, is required for skeleton patterning in multiple lineages[J]. Development,1998, 125(1): 21-31.
[19] CHRISTINE C L, MARJANOVIC N D, LEE T,et al. Poised chromatin at the zeb1 promoter enables breast cancer cell plasticity and enhances tumorigenicity[J]. Cell,2013, 154(1): 61-74.
[20] KREBS A M, MITSCHKE J, LOSADA M L,et al. The EMT-Activator zeb1 is a key factor for cell plasticity and promotes metastasis in pancreatic cancer[J]. Nature Cell Biology,2017, 19(5): 518-529.
[21] WANG Z, DAI X, CHEN Y,et al. MiR-30a-5p is induced by wnt/β-catenin pathway and promotes glioma cell invasion by repressing ncam[J]. Biochemical and Biophysical Research Communications, 2015, 465(3): 374-380.
[22] YUE X, CAO D, LAN F,et al. MiR-301a is activated by the wnt/β-catenin pathway and promotes glioma cell invasion by suppressing sept7[J]. Neuro-Oncology, 2016, 18(9): 1288-1296.
[23] TAN S, SHI H, BA M,et al. MiR-409-3p sensitizes colon cancer cells to oxaliplatin by inhibiting beclin-1-mediated autophagy[J]. International Journal of Molecular Medicine,2016, 37(4): 1030-1038.
[24] LI C, NIE H, WANG M,et al. MicroRNA-409-3p regulates cell proliferation and apoptosis by targeting phf10 in gastric cancer[J]. Cancer Letters,2012, 320(2): 189-197.
[25] XU X, CHEN H, LIN Y,et al. MicroRNA-409-3p inhibits migration and invasion of bladder cancer cells via targeting c-met[J]. Molecules and Cells,2013, 36(1): 62-68.
[26] WU S, DU X, WU M,et al. MicroRNA-409-3p inhibits osteosarcoma cell migration and invasion by targeting catenin-δ1[J]. Gene,2016, 584(1): 83-89.
[27] THIERY J P. Epithelial-mesenchymal transitions in cancer onset and progression[J]. Bulletin de l'Académie Nationale de Médecine,2009, 193(9): 1969-1978.
