普通烟草NtNAC055基因的克隆、鉴定及表达分析
2021-09-13王奇李晓旭郭存郭永峰
王奇 李晓旭 郭存 郭永峰

摘 要:NAC家族是植物中最大的转录因子家族之一,在植物生长发育以及应对环境胁迫中起着至关重要的作用,克隆和验证烟草中NAC相关基因可为烟草抗性育种提供理论依据。本研究采用RT-PCR方法从普通烟草K326根部cDNA中克隆到NtNAC055基因,对NtNAC055及其编码蛋白进行了生物信息学分析、表达模式分析、亚细胞定位和转录激活等相关试验。结果发现,NtNAC055基因的CDS序列全长为1032 bp,NtNAC055蛋白具有典型的NAC结构域,编码一个具有343个氨基酸的NAC转录因子;通过进化分析发现,烟草NtNAC055与拟南芥ANAC055同源性较高,同属于RD26亚家族;通过亚细胞定位分析以及转录激活分析发现,NtNAC055蛋白在细胞核中且具有转录激活活性;运用qRT-PCR技术,对该基因不同组织和胁迫处理后的表达进行了分析,结果显示,NtNAC055基因在根、茎、叶、花和腋芽中均有表达,且在根部表达量最高;同时,该基因受干旱和热胁迫的诱导,表明烟草NtNAC055基因可能参与了烟草的非生物胁迫应答反应。
关键词:烟草;NtNAC055;非生物胁迫;干旱;基因表达
Abstract: NAC family is one of the largest transcription factor families in plants, and plays a significant regulatory role in plant development, signal transduction and abiotic stress response. Cloning and validation of NAC related genes in tobacco can provide a theoretical basis for tobacco breeding for stress tolerance. In this study, NtNAC055 was cloned from root cDNA of cv. K326 by RT-PCR. In addition, bioinformatics analysis, expression pattern analysis, subcellular localization and transactivation activity analysis of NtNAC055 were performed. The results showed that the full-length of NtNAC055 was 1032 bp, and the NtNAC055 protein was 343 aa that contained a typical NAC domain. Phylogenetic analysis indicated that NtNAC055 had high homology with ANAC055 from Arabidopsis. Subcellular localization and transactivation analyses showed that NtNAC055 was localized in the nucleus and had transactivation activities. The expressions of NtNAC055 were analyzed by qRT-PCR in different tissues of tobacco, and in seedlings under different abiotic stresses. The results showed that NtNAC055 was expressed in tobacco roots, stems, leaves, flowers and axillary buds, especially in roots. The expression levels of NtNAC055 were induced under drought and heat stresses, which indicated that NtNAC055 might be involved in tobacco abiotic stress responses.
Keywords: tobacco; NtNAC055; abiotic stress; drought; gene expression
NAC(NAM, AFAT, CUC)转录因子是植物特有的一类转录因子[1],SOUER等[2]从矮牵牛中克隆到第一个NAC转录因子NAM(No Apical Meristem),该转录因子家族成员作为重要的调控因子广泛参与了植物生长发育过程,包括叶片衰老[3-4],侧根发育[5-7],果实成熟[8],次生壁形成[9-10]和植物激素信号转导[11-13]等。同时,有很多文献报道NAC转录因子家族成员在植物响应非生物胁迫中也发挥着重要的作用[14]。过表达ANAC072、ANAC019和ANAC055基因时,转基因拟南芥植株的耐旱性显著提高[15],并可以促进拟南芥干旱应答基因的表达。ANAC072可被多种生物、非生物胁迫诱导表达,包括脱落酸(ABA),NaCl,干旱,茉莉酸(JA)等[15-18]。在豆科植物中间锦鸡儿中,过表达ANAC055的同源基因CiNAC4提高了转基因植株的耐盐性[19]。在玉米中,ZmNAC55基因在干旱、盐等非生物胁迫处理下被显著诱导,且过表达ZmNAC55的拟南芥植株对干旱的抗性明显增强[20]。在水稻中,过表达OsNAC9基因可以有效提高转基因水稻植株的耐旱性[21]。沙冬青在干旱、盐、低温和高温胁迫以及施加外源ABA的条件下,AmNAC3、AmNAC4、AmNAC5的表达量均可被诱导上调。将3个基因分别转入到拟南芥中,AmNAC3过表达株系的耐盐性得到显著提高,AmNAC4和AmNAC5基因可以提高耐盐性和抗旱性[22]。烟草在不同的非生物胁迫和植物激素处理下,NtNAC072基因的表达可被NaCl、干旱以及ABA显著诱导,说明NtNAC072基因可能在烟草处于干旱胁迫和盐胁迫等非生物逆境下起着重要的作用[23]。徐小艳等[24]將NtNAC1基因转入野生型烟草植株中,在使用甘露醇模拟干旱条件下,其过表达株系根长较野生型长,证实了NtNAC1基因具有增强植株抗旱性的功能。代婷婷等[25]将NtNAC4基因转入普通烟草中,在干旱处理下,转基因烟草幼苗根长与对照相比没有受到明显的抑制,表明过表达NtNAC4基因提高了植株的抗旱能力。
烟草(Nicotiana tabacum L.)为茄科(Solanaceae)烟草属(Nicotiana)特种经济作物,在我国的大部分地区都有种植。高温、干旱、冷害、高盐等极端环境严重影响了烟草的生长发育,进而对其品质造成损害。本研究运用RT-PCR的方法对NtNAC055基因进行分离克隆,对其表达模式、亚细胞定位以及转录激活活性进行分析,旨在探讨烟草抗逆性的调控机制和内在机理,为后期培育抗逆新品种提供理论依据。
1 材料与方法
1.1 试验材料
种植材料为普通烟草K326。DH5α大肠杆菌感受态细胞和亚克隆载体购自北京全式金公司,GV3101農杆菌感受态细胞和AH109酵母感受态细胞购自博迈德生物公司。GFP标签载体pYG56-GFP和pBridge载体由本实验室保存。同源重组酶(Infusion)、PrimeSTAR Max DNA Polymerase购自宝生物工程(大连)有限公司,限制性内切酶购自NEB公司。植物总RNA提取试剂Trizol购自康为世纪生物科技有限公司,反转录试剂盒PrimeScript? RT reagent Kit、qRT-PCR试剂、酵母培养基购自宝生物工程(大连)有限公司,DNA胶回收和质粒提取试剂盒购自天根公司。
1.2 试验方法
1.2.1 烟草材料种植和处理 供试普通烟草品种K326于2020年5月种植在中国农业科学院烟草研究所气候室。对K326种子进行消毒,首先用75%酒精浸泡20 s,无菌水洗2次,再用15%的H2O2浸泡8~12 min,最后再用无菌水洗4~5次。将消毒过的烟草种子均匀地铺在MS固体培养基上,待长至4片真叶期,将长势一致的烟苗分别转移到含有100 mmol/L NaCl、10 μmol/L ABA、PEG-6000(5%)的相应培养基上,在4 ℃和37 ℃光照培养箱中模拟低温胁迫和热胁迫。在处理时间为0、1、3和6 h时对处理的烟苗进行整株采样,每个处理每次采集3株,每株作为一个生物学重复,液氮速冻后转移至–80 ℃冰箱中保存、备用。
将MS固体培养基上长势一致的4片真叶期烟苗移栽至装有营养土的花盆里,置于气候室正常培养。在烟株盛花期,采集正常生长植株的根、茎、幼叶、成熟叶、衰老叶、花及腋芽。根部组织取样时,将烟草根系部位营养土用水轻轻冲洗干净,剪取侧根。采集样品时,先将样品放入液氮中,然后转移至–80 ℃冰箱中保存备用。
1.2.2 总RNA的提取、反转录 将采集的不同组织样品以及胁迫处理的样品在液氮中研磨至粉末,使用Trizol试剂提取各样品的总RNA,并利用反转录试剂盒PrimeScript? RT reagent Kit对提取的总RNA进行cDNA第一链的合成,将反转后的cDNA置于–20 ℃保存,备用。
1.2.3 NtNAC055基因的克隆 以拟南芥ANAC055蛋白序列为query序列,在茄科基因组数据库(http://solgenomics.net/)中进行Blast P比对,获得候选基因(Nitab4.5_0001204g0100.1),根据基因的编码区设计PCR扩增引物(NtNAC055-F:5'-ATGGGTGTTCAGGAAATGGACC-3';NtNAC05 5-R 5'-TTACCGACTGAAACCCATATTCACT-3'),以普通烟草K326根部cDNA为模板,使用PrimeSTAR Max DNA Polymerase进行基因扩增。PCR反应体系为:PrimeSTAR Max Premix 25 μL,引物F 1.5 μL,引物R 1.5 μL,cDNA 1.5 μL,用ddH2O补充至50 μL。PCR反应程序:98 ℃变性10 s,55 ℃ 退火10 s,72 ℃延伸20 s;32个循环。PCR产物用1%琼脂糖凝胶电泳检测,将1000 bp左右的目的条带切下经凝胶回收纯化试剂盒回收纯化,回收的目的片段与亚克隆载体连接,取5 μL连接产物转化至DH5α细胞中,在LB固体培养基上(Kan 100 μg/ml)37 ℃培养,进行筛选,挑取经PCR鉴定为阳性的单克隆送至上海生工生物工程有限公司测序。
1.2.4 NtNAC055基因生物信息学分析 使用ExPASy ProtParam(https://web.expasy.org/protparam/)工具,在线分析NtNAC055蛋白的分子量、理论等电点。在拟南芥基因组数据库TAIR(www.arabidopsis.org)下载拟南芥ATAF1、ATAF2、AtNAP、RD26、ANAC055、ANAC019、AtNAC2和AtNAC3等胁迫相关的NAC转录因子蛋白序列。在茄科基因组数据库(http://solgenomics.net/)中下载马铃薯StNAC053、StNAC055和StNAC101等胁迫相关的NAC转录因子蛋白序列[26]。在植物基因组数据库EnsemblPlants(https://plants.ensembl.org/ index.html)中下载其他物种胁迫相关NAC转录因子蛋白序列,包括水稻OsNAC4、OsNAC10,小麦TaNAC29、TaNAC2、TaNAC67,大豆GmNAC6、GmNAC11。利用MEME(http://meme-suite.org/)在线软件进行NAC蛋白序列的保守基序(motif)分析,并使用DNAMAN进行多序列比对[27],运用MEGA6构建系统树。
1.2.5 NtNAC055基因亚细胞定位分析 参照文献[28]对NtNAC055基因进行亚细胞定位分析。用Spe I单酶切质粒载体pYG56-GFP,使用同源重组酶(Infusion)将去掉终止密码子的NtNAC055基因编码序列连接到带有GFP标签的亚细胞定位载体上,即获得融合表达载体35S:: NtNAC055-GFP。将构建好的融合质粒转化至GV3101农杆菌感受态细胞中,以只含有GFP标签的质粒农杆菌菌株为对照。将P19与目标菌等比例混合后,注射到正常生长4~5周的本氏烟草叶片背部,做好标记,避光培养1 d后正常培养2 d,取少量注射的烟草叶片在激光共聚焦显微镜TCS-SP8(德国Leica公司)488 nm激发光波长下观察GFP信号。
1.2.6 NtNAC055基因转录激活试验 参照文献[29]对NtNAC055基因进行转录激活活性试验。用EcoR I单酶切质粒载体pBridge,使用同源重组酶将NtNAC055基因编码序列连接到pBridge载体中,构建NtNAC055与GAL4BD融合载体。将GAL4BD-NtNAC055重组质粒与pBridge空白载体分别转入AH109酵母感受态细胞中,然后在缺少色氨酸的培养基(SD/-Trp)上进行阳性克隆的筛选,随后将阳性克隆转移至加有X-gal的缺素培养基(SD/-Trp/X-gal)上,避光培養3~4 d至显色。
1.2.7 NtNAC055基因表达模式分析 采取qRT-PCR技术对NtNAC055基因的表达模式进行分析。根据NtNAC055基因的编码序列设计荧光定量引物,NAC055-qRT-F:5'-CCGACTGACGAGGAG CTTTT-3';NAC055-qRT-R:5'-TTGGTCGTGATCC ATTCGGG-3',采用烟草26S rRNA基因(26S-F:5'-GAAGAAGGTCCCAAGGGTTC-3';26S-R:5'-TC TCCCTTTAACACCAACGG)作为管家基因[30]。提取盐、脱落酸、PEG6000、4 ℃和37 ℃处理的烟草幼苗的总RNA,使用仪器ABI 7500(美国ABI公司)进行qRT-PCR,设3次生物学重复。
2 结 果
2.1 NtNAC055基因的克隆与序列分析
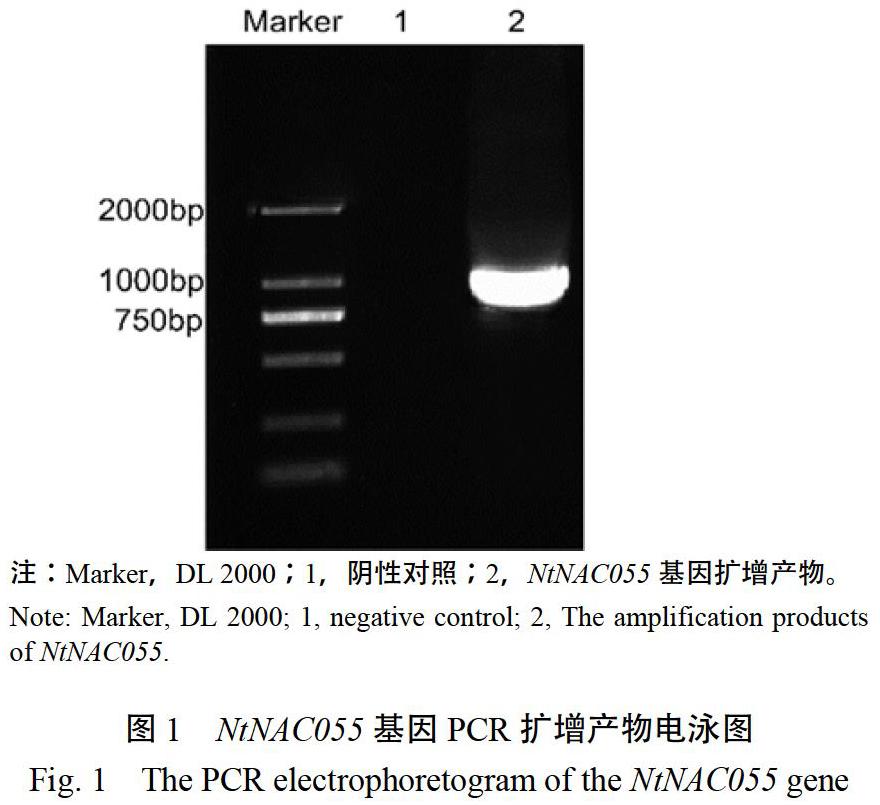
根据茄科数据库BlastP比对结果,设计烟草NtNAC055基因的特异性扩增引物,以K326根部cDNA为模板进行PCR扩增,使用1.2%琼脂糖凝胶电泳检测,在泳道2内有一条清晰的条带,处在1000 bp附近(图1),泳道1作为阴性对照,回收纯化后连接亚克隆载体,测序结果显示,NtNAC055基因CDS全长为1032 bp,编码343个氨基酸。采用ExPASy ProtParam工具预测其分子量和理论等电点,结果显示:NtNAC055蛋白分子量为38.7 kDa,理论等电点(pI)为7.06。
将烟草NtNAC055蛋白序列与拟南芥、马铃薯、小麦、水稻和大豆中的NAC转录因子蛋白序列进行多序列比对(图2),序列比对分析发现,NtNAC055蛋白序列N端具有保守的典型NAC结构域Subdomain A-E,在Subdomain D中发现保守的核定位信号(NLS),而其C端序列一致性非常低,推测该区域可能与NAC蛋白的转录激活功能相关。
2.2 NtNAC055的进化树分析与保守基序分析
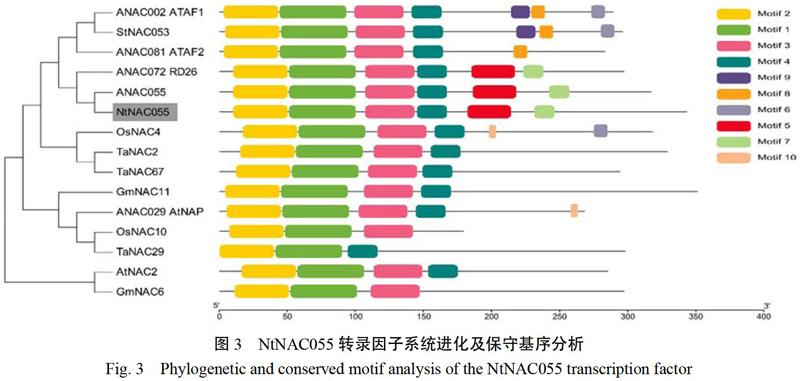
使用MEGA6软件对烟草NtNAC055转录因子与其他物种中的NAC转录因子进行系统进化分析,建立进化树(图3)。从图3可以看出,烟草NtNAC055与拟南芥ANAC055、ANAC072聚在一起,同属于RD26亚家族。使用在线软件MEME对NAC蛋白序列的保守基序进行分析发现,RD26亚家族内的NAC转录因子家族成员具有6个相同的保守基序且所处位置基本一致。而且NtNAC055与拟南芥ANAC055聚在同一小支内,推测两者在功能上可能具有相似性。
2.3 NtNAC055蛋白的亚细胞定位分析
为确定NtNAC055的亚细胞定位,以携带35S:: NtNAC055-GFP的农杆菌和携带35S::GFP的农杆菌(阴性对照)侵染烟草叶片,通过激光共聚焦显微镜观察GFP信号,进行NtNAC055蛋白的亚细胞定位(图4),从图中可以看出,NtNAC055-GFP融合蛋白定位于细胞核中,与核指示剂DAPI共定位,而对照的GFP信号在细胞膜、细胞核均有表达,说明NtNAC055蛋白定位于细胞核。
2.4 NtNAC055的转录激活活性分析
为了确定NtNAC055是否具有转录激活活性,分别将GAL4BD-NtNAC055融合载体和GAL4BD空载体(对照)转化至AH109酵母感受态中,在缺少色氨酸的培养基(SD/-Trp)上均生长良好,随后将生长良好的酵母单克隆转移至缺少色氨酸的显色培养基(SD/-Trp/X-gal)上,在30 ℃培养箱中倒置避光培养。如图5所示,只有转化了GAL4BD-NtNAC055融合载体的酵母表达菌株在SD/-Trp/X-gal培养基上显示蓝色,而只有GAL4BD的对照酵母菌株没有显示蓝色,表明NtNAC055蛋白具有转录激活活性。
2.5 NtNAC055基因的表达模式分析
利用实时荧光定量PCR检测了烟草不同组织中NtNAC055基因的表达量,结果表明,在根、茎、幼叶、成熟叶、衰老叶、花、腋芽中NtNAC055基因均有表达,其中在根部的表达量最高,在茎中的表达量最低。另外,在衰老叶片中的表达量是幼叶的3.98倍,是成熟叶片的2.41倍(图6A)。
对NtNAC055基因在不同胁迫及ABA处理下的表达量进行分析,可知NtNAC055基因受多种胁迫和ABA的诱导和调控。在干旱处理6 h内,NtNAC055基因的表达量随干旱处理时间增加而显著提高(图6B),处理1 h时表达量为对照(0 h)的8.1倍,处理3 h时为对照的11.8倍,处理6 h时达到最高,为对照的22.4倍。在热胁迫下,处理1 h时表达量为对照(0 h)的2.2倍,而处理3 h和6 h时表达量出现了逐渐下降的趋势(图6C)。在盐(图6D)、低温(图6E)胁迫和ABA(图6F)处理下,表达量均呈现下调的趋势。结果表明,NtNAC055基因可能在烟草受到干旱和热胁迫时发挥重要的作用;而在受到盐、低温胁迫和ABA处理时NtNAC055基因的表达量也受到显著的调控,但与干旱胁迫时的响应模式存在明显的差异。
3 討 论
NAC转录因子是植物最大的转录因子家族之一,参与了植物的生长发育、逆境胁迫[3-7,14]等,其中ANAC019、ANAC055、ANAC072(RD26)属于胁迫相关转录因子(SNAC-A)亚家族的成员[31],可以调控非生物应答基因的表达[16]。
本研究从普通烟草K326根部cDNA中克隆到胁迫相关基因NtNAC055,全长1032 bp,编码343个氨基酸残基。与其他物种NAC蛋白进行序列比对,结果发现,NtNAC055蛋白具有NAC转录因子家族典型的NAC结构域。系统进化表明,NtNAC055与RD26亚家族中的成员ANAC055聚在一起,且蛋白保守基序具有较高的一致性,暗示两者具有相似的生物学功能。亚细胞定位试验表明,NtNAC055定位在细胞核中。此外,转录激活结果表明,转录因子NtNAC055具有转录激活活性。表达模式分析发现,NtNAC055基因在叶片和根中高表达。特别的,NtNAC055表达量随着叶片衰老过程逐渐上升,在衰老叶片中的表达量分别是幼叶和成熟叶的3.98倍和2.41倍,暗示NtNAC055可能在叶片衰老中发挥重要的调控作用。
有研究表明,在十字花科菜心中,BrNAC055基因在衰老叶片中上调表达,过表达BrNAC055基因能够促进叶片衰老[32]。表达模式分析发现,在烟草中NtNAC055基因在衰老叶片中表达量上升(图6A),暗示NtNAC055基因很可能在烟草中参与叶片衰老落黄的调控过程。在拟南芥中ANAC055基因受干旱、盐等非生物胁迫的诱导,同时过表达ANAC055基因可以显著提高植株的耐旱性[15]。在其他物种中,ANAC055的同源基因也被报道广泛参与非生物逆境的响应和调控过程。在玉米中,ZmNAC55基因在干旱、盐、低温和ABA处理下被显著诱导,且过表达ZmNAC55的拟南芥植株对干旱的抗性明显增强[20]。在甘蓝型油菜中,BnaNAC55基因受冷、热、ABA等非生物胁迫的诱导[33]。在新疆小拟南芥中,ApNAC055基因被盐胁迫显著诱导,提示该基因可能参与小拟南芥盐胁迫响应[34]。在豆科植物中间锦鸡儿中,ANAC055的同源基因CiNAC4基因同时响应干旱、盐、热、冷和ABA,在拟南芥中过表达CiNAC4基因提高了转基因植株的耐盐性[19]。本研究中,NtNAC055基因能够被干旱和热胁迫诱导,同时响应ABA、盐和冷胁迫,暗示NtNAC055基因可能参与多种非生物逆境的响应和调控过程。
4 结 论
试验结果表明,NtNAC055基因为拟南芥ANAC055的同源基因,编码典型的NAC转录因子,NtNAC055蛋白只在细胞核内表达,为核定位的转录因子且具有转录激活活性。NtNAC055基因在烟草根部高量表达,而且同时受到干旱胁迫和热胁迫的诱导。说明NtNAC055基因可能在烟草响应干旱胁迫、热胁迫等逆境方面起重要的调控作用。本研究结果有利于进一步探讨烟草抗逆性的调控机制和内在机理,后续研究将利用过表达、基因编辑等手段深入探索NtNAC055基因功能,为烟草抗逆育种提供理论依据和育种中间素材。
参考文献
[1]OLSEN A N, ERNST H A, LEGGIO L L, et al. NAC transcription factors: structurally distinct, functionally diverse[J]. Trends in Plant Science, 2005, 10(2): 79-87.
[2]SOUER E, VAN A H, KLOOS D, et al. The no apical meristem gene of petunia is required for pattern formation in embryos and flowers and is expressed at meristem and primordia boundaries[J]. Cell, 1996, 85(2): 159-170.
[3]GUO Y F, GAN S S. AtNAP, a NAC family transcription factor, has an important role in leaf senescence[J]. The Plant Journal, 2006, 46(4): 601-612.
[4]KIM Y S, SAKURABA Y, HAN S H, et al. Mutation of the Arabidopsis NAC016 transcription factor delays leaf senescence[J]. Plant Cell Physiology, 2013, 54: 1660-1672.
[5]YANG X, KIM M Y, HA J, et al. Overexpression of the soybean NAC gene GmNAC109 increases lateral root formation and abiotic stress tolerance in transgenic Arabidopsis plants[J]. Frontiers in Plant Science, 2019, 10: 1036-1047.
[6]XIE Q, FRUGIS G, COLGAN D, et al. Arabidopsis NAC1 transduces auxin signal downstream of TIR1 to promote lateral root development[J]. Genes & Development, 2000, 14(23): 3024-3036.
[7]HE X J, MU R L, CAO W H, et al. AtNAC2, a transcription factor downstream of ethylene and auxin signaling pathways, is involved in salt stress response and lateral root development[J]. The Plant Journal, 2005, 44(6): 903-916.
[8]NIEUWENHUIZEN N J, CHEN X, WANG M Y, et al. Natural variation in monoterpene synthesis in kiwifruit: transcriptional regulation of terpene synthases by NAC and ETHYLENE-INSENSITIVE3-like transcription factors[J]. Plant Physiology, 2015, 167(4): 1243-1258.
[9]MITSUDA N, SEKI M, SHINOZAKI K, et al. The NAC transcription factors NST1 and NST2 of Arabidopsis regulate secondary wall thickenings and are required for anther dehiscence[J]. The Plant Cell, 2005, 17(11): 2993-3006.
[10]ZHANG J, HUANG G Q, ZOU D, et al. The cotton (Gossypium hirsutum) NAC transcription factor (FSN1) as a positive regulator participates in controlling secondary cell wall biosynthesis and modification of fibers[J]. New Phytologist, 2018, 217(2): 625-640.
[11]SHAHNEJAT-BUSHEHRI S, TARKOWSKA D, SAKURABA Y, et al. Arabidopsis NAC transcription factor JUB1 regulates GA/BR metabolism and signalling[J]. Nature Plants, 2016, 2(3): 16013-16021.
[12]CHEN X, LU S, WANG Y, et al. OsNAC2 encoding a NAC transcription factor that affects plant height through mediating the gibberellic acid pathway in rice[J]. The Plant Journal, 2015, 82(2): 302-314.
[13]CAO L, YU Y, DING X, et al. The Glycine soja NAC transcription factor GsNAC019 mediates the regulation of plant alkaline tolerance and ABA sensitivity[J]. Plant Molecular Biology, 2017, 95(3): 253-268.
[14]SHAO H, WANG H, TANG X. NAC transcription factors in plant multiple abiotic stress responses: progress and prospects[J]. Frontiers in Plant Science, 2015, 6: 902-909.
[15]TRAN L S P, NAKASHIMA K, SAKUMA Y, et al. Isolation and functional analysis of Arabidopsis stress-inducible NAC transcription factors that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1 promoter[J]. The Plant Cell, 2004, 16(9): 2481-2498.
[16]NAKASHIMA K, TAKASAKI H, MIZOI J, et al. NAC transcription factors in plant abiotic stress responses[J]. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 2012, 1819(2): 97-103.
[17]FUJITA M, FUJITA Y, MARUYAMA K, et al. A dehydration-induced NAC protein, NAC055, is involved in a novel ABA-dependent stress-signaling pathway[J]. The Plant Journal, 2004, 39(6): 863-876.
[18]CHUNG Y, KWON S I, CHOE S. Antagonistic regulation of Arabidopsis growth by brassinosteroids and abiotic stresses[J]. Molecules and Cells, 2014, 37(11): 795-803.
[19]HAN X M, FENG Z Q, XING D D, et al. Two NAC transcription factors from Caragana intermedia altered salt tolerance of the transgenic Arabidopsis[J]. BMC Plant Biology, 2015, 15(1): 208-219.
[20]MAO H D, YU L J, HAN R, et al. ZmNAC55, a maize stress-responsive NAC transcription factor, confers drought resistance in transgenic Arabidopsis[J]. Plant Physiology & Biochemistry, 2016, 105: 55-66.
[21]REDILLAS M C F R, JEONG J S, KIM Y S, et al. The overexpression of OsNAC9 alters the root architecture of rice plants enhancing drought resistance and grain yield under field conditions[J]. Plant Biotechnology Journal, 2012, 10(7): 792-805.
[22]任美艳. 沙冬青三个抗逆相关NAC转录因子基因的克隆与功能研究[D]. 呼和浩特:内蒙古农业大学,2019.
REN M Y. Cloning and functional analysis of three stress-related NAC transcription factor genes from Ammopiptanthus mongolicus[D]. Inner Mongolia Agricultural University, 2019.
[23]李晓旭,郭存,刘成,等. 普通烟草NtNAC072基因的克隆、鉴定及表达模式分析[J]. 烟草科技,2019,52(3):10-17.
LI X X, GUO C, LIU C, et al. Cloning, characterization and expression pattern analysis of NtNAC072 gene in Nicotiana tabacum[J]. Tobacco Science & Technology, 2019, 52(3): 10-17.
[24]徐小艳,姚新转,吕立堂,等. 烟草NtNAC1基因的克隆及其在烟草中的抗旱功能分析[J]. 植物生理学报,2018,54(6):1085-1094.
XU X Y, YAO X Z, LYU L T, et al. Cloning of NtNAC1 gene from Nicotiana tabacum and its analysis of drought-resistant function[J]. Plant Physiology Journal, 2018, 54(6): 1085-1094.
[25]代婷婷,姚新轉,吕立堂,等. 烟草NAC4基因的克隆及其抗旱功能分析[J]. 农业生物技术学报,2018,26(5):764-773.
DAI T T, YAO X Z, LYU L T, et al. Cloning and drought-resistant function analysis of NAC4 gene in tobacco (Nicotiana tabacum) [J]. Journal of Agricultural Biotechnology, 2018, 26(5): 764-773.
[26]SINGH A K, SHARMA V, PAL A K, et al. Genome-wide organization and expression profiling of the NAC transcription factor family in potato (Solanum tuberosum L) [J]. DNA Research, 2013, 20(4): 403-423.
[27]刘成,李晓旭,苏玉龙,等. 普通烟草SBP转录因子家族的全基因组鉴定及其进化和表达分析[J]. 中国烟草科学,2015,36(4):
1-11.
LIU C, LI X X, SU Y L, et al. Genome-wide identification, phylogenetic analysis and expression profiling of the SBP transcription factor family in Nicotiana tabacum[J]. Chinese Tobacco Science, 2015, 36(4): 1-11.
[28]LI X X, HAMYAT M, LIU C, et al. Identification and characterization of the WOX family genes in five Solanaceae species reveal their conserved roles in peptide signaling[J]. Genes, 2018, 9(5): 260-279.
[29]孙晋浩,牛文利,陈志华,等. 烟草 NtbHLH112 基因的克隆、鉴定及表达模式分析[J]. 中国烟草科学,2020,41(5):8-14.
SUN J H, NIU W L, CHEN Z H, et al. Cloning, characterization and expression pattern analysis of NtbHLH112 gene in Nicotiana tabacum[J]. Chinese Tobacco Science, 2020, 41(5):8-14.
[30]王姍姗,赵影影,李超杰,等. 烟草转录因子MYB12基因克隆及表达模式分析[J]. 烟草科技,2017,50(8):1-9.
WANG S S, ZHAO Y Y, LI C J, et al. Cloning and expression analysis of transcription factor gene MYB12 from Nicotiana tabacum[J]. Tobacco Science & Technology, 2017, 50(8): 1-9.
[31]HICKMAN R, HILL C, PENFOLD C A, et al. A local regulatory network around three NAC transcription factors in stress responses and senescence in Arabidopsis leaves[J]. The Plant Journal, 2013, 75(1): 26-39.
[32]FAN Z Q, TAN X L, CHEN J W, et al. BrNAC055, a novel transcriptional activator, regulates leaf senescence in Chinese flowering cabbage by modulating reactive oxygen species production and chlorophyll degradation[J]. Journal of Agricultural and Food Chemistry, 2018, 66(36): 9399-9408.
[33]NIU F, WANG C, YAN J, et al. Functional characterization of NAC55 transcription factor from oilseed rape (Brassica napus L.) as a novel transcriptional activator modulating reactive oxygen species accumulation and cell death[J]. Plant Molecular Biology, 2016, 92(1-2): 89-104.
[34]林军,张亮,黄先忠. 新疆小拟南芥NAC转录因子ApNAC055的克隆及表达分析[J]. 石河子大学学报(自然科学版),2017,35(6):747-753.
LIN J, ZHANG L, HUANG X Z. Molecular cloning and expression analysis of ApNAC055 from Arabidopsis pumila[J]. Journal of Shihezi University (Natural Science), 2017, 35(6): 747-753.
