β-内酰胺类抗生素臭氧氧化机理与降解途径
2021-09-13敖蒙蒙刘利魏健宋永会陈婷婷熊兆锟赖波陈忠林
敖蒙蒙 刘利 魏健 宋永会 陈婷婷 熊兆锟 赖波 陈忠林

摘 要:为考察β-内酰胺类抗生素在臭氧氧化过程中的降解规律与特征,采用臭氧直接氧化法处理水中4种典型β-内酰胺类抗生素。研究不同pH值条件下臭氧氧化典型β-内酰胺类抗生素的降解效果,利用淬灭实验探究降解机理,分析中间产物并推测降解路径。研究结果表明:改变pH值对阿莫西林和头孢氨苄降解效果没有显著影响,酸性条件对青霉素钠降解有抑制,碱性条件对头孢曲松钠降解有促进。淬灭实验结果表明:叔丁醇(TBA)对阿莫西林和头孢氨苄的降解有一定的促进作用,说明阿莫西林和头孢氨苄的降解由臭氧分子直接氧化主导;随着TBA浓度的升高,对青霉素钠和头孢曲松钠的抑制效果更加显著,说明青霉素钠和头孢曲松钠以羟基自由基(·OH)间接氧化为主导。阿莫西林、头孢氨苄、青霉素钠和头孢曲松钠臭氧氧化过程中分别生成了4、6、3、3种主要中间产物,降解途径包括β-内酰胺环断裂、去甲基化、水合反应、加成反应等过程。
关键词:β-内酰胺类抗生素;臭氧;中间产物;降解途径
中图分类号:X703.1 文献标志码:A 文章编号:2096-6717(2021)06-0187-10
Abstract: In order to investigate the degradation law and characteristics of β-lactam antibiotics during ozone oxidation, four typical β-lactam antibiotics in water were treated by direct ozone oxidation. The degradation effect of ozone on typical β-lactam antibiotics under different pH values was studied. Quenching experiments were adopted to explore the degradation mechanism,analyze intermediates and speculate the degradation path. Results showed that the degradation of amoxicillin and cephalexin was not significantly affected by changing pH, penicillin sodium was inhibited in acidic condition, and ceftriaxone sodium was promoted in alkaline condition.The results of quenching experiments showed that TBA can promote the degradation of amoxicillin and cephalexin, indicating that the degradation of amoxicillin and cephalexin was dominated by direct oxidation of O3.With the increase of TBA concentration, the inhibition effect to penicillin and ceftriaxone sodium was more and more significant, which indicated that penicillin and ceftriaxone sodium were indirectly oxidized by ·OH.Amoxicillin, cephalexin, penicillin sodium and ceftriaxone sodium produced 4, 6, 3 and 3 main intermediates during ozonation, respectively. The degradation pathways were composed of β-lactam ring breaking, demethylation, hydration and addition etc.
Keywords: β-lactam antibiotics; ozone oxidation; intermediates; degradation pathway
自發现青霉素以来,β-内酰胺类抗生素被广泛应用于医学、生物学、生物化学、生命科学、农业等领域[1]。由于人或动物对抗生素消耗量大、代谢量小,大量β-内酰胺类抗生素通过人体后直接排放到环境中[2]。德国联邦化学品安全委员会的一项研究表明,在超过50%的废水和地表水样本中检测出最大浓度在ng/L范围的β-内酰胺类抗生素[3]。尽管抗生素在环境中的残留问题已经被广泛关注,但其转化产物(TPs)的产生也是一个紧迫的环境和公共卫生问题,Gozlan等[4]在水生环境中甚至在地下水中检测到了阿莫西林的转化产物。
目前,针对抗生素类污染物的处理方法有很多,包括生物法、物理法和化学法[5]。生物法去除抗生素类污染物的效果不理想[6],物理法因成本和二次污染等问题而略显不足[7],因此,当前化学法中的高级氧化法(AOPs)是去除水体中抗生素类污染物的重要适用技术[8]。臭氧氧化技术是一项实用、高效的高级氧化技术,具有反应迅速、氧化效果好和无需添加化学试剂等优点,被广泛地应用在微污染物处理方面[9-11]。臭氧作为一种强氧化剂,可选择性攻击废水中不饱和有机物,在难降解废水处理及废水深度处理中广泛应用[12]。在水溶液中,臭氧的不同存在形式决定了臭氧氧化有机污染物具有两种不同途径:1)臭氧分子的直接反应,主要是与含有不饱和键的分子如双键、芳香环、杂环化合物等进行反应;2)通过臭氧分解和产生羟基自由基(·OH)的间接氧化,溶液中的OH-诱导臭氧分解产生·OH,并引发自由基链式反应[13]。大量研究表明:臭氧去除水体中残留的抗生素具有显著效果。Dantas等[14]的实验表明磺胺甲恶唑可被臭氧氧化快速去除,废水可生化性显著提升,有效改善了废水处理效果,但发现磺胺甲恶唑基本可以完全被氧化,却不能被彻底矿化。林晓璇等[15]研究了水中酮洛芬在臭氧氧化作用下的降解机制、产物及毒性,结果表明,臭氧能有效降解酮洛芬且降解过程符合一级动力学,降解过程中臭氧分子和羟基自由基共同作用,酮洛芬降解过程中生成了21种主要产物,但是发光杆菌急性毒性实验表明,酮洛芬降解过程中生成了较母体更高风险的中间产物。因此,这些非预期性污染物在臭氧氧化作用下可能会生成比母体更难去除、潜在危害更大的中间产物,预测其转化机理及降解途径显得尤为重要[16-17]。
笔者分别选择青霉素类的青霉素钠(PG)和阿莫西林(AMX),头孢菌素类的头孢氨苄(CLX)和头孢曲松钠(CS)的β-内酰胺类抗生素为目标污染物,考察不同β-内酰胺类抗生素在臭氧氧化工艺中不同pH值条件下的降解效果,分析降解机理,鉴定降解过程中的中间产物,推测产物转化的路径,为臭氧氧化技术在β-内酰胺类抗生素制药废水处理方面提供理论支撑。
1 材料与方法
1.1 实验试剂
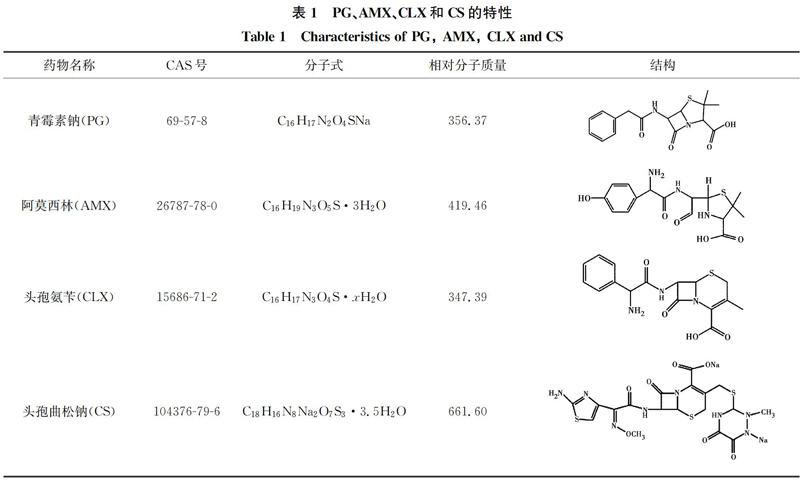
青霉素钠(1 650 U/mg)、阿莫西林(≥98%)、头孢氨苄(≥98%)、头孢曲松钠(HPLC≥98%)、乙腈(色谱级)、甲酸、H2SO4、NaOH、Na2S2O3、叔丁醇(TBA)均购自上海阿拉丁生化科技股份有限公司。实验用水均为超纯水。青霉素钠、阿莫西林、头孢氨苄和头孢曲松钠的特性如表1所示。
1.2 仪器
臭氧发生器(FL-803A,深圳市飞立电器科技有限公司),高效液相色谱仪(1260型,美国 Agilent 公司),UPLC-Q-TOF-MS四级杆质谱仪(6550 iFunnel Q-TOF,安捷伦科技有限公司),紫外分光光度计(UV2355,尤尼柯),pH计(PHS-3C,上海雷磁科学仪器有限公司),搅拌桨(RW20,EKA),纯水机(UPK-I-10T,优普超纯科技有限公司),恒温水浴器(XMTD203,江苏科析仪器有限公司)。
1.3 实验方法
实验在目标污染物浓度50 mg/L、臭氧流量100 mL/min、反应温度25 ℃、搅拌强度300 r/min的条件下进行,反应全程在通风橱中完成。实验进行中每隔一定时间取样一次,取样后立即加入50 μL 0.1 mol/L Na2S2O3溶液终止反应,采用高效液相色谱仪测定AMX、CLX、PG和CS浓度。
1.4 分析测试方法
样品中AMX、CLX、PG和CS的浓度使用安捷伦1260高效液相色谱分析仪测定。检测条件:Eclipse XDB-C18色谱柱,AMX、CLX、PG和CS流动相为乙腈与0.1%甲酸体积比分别为10∶90、10∶90、40∶60和35∶65;进样量10 μL;检测波长分别为270、254、220、254 nm;流速均为1 mL/min;柱温30 ℃。pH值采用方舟PHS-3C+型pH计测定。使用UPLC-Q-TOF-MS对PG、AMX、CLX和CS产物进行检测与分析。采用靛蓝二磺酸钠法测水中臭氧浓度,利用紫外可见分光光度计在610 nm波长处检测。
2 结果与讨论
2.1 pH值对臭氧氧化AMX、CLX、PG和CS的影响
在臭氧氧化体系中,初始pH值是一个重要的参数。在水溶液中,臭氧氧化反应主要有臭氧直接氧化和自由基间接氧化两种途径[13]。臭氧与水中抗生素的反应较为复杂,通常为两种反应途径共同作用。溶液的pH值对臭氧氧化反应途径有决定性作用,在酸性介质中以臭氧直接氧化反应为主,而在碱性介质中则以自由基间接氧化反应为主[18-19]。考察了4种目标物在不同初始pH值下的降解效果,初始目标物浓度为50 mg/L、臭氧产量为3 g/h、臭氧浓度为25 mg/L、气体流量为100 mL/min、反应温度为25 ℃时,目标物初始溶液pH值分别为3、7和9,不同pH值条件下臭氧氧化的降解情况如图1所示。从图1可以看出,在不同pH值条件下,阿莫西林和头孢氨苄均有较好的降解效果,分别在4、2 min内降解完全;青霉素钠在酸性条件下表现为明显的抑制作用,在碱性条件下稍有促进作用,头孢曲松钠在碱性条件下有明显的促进作用。
阿莫西林在不同pH值条件下均被快速完全降解,通过拟一级反应速率擬合,反应过程中的降解速率(kobs)(图2)在pH为3、7和9时分别为0.750、0.674、0.628 min-1。头孢氨苄也表现出相似的结果,2 min可将其降解完全,但是根据降解过程色谱图的变化发现(图3),反应0.5 min头孢氨苄色谱峰消失的同时有新的色谱峰出现,并且新峰的峰高先升高后降低,表明新峰是臭氧氧化头孢氨苄的中间产物,同时也在被氧化。然而,青霉素钠和头孢曲松钠的结果与其不同。青霉素钠在初始pH值为3时,30 min只能降解90%,同时降解速率减慢,随着pH值的增加降解速率增加,由0.083 min-1增加至0.146、0.186 min-1。随着臭氧氧化时间的增加,不同初始 pH值条件下,均表现出5 min内去除率增加速度较快,5~30 min内,去除率增加速度减缓的现象。头孢曲松钠表现出相似的结果,主要降解过程集中在反应前10 min,10~60 min反应较平缓。并且在pH值为3时,降解稍有抑制,pH值增加至9时,有明显的促进作用。降解速率由0.043 min-1增加至0.053 min-1。由上述现象推测,阿莫西林和头孢氨苄臭氧氧化过程主要由臭氧分子直接氧化进行,青霉素钠和头孢曲松钠则通过臭氧分解生成·OH的间接氧化完成。
4种目标物在不同初始pH值情况下反应结束时溶液均呈酸性。初始pH值为3时,整个反应过程pH值不变化,始终保持在3;初始pH值为7和9时,反应溶液的pH值随反应时间而降低,最终pH值保持在4~5。
2.2 臭氧氧化AMX、CLX、PG和CS的降解机理
根据对4种目标物降解机理的推测结果做进一步淬灭探究实验。自由基清除剂是指能清除自由基或能阻断自由基参与氧化反应的物质[20]。叔丁醇(TBA)是一种典型的·OH捕获剂,在臭氧氧化实验中添加TBA可以抑制反应过程·OH的间接反应[21]。因此,在进行臭氧氧化反应前加入一定量TBA考察其对臭氧氧化降解的影响,根据降解效果讨论每种目标物在臭氧氧化过程中以何种反应途径作为主导作用。添加不同浓度TBA时,4种目标物臭氧氧化降解曲线和kobs变化如图4和图5所示。
阿莫西林和头孢氨苄在加入TBA后降解效果增强,降解速率增大,说明添加TBA后促进了臭氧氧化的进程。其主要原因为阿莫西林和头孢氨苄的氧化过程中同时存在臭氧直接氧化和自由基间接氧化两种反应途径,添加TBA后自由基间接氧化反应被终止,臭氧直接氧化反应更突出,降解效果更加显著。并且阿莫西林在添加TBA后降解速率从0.674 min-1显著增加至1.596 min-1,臭氧直接氧化作用在反应过程中占主导作用。在臭氧氧化头孢氨苄过程中加入5 mmol/L TBA就可以显著增加降解速率,kobs从1.642 min-1增加至4.446 min-1。青霉素钠和头孢曲松钠在添加TBA后降解效果受到抑制,降解速率减小,说明添加TBA后抑制了臭氧氧化的进程。主要原因为·OH被TBA捕获导致自由基间接氧化反应受到抑制,实验结果表明,青霉素钠和头孢曲松钠以·OH间接氧化为主要氧化途径。
2.3 臭氧氧化AMX、CLX、PG和CS中间产物与降解途径
采用UPLC-Q-TOF-MS方法对正常条件下AMX、CLX、PG和CS臭氧氧化过程中的降解产物进行探究,表2为4种目标物臭氧氧化过程所检测到的所有降解产物。AMX和CLX通过臭氧直接氧化降解,此方式具有较强的选择性,一般攻击具有双键的有机物,对不饱和脂肪烃和芳香烃类化合物较有效;PG和CS通过臭氧分解产生·OH间接反应降解,不具有选择性。
如图6所示,根据测得的降解产物可以推测出阿莫西林臭氧氧化的降解路径。臭氧氧化AMX过程分为2个途径。在途径一中,首先C—N共价键断裂的同时发生AMX加成反应,生成C16H19N3O5S,然后C—C单键断裂,变成3-(4-羟基苯基)哌嗪-2,5-二酮(C10H10N2O3),随后经过氧化反应,生成苯基吡嗪二醇(C10H8N2O2)[22]。在途径二中,AMX经过O=C—N键的断裂和水合反应形成C16H19N3O6S,然后C16H19N3O6S脱羧变成C15H21N3O4S,最后再经过C—N键的断裂和水合反应生成4-羟基苯甘氨酸(C8H10N2O2)[23]。
如图7所示,根据测得的降解产物可以推测出头孢氨苄臭氧氧化的降解路径。途径一中,首先氧化CLX分子结构中含S、N杂原子环上的C=C生成C16H19N3O7S和C15H19N3O6S,随着降解过程的进一步氧化,产物中S—N断裂生成C13H13N3O8S和C13H15N3O9S[24]。途径二通过直接开环和硫醚基氧化后延迟开环两种形式打开四元β-内酰胺环并在该位置生成羧基,两种形式开环所形成的C16H17N3O5S分子式相同而结构不同[25-26],最后再通过脱羧完成进一步矿化。
如图8所示,根据测得的降解产物推测青霉素钠可能通过两种途径进行氧化。由于反应迅速,前期中间产物不能全部检测到。在途径一中,首先噻唑烷环侧链上—CH3基团的碳原子被快速氧化形成—CO基团,从而形成C16H16N2O5S[27],随之—CH3基团被氧化形成二羧酸基团,从噻唑烷环上脱落形成C14H12N2O4S,然后由于噻唑烷环的稳定性较低故而生成C11H14N2O3,接着C11H14N2O3通过失去氨基形成了C11H13NO3[28],C11H13NO3通过去甲基化形成C10H11NO3[29],最后C10H11NO3通过脱羧和脱甲基形成C8H9NO[30]。在途径二中,首先β-内酰胺环中酮基和氨基之间的键快速断裂形成C16H20N2O4S[30],然后噻唑烷脱落便形成了C6H9NO2S[31]。最后中间产物通过臭氧进一步氧化为CO2和H2O。
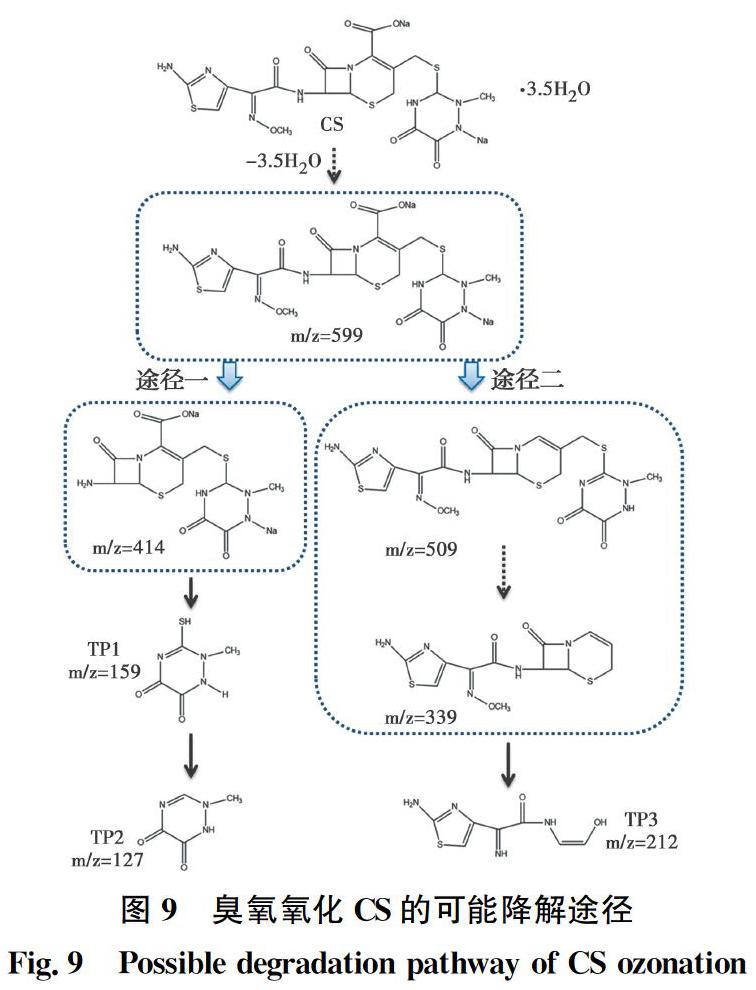
如图9所示,根据测得的降解产物推测头孢曲松钠可能通过两种途径进行氧化。首先失去3.5个结合水,然后通过途径一C-8侧链的C—N键断裂生成C12H13N5Na2O5S2,随之C—S键断裂生成C4H5N3O2S,再经过氧化反应变成C4H5N3O2[32],在途径二中首先羧基丢失变成C17H18N8O5S3,再断裂C—S键和邻位重排变成C12H13N5O3S2,最后β-内酰胺环断裂生成C7H8N4O2S[33]。
3 结论
1)臭氧氧化技术对β-内酰胺类抗生素表现出很好的降解效果,在改变溶液pH值的条件下,AMX和CLX降解没有显著影响,酸性条件对降解PG有抑制,碱性条件对降解CS有促进。
2)AMX和CLX随着添加TBA浓度的增加降解效果增强,说明TBA抑制了·OH的间接氧化,臭氧分子直接氧化更加明显,因此,AMX和CLX主要由臭氧分子直接氧化进行降解;PG和CS随着添加TBA浓度的增加降解效果减弱,·OH被抑制显著影响降解效果,说明PG和CS由臭氧分子分解·OH间接氧化为主导。
3)利用UPLC-Q-TOF-MS测得AMX、CLX、PG和CS臭氧氧化過程中分别产生4、6、3和3种主要中间产物,通过分析推导出臭氧氧化4种β-内酰胺类抗生素的降解途径,主要包括β-内酰胺环断裂、去甲基化、开环加羧、水合反应、加成反应等。
参考文献:
[1]ELANDER R P. Industrial production of β-lactam antibiotics[J]. Applied Microbiology and Biotechnology, 2003, 61(5/6): 385-392.
[2]CHA J M, YANG S, CARLSON K H. Trace determination of β-lactam antibiotics in surface water and urban wastewater using liquid chromatography combined with electrospray tandem mass spectrometry[J]. Journal of Chromatography A, 2006, 1115(1/2): 46-57.
[3]TIMM A, BOROWSKA E, MAJEWSKY M, et al. Photolysis of four β-lactam antibiotics under simulated environmental conditions: Degradation, transformation products and antibacterial activity[J]. Science of the Total Environment, 2019, 651: 1605-1612.
[4]GOZLAN I, ROTSTEIN A, AVISAR D. Investigation of an amoxicillin oxidative degradation product formed under controlled environmental conditions[J]. Environmental Chemistry, 2010, 7(5): 435-442.
[5]劉烈, 李魁岭, 徐莉莉, 等. 电催化臭氧技术去除水中草酸的研究[J]. 水处理技术, 2019, 45(8): 89-93,102.
LIU L, LI K L, XU L L, et al. Study on the degradation of oxalic acid in water by electro-peroxon technology[J]. Technology of Water Treatment, 2019, 45(8): 89-93,102. (in Chinese)
[6]YAN L, LI Y S, XIANG C B, et al. Effect of nano-sized Al2O3-particle addition on PVDF ultrafiltration membrane performance[J]. Journal of Membrane Science, 2006, 276(1/2): 162-167.
[7]王军芳, 朱世云, 程鼎, 等. 臭氧氧化法处理染料废水技术进展[J]. 工业水处理, 2008, 28(6): 8-11.
WANG J F, ZHU S Y, CHENG D, et al.Advances in the treatment of dye wastewater by ozonation[J]. Industrial Water Treatment, 2008, 28(6): 8-11. (in Chinese)
[8]ZHENG Y P, YAO G H, CHENG Q B, et al. Positively charged thin-film composite hollow fiber nanofiltration membrane for the removal of cationic dyes through submerged filtration[J].Desalination, 2013, 328: 42-50.
[9]LIN C K, TSAI T Y, LIU J C, et al.Enhanced biodegradation of petrochemical wastewater using ozonation and bac advanced treatment system[J]. Water Research, 2001, 35(3): 699-704.
[10]LIBRA J A, SOSATH F. Combination of biological and chemical processes for the treatment of textile wastewater containing reactive dyes[J]. Journal of Chemical Technology & Biotechnology, 2003, 78(11): 1149-1156.
[11]LANGLAIS B, CUCUROU B, AURELLE Y, et al. Improvement of a biological treatment by prior ozonation[J]. Ozone: Science & Engineering, 1989, 11(2): 155-168.
[12]CHVEZ A M, SOLS R R, BELTRN F J. Magnetic graphene TiO2-based photocatalyst for the removal of pollutants of emerging concern in water by simulated sunlight aided photocatalytic ozonation[J]. Applied Catalysis B: Environmental, 2020, 262: 118275.
[13]NAWROCKI J, KASPRZYK-HORDERN B. The efficiency and mechanisms of catalytic ozonation[J].Applied Catalysis B: Environmental, 2010, 99(1/2): 27-42.
[14]DANTAS R F, CONTRERAS S, SANS C, et al.Sulfamethoxazole abatement by means of ozonation[J]. Journal of Hazardous Materials, 2008, 150(3): 790-794.
[15]林曉璇, 孔青青, 曾泳钦, 等. 酮洛芬在臭氧作用下的降解机制、产物及毒性[J]. 环境化学, 2018, 37(5): 1063-1070.
LIN X X, KONG Q Q, ZENG Y Q, et al. Study on mechanism, intermediates and toxicity of ketoprofen degradation by ozone[J]. Environmental Chemistry, 2018, 37(5): 1063-1070. (in Chinese)
[16]VON GUNTEN U. Ozonation of drinking water: Part I. Oxidation kinetics and product formation[J]. Water Research, 2003, 37(7): 1443-1467.
[17]MIAO H F, ZHU X W, XU D Y, et al. Transformation of aminopyrine during ozonation: Characteristics and pathways[J]. Chemical Engineering Journal, 2015, 279: 156-165.
[18]DAI Q Z, WANG J Y, YU J, et al. Catalytic ozonation for the degradation of acetylsalicylic acid in aqueous solution by magnetic CeO2 nanometer catalyst particles[J]. Applied Catalysis B: Environmental, 2014, 144: 686-693.
[19]史富丽, 王志平. 臭氧氧化降解水中氯霉素的效能[J]. 净水技术, 2013, 32(2): 25-29.
SHI F L, WANG Z P. Performance of degradation of chloramphenicol in water by ozonation process[J]. Water Purification Technology, 2013, 32(2): 25-29. (in Chinese)
[20]薛罡, 钭晨, 江晨舟. 臭氧化降解给水系统中磺胺甲噁唑的试验研究[J]. 水处理技术, 2010, 36(3): 67-69,77.
XU G, DOU C, JIANG C Z. Investigation on the degradation of sulfamethoxazole in water supply system by ozonization[J]. Technology of Water Treatment, 2010, 36(3): 67-69,77. (in Chinese)
[21]SEIN M M, ZEDDA M, TUERK J, et al. Oxidation of diclofenac with ozone in aqueous solution[J].Environmental Science & Technology, 2008, 42(17): 6656-6662.
[22]ZHANG Y, ZHANG B T, TENG Y G, et al.Carbon nanofibers supported Co/Ag bimetallic nanoparticles for heterogeneous activation of peroxymonosulfate and efficient oxidation of amoxicillin[J]. Journal of Hazardous Materials, 2020, 400: 123290.
[23]ZIA J, RIYAZUDDIN M, AAZAM E S, et al. Rapid catalytic degradation of amoxicillin drug using ZnFe2O4/PCz nanohybrids under microwave irradiation[J]. Materials Science and Engineering: B, 2020, 261: 114713.
[24]XU J, LI Y, QIAN M Q, et al. Amino-functionalized synthesis of MnO2-NH2-GO for catalytic ozonation of cephalexin[J]. Applied Catalysis B: Environmental, 2019, 256: 117797.
[25]BAENA-NOGUERAS R M, GONZLEZ-MAZO E, LARA-MARTN P A. Photolysis of antibiotics under simulated sunlight irradiation: Identification of photoproducts by high-resolution mass spectrometry[J]. Environmental Science & Technology, 2017, 51(6): 3148-3156.
[26]GE L K, NA G S, ZHANG S Y, et al. New insights into the aquatic photochemistry of fluoroquinolone antibiotics: Direct photodegradation, hydroxyl-radical oxidation, and antibacterial activity changes[J]. Science of the Total Environment, 2015, 527/528: 12-17.
[27]SZAB L, TTH T, RCZ G, et al. Drugs with susceptible sites for free radical induced oxidative transformations: The case of a penicillin[J]. Free Radical Research, 2016, 50(1): 26-38.
[28]ALDEEK F, CANZANI D, STANDLAND M, et al. Identification of penicillin G metabolites under various environmental conditions using UHPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2016, 64(31): 6100-6107.
[29]HAMMARSTRM S, STROMINGER J L. Degradation of penicillin G to phenylacetylglycine by D-alanine carboxypeptidase from Bacillus stearothermophilus[J]. Proceedings of the National Academy of Sciences, 1975, 72(9): 3463-3467.
[30]DE WITTE B, DEWULF J, DEMEESTERE K, et al. Ozonation and advanced oxidation by the peroxone process of ciprofloxacin in water[J]. Journal of Hazardous Materials, 2009, 161(2/3): 701-708.
[31]LI L X, GUO C H, AI L F, et al. Research on degradation of penicillins in milk by β-lactamase using ultra-performance liquid chromatography coupled with time-of-flight mass spectrometry[J]. Journal of Dairy Science, 2014, 97(7): 4052-4061.
[32]YANG J H, LUO X G. Ag-doped TiO2 immobilized cellulose-derived carbon beads: One-Pot preparation, photocatalytic degradation performance and mechanism of ceftriaxone sodium[J]. Applied Surface Science, 2021, 542: 148724.
[33]QIAO J, LV M, QU Z H, et al. Preparation of a novel Z-scheme KTaO3/FeVO4/Bi2O3 nanocomposite for efficient sonocatalytic degradation of ceftriaxone sodium[J]. Science of the Total Environment, 2019, 689: 178-192.
(編辑 黄廷)
