CeO2/CuBi2O4异质结的制备及其光催化性能研究*
2021-09-13岳明月李天保罗居杰翟光美郭俊杰许并社
岳明月,朱 佳,李天保,罗居杰,翟光美,郭俊杰,许并社
(1. 太原理工大学 材料科学与工程学院,太原 030024;2. 新材料界面科学与工程教育部重点实验室,太原 030024)
0 引言
随着可持续发展观念的深入,工业废水的处理已经成为当前环境领域亟待解决的热点问题[1]。采用半导体光催化技术降解废水中的有机污染物具有环保且高效的优点因而受到社会广泛关注[2]。
CuBi2O4作为一种p型半导体材料,具有化学稳定性高、成本低廉和元素地壳含量丰富的优点,并且其电子能带结构的禁带宽度较窄(Eg = 1.6~1.8eV),表现出优异的可见光响应[3],因而在光催化降解有机污染物方面具有巨大应用潜力。但是实际应用中纯CuBi2O4表现出较低的光催化效率,以降解罗丹明B(RhB)为例,纯CuBi2O4降解RhB的效率仅约为74%[4]。针对CuBi2O4光降解效率低这一现状,科研人员已经提出多种策略来增强CuBi2O4光催化性能。例如,形貌设计[5]、半导体复合[6]、贵金属沉积[7]和离子掺杂[8]等。其中,与其它半导体复合构建异质结,不仅可以有效促进光生电荷的分离并且可以降低活化能,促进表面催化反应进行,是提高光催化效率的最有效手段之一。已经报道的与CuBi2O4形成的异质结主要有Z型异质结和p-n型异质结两种[9],Z型异质结有CuBi2O4/Bi2WO6、Fe2O3/CuBi2O4和Ag3PO4/ CuBi2O4等,p-n型异质结有 CuBi2O4/NaTaO3、CuBi2O4/MoS2和CuBi2O4/C3N4等。
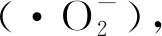
CeO2与CuBi2O4的半导体类型以及它们之间合适的能带位置,使得二者构建p-n型异质结光催化剂改善CuBi2O4光催化性能成为可能。但目前CeO2与CuBi2O4形成的复合物报道较少。Abdelkader[11]等将一定化学计量比的α-Bi2O3与CuO在玛瑙研钵中进行研磨,随后将混合物置于马弗炉煅烧生成CuBi2O4,再取少量CuBi2O4生成物与CeO2研磨形成以CeO2为主的复合物,实验中由于CeO2的吸收位于近紫外区,所以该实验仅在紫外光下进行了复合物对刚果红的降解实验。
本文采用水热法生成CuBi2O4纳米棒后在其表面利用湿化学法原位沉积了Ce(OH)3,后经煅烧处理,最终形成CeO2纳米颗粒附着在CuBi2O4纳米棒上的CeO2/CuBi2O4复合结构。利用CuBi2O4强可见光吸收能力,在模拟太阳光条件下,以RhB为目标污染物检测其光催化活性,研究和比较了不同CeO2添加量对催化效果的影响,并探讨了其光催化降解机理。
1 实验
1.1 化学试剂
本文中所有试剂均为分析纯。RhB购自上海展云化工有限公司,NH3·H2O(25-28%)购自天津致远化学试剂有限公司,Bi(NO3)3·5H2O (99%)、Cu(NO3)2·6H2O(99%)和NaOH(99%)购自上海国药集团,Ce(NO3)3·6H2O(99%)购自阿拉丁。
1.2 催化剂的制备
1.2.1 制备CuBi2O4
将2.42 g Bi(NO3)3·5H2O和0.62g Cu(NO3)2·3H2O溶解在80 mL去离子水中进行搅拌,同时加入0.87g NaOH 在室温下继续搅拌3 h直至形成均匀的悬浮液,随即转移至反应釜中,并在180℃下反应24 h,待反应釜自然冷却至室温后将所获得的样品离心,并通过乙醇、去离子水各洗涤数次,随后放入真空干燥箱中70℃下干燥6h。所得产物即为CuBi2O4纳米棒。
1.2.2 制备CeO2/CuBi2O4
以10%(质量分数)CeO2/CuBi2O4为例,将0.07 g Ce(NO3)3·6H2O和0.17 g CuBi2O4溶解在50mL去离子水中,之后将混合溶液超声处理10 min,随后添加氨水调节至pH = 10,将所得溶液置于水浴中并在40℃恒温条件下搅拌2 h,离心洗涤数次后在真空干燥箱中60℃干燥2h。最后将所获产物在400℃下煅烧2h即获得目标产物。在相同条件下改变Ce(NO3)3·6H2O的添加量获得一系列不同质量分数的(x%)CeO2/CuBi2O4(x= 5、10、15、20)复合材料。作为对比,纯CeO2颗粒的制备方法同上,但没有添加CuBi2O4。
1.3 催化剂的表征
采用JSM-6390A型场发射扫描电子显微镜(SEM)、GENESISXM 型X射线能谱仪(EDS)和D2PHASER型X射线衍射仪(XRD),对样品的表面形貌、成分及物相结构进行分析。采用ESCALAB 250XI型X射线光电子能谱(XPS)测量元素的电子结合能。采用UV-3600型紫外-可见分光光度计(UV-Vis)测试样品吸光特性,采用CHI660E型电化学工作站测试样品莫特肖特基曲线(M-S)。
1.4 光催化性能评价
以RhB作为目标污染物对不同质量分数的(x%)CeO2/CuBi2O4(x=5、10、15、20)复合材料的光催化性能进行探究,以300W的氙灯(14 V,15 A)作为光催化实验中模拟太阳光的光源,最初的RhB染料浓度为2 mg/L,具体实验步骤如下:称量0.1 g不同掺杂比例的CeO2/CuBi2O4复合材料超声分散于100 mL的RhB水溶液中,在暗室中将反应溶液搅拌30 min以达到吸附-解吸平衡,抽取3mL溶液使用带有循环冷却系统的光催化器进行测试,光照后每10 min取等量溶液,离心后取上层清液利用UV-Vis测量染料吸光度。降解率η根据公式:η=(C0-Ct)/C0×100 %,(C0、Ct分别为染料的初始浓度与不同时间时的浓度)计算得出。
2 结果与讨论
2.1 样品表征
2.1.1 XRD分析
图1为所制备样品CuBi2O4、CeO2和CeO2/CuBi2O4的X射线衍射图谱。从图中可见,纯CuBi2O4的特征衍射峰与标准PDF卡片(JCPDS 42-0334)[9]相对应,晶体结构为四方相。纯CeO2的特征衍射峰与标准卡片(JCPDS 34-0394)[12]相对应,晶体结构为立方相。形成复合物后由于CeO2的加入CuBi2O4的特征峰整体相对降低。

图1 样品XRD图谱
2.1.2 SEM分析
图2为所制备样品CuBi2O4、CeO2和CeO2/CuBi2O4的微观形貌图。从图2(a)可见,由水热法所制备的CuBi2O4形貌呈纳米棒形态,直径约100~150 nm,长度约2 μm。图2(b)为Ce(NO3)3和NH3·H2O 反应形成的Ce(OH)3前驱体煅烧后得到的CeO2纳米颗粒,直径约为50 nm。图2(c)为经过湿化学法沉积和400℃煅烧处理后的CuBi2O4纳米棒复合CeO2纳米颗粒的形貌像,可以看出二者混合均匀并形成紧密接触。

图2 CuBi2O4,CeO2和CeO2/CuBi2O4的SEM图
2.1.3 XPS分析
XPS光谱可以反映所制备样品的表面化学状态和元素组成。图3(a)所示为10% CeO2/CuBi2O4样品的全光谱图,Cu、Bi、O和Ce 4种元素的峰均能在XPS光谱中被观察到,表明复合物中存在Cu、Bi、O和Ce4种元素,这意味着CeO2/CuBi2O4复合材料已被成功制备。图3(b)~(e)依次为Cu 2p、Bi 4f、O 1s和Ce 3d 的XPS光谱图,在Cu 2p XPS光谱中(图3(b)),位于结合能941.8和962.2 eV处的特征峰分别对应于Cu 2p3/2和Cu 2p1/2,此外在943和963 eV处的特征峰源自于Cu 2p卫星峰的贡献,证明复合物中铜以正二价氧化态存在[13]。在Bi 4f XPS光谱中(图3(c)),位于结合能159.2和164.5eV处的特征峰分别对应于Bi 4f7/2和Bi 4f5/2,证明复合物中铋以正三价氧化态存在[14]。在O 1s XPS光谱中(图3(d)),分别以529.5 和531.4 eV的结合能为中心将O 1s光谱卷积为两个峰,位于结合能529.5eV处较强的峰源自于晶格氧的贡献,而531.4eV处较低的峰则是由化学吸附氧引起[15]。在Ce 3d XPS光谱中(图3(e)),位于结合能882.3、888.8、898.3、900.9、906.1和916.8 eV处的特征峰对应于Ce4+,而位于结合能884.1 eV处的特征峰则对应于Ce3+。Ce3+的存在可归因于CeO2中存在氧空位[16]。
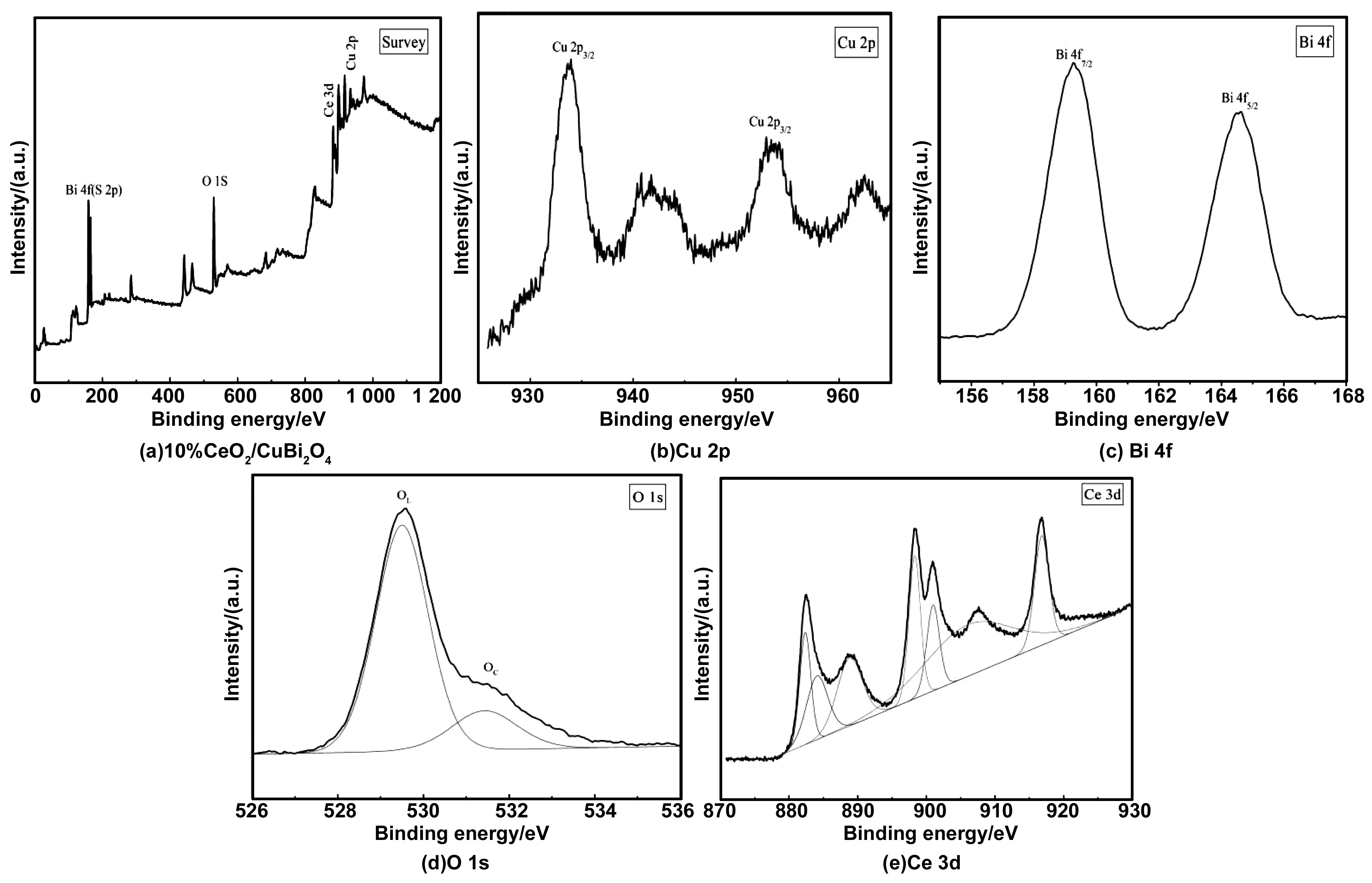
图3 10%CeO2/CuBi2O4, Cu 2p, Bi 4f, O 1s和 Ce 3d的高分辨率XPS光谱
2.1.4 光吸收性能分析
UV-Vis可以反映所制备半导体样品的光吸收范围和禁带宽度。图4(a)所示为CuBi2O4、CeO2和10%CeO2/CuBi2O4的UV-Vis光谱。由图4(a)可见,纯CuBi2O4在可见光区域具有强光吸收能力,光吸收带边约为765nm,而纯CeO2在近紫外区域具有较强光吸收能力,光吸收带边约为450nm。仅从光吸收能力考虑,与纯相CuBi2O4相比,10%CeO2/CuBi2O4异质结在可见光区域的吸收能力并未受到明显影响。根据公式αhv=A(hv-Eg)n/2(α:物质对光的吸收系数 A:比例常数 h:光子能量 Eg:带隙值)对CuBi2O4、CeO2的带隙值进行计算[17]。如图4(b)所示,纯CuBi2O4与纯CeO2的带隙值分别为1.62和2.85 eV。

图4 (a) CuBi2O4,CeO2和10%CeO2/CuBi2O4的紫外可见漫反射图 (b) CuBi2O4和CeO2的带隙图
2.1.5 Mott-Schottky plot分析
M-S曲线可用来研究CeO2/CuBi2O4复合材料的能带结构,图5所示为CuBi2O4与CeO2的M-S曲线,其电化学测试条件为1.0 kHz 和 0.5 mol/L Na2SO4。由图5(a)所示,纯CuBi2O4的M-S曲线斜率为负,表明了纯CuBi2O4的p型特性,其平带电势(VFB)约为1.05V (vs. NHE)。由图5(b)所示,纯CeO2的M-S曲线斜率为正,表明了纯CeO2的n型特性,其VFB约为-0.23V(vs. NHE)。

图5 (a) CuBi2O4和(b) CeO2的莫特肖特基曲线图
2.2 光催化性能影响因素的研究
2.2.1 CeO2掺杂比例对CeO2/CuBi2O4异质结光催化性能的影响
为探究CeO2掺杂比例对CeO2/CuBi2O4异质结光催化性能的影响,选择RhB作为目标污染物,在模拟太阳光照射下,测试一系列不同质量分数的(x%)CeO2/CuBi2O4(x=5、10、15、20)复合材料的光催化活性。实验结果如图6(a)所示,相较于纯CeO2和CuBi2O4,在CuBi2O4纳米棒表面负载CeO2纳米颗粒后,光催化剂的催化活性得到明显改善。其中10%CeO2/CuBi2O4表现出最佳光催化活性,在光照 60 min后对RhB的降解率达到93.1%,与纯CuBi2O4降解率71.3%相比提高了30.6%。当CeO2掺杂比例超过10%时,CeO2/CuBi2O4的光催化性能逐步降低,这是因为随着CeO2在CuBi2O4表面沉积量的增加会阻碍CuBi2O4的可见光吸收,因而尽管有电子-空穴对分离的增益,但由于光吸收率降低的副作用更显著,因此总体反而表现为催化效率降低。除了光催化剂的活性之外,稳定性也是考察光催化剂性能的重要参数之一,对10%CeO2/CuBi2O4降解RhB进行了循环实验,实验结果如图6(b)所示,由图可见,在经过3次循环实验后,10%CeO2/CuBi2O4对RhB的降解率仅下降3.9%,证明所制备的CeO2/CuBi2O4复合材料具有良好的稳定性。
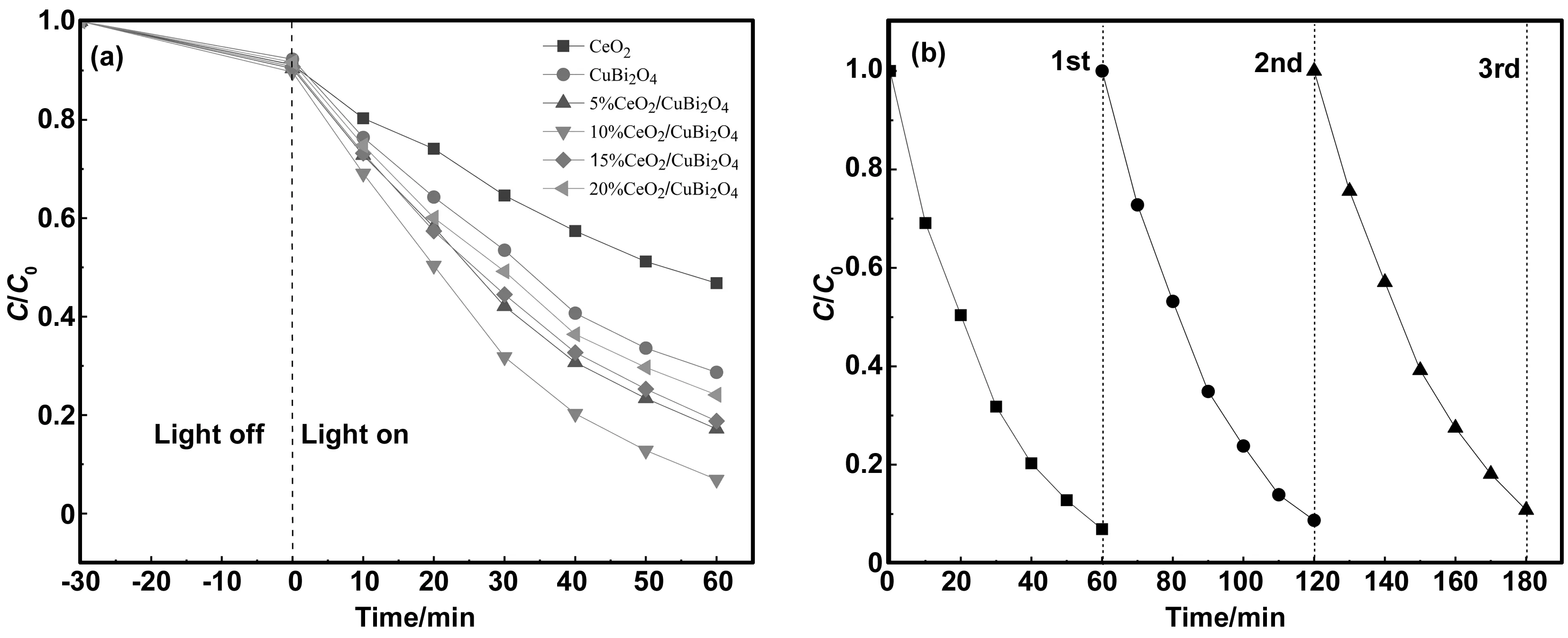
图6 模拟太阳光下(a)催化剂对RhB降解率和(b)10%CeO2/CuBi2O4的循环利用图
2.2.2 10%CeO2/CuBi2O4自由基捕获对比实验

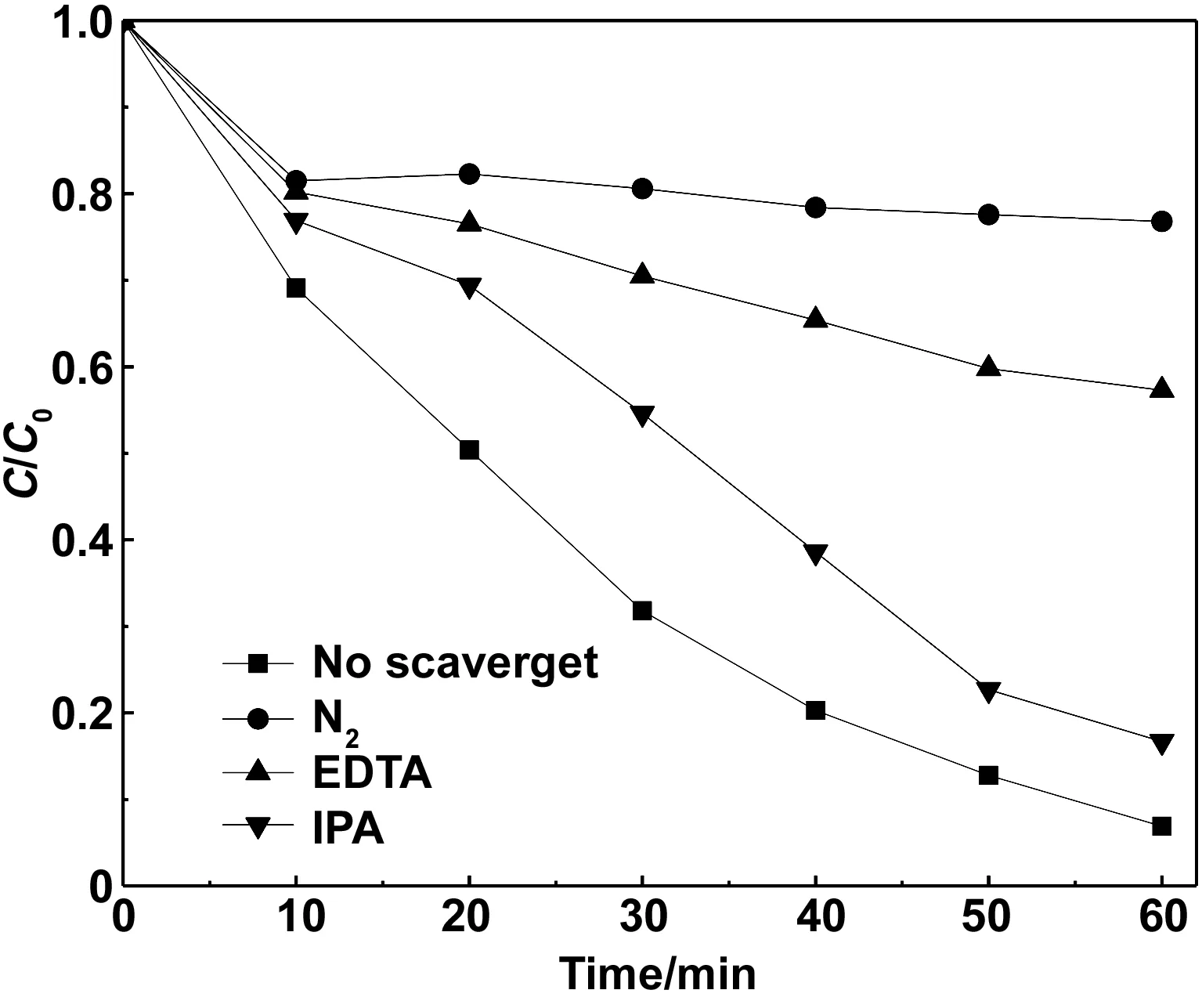
图7 模拟太阳光下不同捕获剂对CeO2/CuBi2O4降解RhB的光催化活性影响
2.2.3 光催化机理
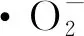
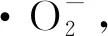

图8 CeO2/CuBi2O4模拟太阳光下降解RhB的光催化反应机理图
(1)
CuBi2O4(h+)+RhB→CuBi2O4+RhB+
(2)
h++H2O→·OH+H+
(3)
3 结论
研究通过水热法、湿化学原位沉积法和煅烧工艺成功合成了一系列不同CeO2掺杂比例的(x%)CeO2/CuBi2O4(x=5、10、15、20)异质结光催化剂,在模拟太阳光条件下,以RhB为降解对象进行光催化活性测试,具体实验结论如下:
(1)与纯CeO2和CuBi2O4相比,10%CeO2/CuBi2O4异质结光催化剂表现出最佳光催化活性,模拟太阳光照射60 min后,其对RhB的降解效率可以达到93.1%。
(2)通过UV-Vis、M-S以及自由基捕获实验对光催化剂特性及催化活性物种进行了测试,并从电子能带结构对其进行了光催化机理分析,揭示了p-n结形成的内建电场对电子-空穴对的有效分离是光降解效率提升的主要原因。
(3)本研究为在以CuBi2O4为基础上构造高效光催化剂提供了新思路,以期未来能更好地解决环境污染中的废水处理问题。
