ISO15189认可准则在免疫组化质量管理中的应用
2021-09-13张晓琴高艳王莹申宁宁原伟成张王亮王晨
张晓琴,高艳,王莹,申宁宁,原伟成,张王亮,王晨
(山西医科大学第二医院,山西 太原 030001)
《医学实验室质量和能力认可准则(ISO15189)》(以下简称ISO15189)是当前全球公认的医学实验室质量管理标准。在我国的医学检验领域,较多的检验科已建立了完善的质量管理体系并获得中国合格评定国家认可委员会(CNAS)认可。2009年3月国家卫生计生委关于《病理科建设与管理指南(试行)》相关规定发布,病理科质量安全和质量管理受到越来越多的重视[1]。随着精准医学时代的到来,病理诊断作为疾病诊断的金标准,日益受到临床学科的重视和依赖[2]。免疫组化室作为病理科重要的组成部分,是病理诊断坚实的基石和可靠的技术保障。我院病理科免疫组化实验室从2017年10月开始,逐步将ISO15189中的相关要素运用到实验室的管理中,提高了免疫组化制片质量,增强了医技之间的互信,提升了实验室的质量管理水平,工作更加科学规范有序。
1 材料与方法
1.1 材料
收集山西医科大学第二医院病理科2017年4月—2017年9月的免疫组化数据23 864 例为质量改进前组(Q组),2017年10月—2018年3月的免疫组化数据22 712 例为持续改进动态观察组(G组),2018年4月—2018年9月的免疫组化数据34 282 例为质量改进后组(H组)。
1.2 方法
2017年10月—2018年3月按照ISO15189的质量管理要素,对免疫组化室进行规范的质量管理。对质量管理持续改进期间(G组)每月的免疫组化质量做动态观察;对比分析Q组与H组的切片质量和数据。评片工作由一线诊断医师在日常诊断工作中进行,录入系统;对于不合格切片,免疫组化室技术员返工复染,并登记复染原因。免疫组化优良率=免疫组化优良切片数量/免疫组化切片总数量×100%;免疫组化复染率=免疫组化复染切片数量/免疫组化切片总数量×100%。
1.3 评价标准
免疫组化切片的评价标准分为优良、合格、不合格三个级别。优良:切片完整,裱贴牢固,无明显皱褶,免疫组化着色定位准确无背景;合格:切片完整,裱贴较牢固,存在皱褶,免疫组化染色定位准确,或存在一定背景着色,不影响结果判读;不合格:切片不完整,脱片严重,免疫组化染色定位不准或出现异常表达,背景着色严重以及各种原因造成医师判读产生困惑,导致复染。
1.4 统计学方法
采用SPSS13.0系统软件进行统计学分析。质量改进前后免疫组化质量(优良率和复染率)比较采用χ2检验,G组免疫组化质量动态观察中切片质量优良率与观察时间采用Spearman秩相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 质量改进前后两组切片优良率和复染率比较
免疫组化切片优良率:H组为91.1%(31 216/34 282),Q组为78.2%(18 656/23 864),两组比较,χ2=1 912.51,P<0.001,差异有统计学意义。复染率:H组为0.4%(152/34 282),Q组为1.2%(283/23 864),两组比较,χ2=105.8,P<0.001,差异有统计学意义。
2.2 质量管理改进中G组切片质量动态观察
G组免疫组化切片优良率随动态时间不断改进,优片率大致呈逐月递增趋势(r=0.943,P=0.005)(见图1)。
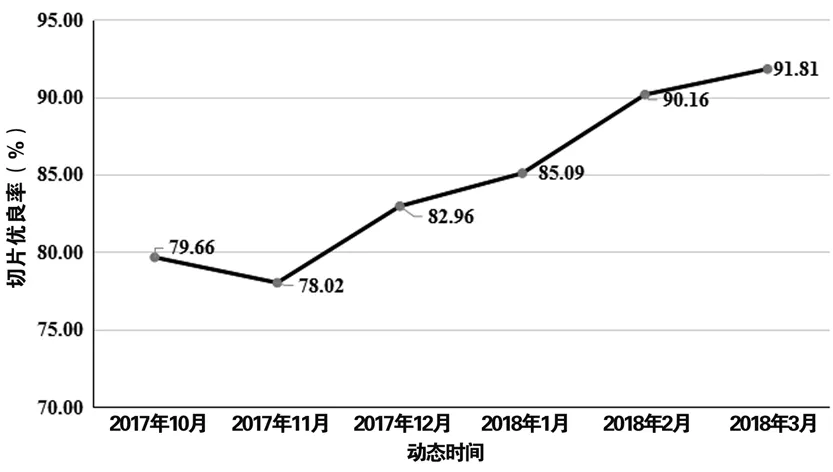
图1 G组免疫组化切片质量动态观察
3 讨 论
3.1 影响免疫组化染色质量的原因
在质量管理改进前的Q组中,影响切片质量甚至不合格被要求重复染色的因素较多,主要为组织的前期处理不当,影响了部分抗体的表达,甚至造成脱片;各种原因导致的表达异常(组织中内对照未呈现预期阳性、非特异着色、阳性异位表达等);试剂管理混乱,使用了失效或过期试剂,无法溯源;染色结果与病理医师的诊断思路相左而被要求复染;病理医师对医嘱的修正未能及时与技师沟通,导致执行出现偏差;对技术员缺乏系统的理论培训和实操考核,也是影响实验结果稳定性的重要因素。运用ISO15189中的要素,通过质量管理持续改进后的H组,对免疫组化实验室进行全方位管理,上述因素得到有效控制,使切片优良率大幅提升,大大减少了实验前、实验过程和实验结果的不确定性,也使免疫组化切片的复染率显著降低。
3.2 质量持续改进中切片质量动态观察分析
PDCA循环是美国质量管理专家戴明博士提出的一种全面质量管理应遵循的科学程序,是质量计划的制订和组织实现的过程[3]。在持续6 个月的实验室整改过程中,我们遵循计划-执行-检查-处理(PDCA)质量循环,对影响制片质量的多种因素进行多次循环和持续改进。上一个循环中出现和遗留的问题,转入下一个循环进一步改进,逐步提高了免疫组化片的优良率。
3.3 质量管理改进措施
3.3.1 标准作业程序文件的完善和执行
提高实验室的质量管理水平,需完善质量体系文件,才能确保质量体系能够长久有效地运行[4]。按照ISO15189中的管理要素,根据实验室自身条件,建立和完善免疫组化室的程序性文件和作业指导书,并逐步完善了各种记录[5]。工作人员严格按照标准作业程序(SOP)文件的要求规范操作,是稳定质量的前提。
3.3.2 人员的管理
实验室质量管理,人员是第一要素。对此,我们依据ISO15189技术要素5.1对人员进行以下几方面的管理。
3.3.2.1 对技术员的资质要求
技术员必须具备相关专业本科学历,病理常规技术工作3年以上,具有病理技术专业资质。
3.3.2.2 规范对技术员的培训
首先进行免疫组化及其相关知识的理论培训;免疫组化SOP文件的培训;仪器设备的使用和实验操作的培训;参加相关机构组织的免疫组化技术培训并取得证书;注重个人能力的培养,逐步了解和掌握各种标记物在组织和细胞中的定位和表达,掌握判断真假阳性的经验和技能,有利于对实验过程和结果进行分析和评估。
3.3.2.3 个人技术档案的管理
对个人信息、继续教育培训、能力和表现定期考核评估,归入个人技术档案。由实验室管理人员对技术人员书面授权,设定工作权限。
3.3.3 仪器设备的管理
依据ISO15189技术要素5.3.1对仪器设备做以下几方面管理。
3.3.3.1 建立仪器设备档案
每一台或每一类仪器设备均建立专属档案。重点是与厂商建立联系,完善必要的性能验证、维修保养、操作使用记录。目的是实时掌握仪器设备运行状况,保证仪器设备良好运行。
3.3.3.2 仪器设备操作培训
技术员必须经过专业人员或带教老师的培训,严格按照设备管理程序,定期对仪器设备进行清洁维护和保养,及时做好相应记录。
3.3.4 试剂耗材的管理
依据ISO15189技术要素5.3.2,建立《试剂耗材管理程序》,对试剂耗材进行采购、验收、库存和出库的信息化管理。免疫组化试剂和耗材的特点是:品种繁多,使用频率差异较大,工作中易疏忽,导致使用过期试剂耗材。使用电子信息管理系统,使试剂耗材的管理变得有序。对试剂耗材的使用可实时追踪,具有可追溯性。
3.3.5 质量管理
3.3.5.1 内部质量控制
第一,标本的质量控制:离体标本及时充分固定、规范取材和组织处理程序是免疫组化实验成功的前提。第二,试剂的质量控制:每一个批号的试剂,在购置验收后,用已知的阳性组织,按照规范的操作流程,做试剂有效性验证,测定最佳稀释度和最佳实验条件,并做详细记录。第三,实验过程的质量控制:在每张载玻片上,待检组织的远端,裱贴同一标记物的阳性对照组织,以保证待检组织与对照组织保持实验条件的一致性,有利于结果的对比和判断,尤其是相关精准诊断和靶向治疗的标记物。阳性对照组织的设立,采取制作单组织和多组织芯片或多种组织制成的羊膜卷。第四,实验结束:镜下观察对照组织和待检组织染色效果,如果发现表达异常,及时追溯,或与病理医师及时沟通,做好不良事件或异常表达记录,便于今后分析。
3.3.5.2 外部室间质评
制订程序化文件,每年至少2次参加国家病理质量控制中心(PQCC)或中国医疗器械行业协会病理专业委员会(CCPI)组织的免疫组化室间质评,验证能力,体现水平,保证质量,循序渐进,完善质量管理体系。2017年10月以前,我们的免疫组化染色除少数涉及临床治疗的关键性指标设立阳性对照外,大部分用于常规辅助病理诊断的指标仅仅依靠被检组织内或许存在的阳性物质作参照。这种质控方式一度在免疫组化发展进程中被推崇和默许。当组织中缺少内对照时,难以判断抗体是否应该表达、试剂是否有效、实验程序是否有误,出现问题时难以查找原因。特别是免疫组化结果与病理医师诊断方向相左时,病理医师更是心存疑虑,下诊断如履薄冰。因此,重复实验时常发生。针对上述问题,我们数次派人员外出参加ISO15189的内审员培训和实践运用培训,并持续改进;通过PDCA质量循环,规范组织的前期处理[6],持续提高免疫组化切片染色质量;建立医技之间有效的沟通机制,增强医技互信,对购进的每一批次试剂,进行有效性验证试验;确立每种指标的最佳实验条件;借鉴外部的实践经验,逐步建立实验室内部的阳性组织对照库;在每张免疫组化片上标贴阳性对照组织,确保对照组织和待检组织在实验条件上的一致性。经过半年的努力,降低了复染率,免疫组化实验室管理得到整体提升。
