稻米淀粉合成和食味品质改良研究进展
2021-09-11刘岩傲雁徐茂森张涛唐家琪李尧卿张超于恒秀
刘岩 傲雁 徐茂森 张涛 唐家琪 李尧卿 张超 于恒秀


摘要:稻米品质主要由碾磨品质、外观品质、蒸煮与食味品质和营养品质等组成。随着生活条件的逐步提升,人们对蒸煮与食味品质优良的稻米需求越来越高。而淀粉是稻米胚乳的主要成分,是影响其食味品质的重要因素,育种家们基于对淀粉合成相关基因与稻米蒸煮食味品质间的关联分析结果,利用常规育种和CRISPR/Cas9等技术创建了一系列具有优良食味品质的水稻新品种(系)。本文总结了稻米品质的组成和影响因素、高等植物淀粉的生物合成途径、淀粉合成底物ADPG的转运途径、直链淀粉和支链淀粉的合成途径、淀粉合成基因与稻米蒸煮食味品质改良的关系以及Wx基因等位变异在稻米品质改良中应用的研究进展,为以后稻米蒸煮食味品质改良提供参考。
关键词:水稻;食味品质;直链淀粉;支链淀粉;生物合成;品种改良
中图分类号:S511.01 文献标志码: A 文章编号:1002-1302(2021)16-0018-08
水稻是世界上超过50%人口的食粮,也是我国重要的粮食作物,水稻生产在国民经济中的地位十分重要[1]。在新时代,粮食安全的问题不容乐观,育种工作的严峻性依然不容轻视,我们要走一条中国特色粮食安全之路。长期以来,我国水稻的生产和研究注重产量,对水稻的品质研究有所忽视,因此,生产的稻米品质并不能完全满足国民的需求,且在国际市场上竞争力并不强。所以,培育优良食味品质的水稻品种便成了我国水稻育种工作重要的一部分,以达到满足市场需求的目的。目前,利用基因编辑技术调控水稻胚乳淀粉合成的相关基因表达,是改良稻米食味品質行之有效的方法。
1 稻米品质的组成及影响因素
1.1 稻米品质的组成
在不同的地域,人们对稻米品质的偏好和要求各有差异,因此评价稻米品质的指标也有不同。在“中国好粮油-稻谷”LS/T3108—2017国家标准对优质大米的指标做了量化,由碾磨品质、外观品质、蒸煮与食味品质和营养品质等共同组成稻米品质。而稻米的蒸煮食味品质有着密切的关系是稻米直链淀粉和支链淀粉的组成比。
1.2 稻米品质的影响因素
稻米研磨品质很受稻米加工企业的关注。稻谷在加工过程中会有多个步骤,最终以糙米率、精米率、整精米率3个数值来表示研磨品质。但是,这些指标也受到成熟期的田间温度、湿度、收割等操作以及贮藏条件的影响。
外观品质主要表现直接影响了籽粒的透明度,肉眼观察以透明、半透明、不透明3种情况呈现,垩白多的水稻品种,碾米时容易碎米,出米率也低,因此,根据垩白对稻米外观的影响,常用垩白粒率和垩白大小2个指标表示。目前,国际市场上,长粒型米因其垩白粒率较低而较为受欢迎。
蒸煮食味品质是稻米品质的核心。通过品尝的方式决定往往有不易定量化和受主观影响判断较大,现多用测定稻米理化特性来表示:包括直链淀粉含量、糊化温度、胶稠度、快速黏滞性谱等[2]。稻米直链淀粉含量与米饭的黏性、硬度、吸水性等均有紧密的相关性。直链淀粉含量低时,蒸煮时干燥而蓬松,色暗,冷却后回生变硬。糊化温度是指淀粉粒在受热吸收水分开始膨胀时的温度,这种变化是不可逆性。常用差示扫描量热仪直接测糊化温度,在稻米淀粉糊化温度中,有以下3种:高(>74 ℃)、中(70~74 ℃)和低(<70 ℃)。煮饭所需时间与糊化温度呈正相关。所以,稻米一旦蒸煮时间过长会对食味品质和外观造成影响,所以认为中等糊化温度的稻米食味品质最合适[3]。胶稠度是稻米淀粉胶体特性,是衡量米饭软硬的评判标准,认为胶稠度的增加会使米质变软[4]。RVA是稻米米粉匀浆在加热、持续高温和冷却过程中黏度变化的动态图。用最高黏度、热浆黏度、冷胶黏度、崩解值、消减值、回复值、峰值时间和糊化温度[5]。所以通过RVA谱比较可以很好地反映稻米品质。
营养品质主要是指稻米中的蛋白质和可吸收氨基酸含量。通常稻米中蛋白质含量越高,表示营养价值越高,但蛋白质可以和除淀粉之外的多聚糖结合形成坚固的结构,使稻米的弹性变差,变硬,稻米的蒸煮食味品质会降低。蛋白质含量除受大米本身的遗传因子影响外,受环境因素和栽培技术影响也很大[6]。高温是对稻米品质影响的最大因素,也是从事水稻研究、生产人员密切关注的科研方向[7]。并且水稻孕穗、开花和灌浆期处于一年中温度最高的时间区,该时期反常的极端天气将会对水稻各组分合成和积累造成重要的影响,间接降低稻米的品质和产量[8]。相关研究表明,高温可以导致胚乳中光合产物积累不足,在籽粒灌浆期,高温处理会导致直链淀粉含量和胶稠度都降低,蛋白质含量增加,但是淀粉粒结构并未发生变化[9],同时还会增加碎米和垩白而降低稻米蒸煮食味品质[10]。
2 植物淀粉的生物合成途径及相关基因的研究进展2.1 高等植物中淀粉的生物合成途径
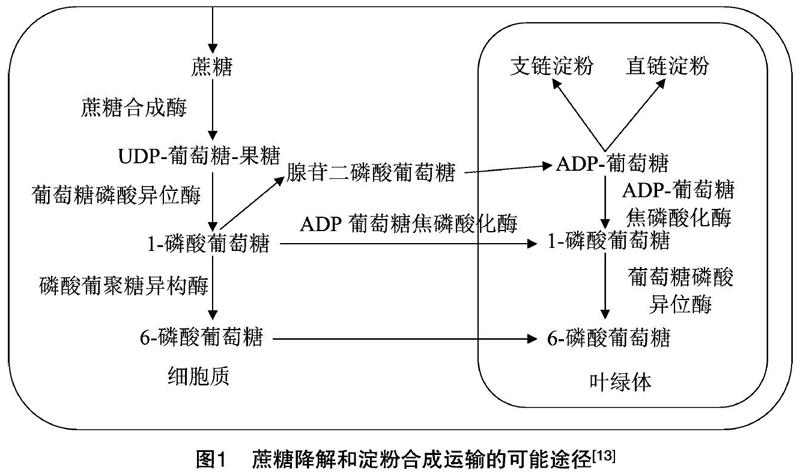
高等植物中,淀粉的主要合成位置是叶绿体和造粉体,淀粉是谷物中主要储藏物,被用作碳骨架的主要储存物,用于生物代谢。在水稻中白昼在叶绿体中合成的淀粉用于夜晚细胞代谢的其他途径(图1)。叶绿体中合成的是临时淀粉,造粉体中合成的是贮藏淀粉。蔗糖在细胞液中通过酶的水解作用形成果糖及UDP-葡萄糖,果糖被果糖激酶水解形成6-磷酸果糖,而后通过磷酸葡聚糖异构酶的作用或者葡萄糖磷酸异位酶的催化作用形成6-磷酸葡萄糖或1-磷酸葡萄糖。UDP-葡萄糖可以形成1-磷酸葡萄糖,在AGPase酶的作用下形成腺苷二磷酸葡萄糖,最终再经过一系列淀粉合成相关酶的作用下合成淀粉[11],从而为种子生长和发育供应所需要的能量和营养,在种子萌发和幼苗早期生长发育起着至关重要的作用[12-13]。
淀粉合成的网络是由多个基因参与的复杂网络过程。淀粉的合成是在ADP-葡萄糖焦磷酸化酶、可溶性淀粉合(成)酶、淀粉分支酶、淀粉去分支酶四类关键性酶协同下,才能完成淀粉的生物合成[13]。
2.2 淀粉合成底物ADP-葡萄糖焦磷酸化酶的转运途径
淀粉合成过程中的第一个关键酶是腺苷二磷酸葡萄糖焦磷酸化酶,它具有催化1-磷酸葡萄糖和磷酸腺苷反应生成腺苷二磷酸葡萄糖,并且释放焦磷酸的功能。因此,淀粉合成的限速酶是ADP-葡萄糖焦磷酸化酶[14]。在高等植物中,ADP-葡萄糖焦磷酸化酶是由2个大亚基和2个小亚基组成的异源四聚体[13]。水稻中鉴定到6个ADP-葡萄糖焦磷酸化酶家族的成员,分别编码腺苷二磷酸葡萄糖焦磷酸化酶的2个小亚基和4个大亚基,命名为AGPS1、AGPS2和AGPL1、AGPL2、AGPL3、AGPL4[15]。其中AGPS2(8号染色体)存在AGPS2a和AGPS2b这2种剪接形式。并且这2种ADP-葡萄糖焦磷酸化酶蛋白存在很高的功能和结构相似性[16-17]。AGPL1和AGPS1在叶绿体中互作形成全酶,催化淀粉生物合成。在幼苗地上部,AGPL1和AGPS1均在叶片、叶鞘和基节等全部器官中表达。在初生根和冠根中,2种基因的表达都局限于根尖的伸长和成熟区以及靠近根尖的区域[18]。AGPL1在水稻种子发育中期优势表达,其表达和培养细胞中淀粉含量受蔗糖和脱落酸浓度的协同调控[15]。颖果发育过程中,AGPL2在水稻籽粒灌浆和淀粉合成中发挥重要的调控作用[19]。AGPL2和AGPS2b相互作用,对水稻胚乳贮藏物质如淀粉和蛋白的积累十分重要。在缺少AGPL2时,AGPS2b可能不能自身互作形成高分子量聚合体。因此,水稻AGPase组装的分子机制可能与拟南芥存在差异[20]。AGPL4影响淀粉合成,进而影响花粉育性,因此,AGPL4突变会阻碍淀粉合成,而导致花粉不育[21]。
2.3 直链淀粉的合成
稻米胚乳直链淀粉是蜡质基因(Wx)编码的蛋白质颗粒结合淀粉合酶Ⅰ催化的,Wx基因对稻米胚乳直链淀粉的含量产生最直接影响,对大米的烹煮和食用品质属性具有重要的影响[22-23]。
稻米直链淀粉是α-D-葡萄糖通过α-1,4-糖苷键连接形成的数千个单位长的葡聚糖链状分子,几乎没有分支或者分支极少[24]。直链淀粉的合成发生在淀粉和蔗糖代谢及糖酵解/糖异生过程中,与淀粉和蔗糖代谢直接相关[25-26]。主要由颗粒淀粉合成酶催化合成[26],颗粒结合淀粉合酶是一种葡萄糖基转移酶,专门负责延长直链淀粉聚合物,Wx基因是在不影响支链淀粉的情况下直接控制直链淀粉含量的唯一靶点。在水稻中,颗粒结合淀粉合成酶分别为GBSSⅠ和GBSSⅡ,GBSSⅡ主要在叶片中表达,参与叶绿体中临时淀粉的合成,GBSSⅠ主要在胚乳中表达,与胚乳中淀粉的生物合成有关联。
相关研究表明,拟南芥中直链淀粉合成也需要靶向淀粉的蛋白(PTST)。PTST是一种具有N-末端卷曲结构域和C-末端糖结合模块(CBM)的可塑性蛋白。颗粒结合淀粉合酶通过卷曲结构域与PTST发生物理作用。此外,还发现PTST的CBM结构域介导了其与淀粉颗粒的相互作用,这也是正确的颗粒结合淀粉合酶定位所必需的。荧光标记的拟南芥颗粒结合淀粉合酶在烟草或拟南芥叶片中表达,都需要拟南芥PTST的存在来定位淀粉颗粒。PTST的CBM突变导致颗粒结合淀粉合酶留在质体基质中。而拟南芥中已经发现PTST的3个同源基因:PTST1、 PTST2和PTST3。PTST实现了一种以前未知的功能,即靶向颗粒结合淀粉合酶淀粉,揭示了靶向生物合成酶的重要性。重要的是PTST代表了一个有希望的新的基因靶点,使生物技术修饰淀粉成分成为可能,目前只有PTST1参与直链淀粉的合成[27]。研究发现拟南芥ptst1突变体无法合成直链淀粉,颗粒结合淀粉合酶蛋白显著减少,并且在表型上与缺乏颗粒结合淀粉合酶的突变体相似。因此,目前新鉴定出了水稻颗粒结合淀粉合酶結合蛋白OsGBP,很大可能就是PTST1同源基因,而osgbp突变体与野生型相比,突变体叶片和籽粒中直链淀粉含量会降低[28]。
2.4 支链淀粉的合成
稻米支链淀粉是由α-D-葡萄糖通过α-1,4-糖苷键和α-1,6-糖苷键共同连接形成的高度分支的葡萄糖聚合物[29]。支链淀粉的生物合成也是受多种酶的协同完成的,每一种酶都扮演着不同的角色。其中SS会通过影响支链淀粉的延伸达到对支链淀粉合成的调控(图2)[30]。并且存在8种同工型,分别为SSⅠ、SSⅡ-1(SSⅡc)、SSⅡ-2(SSⅡb)、SSⅡ-3(SSⅡa)、SSⅢ-1(SSⅢb)、SSⅢ-2(SSⅢa)、SSⅣ-1(SSⅣa)和SSSⅣ-2(SSⅣb)[31]。SSⅠ和SSⅡa分别主要负责合成支链淀粉短链和支链淀粉短支链(DP≤12),对直链淀粉含量的影响较小[1,32]。SSⅡa/SSⅢa的双突变体与野生型相比,结果会导致籽粒出现垩白、直链淀粉含量增加、糊化温度升高、黏度降低的现象[33-35]。水稻胚乳产生特有的复合颗粒,在一个淀粉体中含有几十个多面体淀粉颗粒,其他一些谷物品种产生简单型颗粒,即每个淀粉体只有1个淀粉颗粒[36]。SSⅢa和SSⅣb突变会导致水稻胚乳淀粉颗粒形态由多面体变为球形[37]。过表达SSⅣ会导致拟南芥叶片淀粉积累水平增加30%~40%,株系表现出较高的生长率[38]。在长期贮藏的淀粉器官如马铃薯块茎中,观察到SSⅣ表达增强导致淀粉含量的增加。表明SSⅣ是控制淀粉在质体中积累量的调控步骤之一[39]。
在水稻中淀粉分支酶存在3种同工型:SBE1(SBEⅠ)、SBE3(SBEⅡb)、SBE4(SBEⅡa)[40]。SBE1编码1个糖苷水解酶13家族蛋白[41]。SBE1的突变会导致幼苗白化、叶绿体发育异常,在三叶期死亡[42]。作用是催化葡萄糖链产生由α-1,6糖苷健连接的分支酶。纯化酶体外试验表明,SBEⅡb形成了DP7和DP6的外部短链[43]。SBE3突变会导致支链淀粉链长减少,同时会导致直链淀粉和抗性淀粉含量明显上调[44-45]。从SBE同工酶的氨基酸序列同源性方面看,SBE4更类似于SBE3[46]。
淀粉去分支酶分为2类:间接去分支酶和直接去分支酶。间接去分支酶存在于动物、酵母中[47]。直接去分支酶起水解α-1,6-糖苷键的作用,包括异淀粉酶ISA1、ISA2、ISA3和普鲁兰酶[13]。ISA编码基因突变后会使支链淀粉的积累无法达到正常情况。相关研究表明,ISA1的突变会导致籽粒淀粉含量减少,可溶性葡聚糖和糖原大量积累,呈现为糖质胚乳,并且容易穗发芽[48-49]。水稻中过表达ISA2会导致所有的ISA1形成异源寡聚体,使淀粉的合成受到影响[50]。
3 淀粉合成基因与稻米蒸煮食味品质的关系
通过淀粉的生物学合成途径以及淀粉的组成精细结构研究表明,淀粉合成相关基因都直接或间接性地对稻米的蒸煮食味品质产生影响(图3)[51]。到目前为止,只有Wx基因是即对稻米直链淀粉含量,又可以对胶稠度的产生影响的主效基因[52-53]。除此之外,在SS Ⅱ基因中,SS Ⅱ-3是作为唯一控制糊化温度的主效基因,在胚乳中最高的表达量,是通过酶活降低或缺失导致支链淀粉A链增加,B1链减少的方式,酶活降低的主要原因是关键氨基酸的变异。且SS Ⅱ-3基因和Wx基因位于水稻6号染色体上相邻位置。目前已经有同时对SS Ⅱ-3基因和Wx基因进行编辑从而达到改良稻米蒸煮食味品质研究。为此,国内各机构和高校纷纷展开对稻米蒸煮食味品质改良的研究,四川农业大学按Wx基因型分类,通过多代回交,对21个纯合GC型供试品种和39个TT型供试品种进行糊化温度分析,分析结果表明,稻米糊化温度与直链淀粉之间不存在着显著的相关性;直链淀粉含量有差异的水稻品种,糊化温度也高低不一;因此,推断控制糊化温度的基因位点和Wx基因位点无关系。而稻米的直链淀粉含量和胶稠度则存在着不同程度的负相关关系,是由Wx基因控制的。同时,亦说明稻米的胶稠度也是由Wx基因或与其连锁的基因控制的[54]。同样,西南科技大学证明了Wx基因与SS Ⅲ-2基因互作,且Wx基因对SS Ⅲ-2基因有显性上位性[55]。李钱峰等把日本晴背景的SS Ⅱ-2 RNAi转基因材料与直链淀粉含量相近的软米对照在不同含水量情况下的籽粒外观进行比较,SSⅡ-2 RNAi转基因稻米在低含水量下仍保持良好的透明度,未出现类似于软米暗胚乳(半透明)缺陷,而抑制SS Ⅱ-2 基因的表达在非糯背景中可协同调控直链淀粉和支链淀粉的合成进而改良稻米蒸煮食味品质[56]。对抗条纹叶枯病武运粳8号的SS Ⅱ-2基因的RNA干扰转基因植株研究成果也类似,直链淀粉含量降低的情况下,糊化温度会上升,蒸煮的米饭光泽、外观、口感、黏度均有所提升,对稻米蒸煮食味品质改良达到显著效果[57]。研究水稻淀粉合成相关基因与稻米直链淀粉含量、胶稠度和糊化温度之间的遗传关系,不仅对胶稠度和糊化温度的遗传机制及相关基因的定位克隆有帮助,而且对稻米蒸煮食味品质的改良效果更明显。这对于常规栽培水稻品种的品质研究也有指导作用,同时为稻米品质改良的遗传研究提供了理论基础。
近期四川农业大学任万军教授团队根据稻米食味值的已有研究基础,通过对西南地区36个常规籼稻品种食味值研究,划分为3个食味类型:(高食味类型食味值=72.76;中食味类型食味值=68.2;低食味类型食味值=61.7)。高食味类型的含义是直链淀粉和蛋白质含量都比较低,峰值黏度和崩解值比较高,热浆黏度、回复值和最终黏度低,为评价籼稻米的食味品质提供了理论基础[58],也为不同背景的籼稻米食味品质材料积累了基础研究数据。
4 Wx基因等位变异在稻米品质改良中的应用
水稻Wx基因的自然等位变异是导致不同水稻品种淀粉含量不同的主要因素。非糯性基因(Wx)对糯性基因(wx)表现为不完全显性,存在着较为显著的剂量效应[59]。在自然界中,Wx基因主要有2种常见的类型,一是Wxa,常见于直链淀粉含量较高的籼稻(25%);二是Wxb,常见于直链淀粉含量较低的粳稻(AC-16%)[26]。由于直链淀粉的含量属于转录后的调控,与内含子的表达能力有着重要的关系[52],因此,目前研究方向是通过对Wx基因转录水平的表达调控来达到影响淀粉含量的目的,以期达到改良稻米蒸煮食味品质[60-61]。此外,研究人员通过序列分析研究表明,相较于Wxa而言,Wxb的第1内含子5′端剪切时的突变(G→T),会导致第1内含子剪接出错,结果会以直链淀粉含量下降的形式呈现[62]。而糯性基因wx属于Wx基因的突变,造成的功能性缺失[63]。正是因为Wx基因的自然等位变异导致水稻品种直链淀粉含量和蒸煮食味品质存在广泛差异[64],发现Wx基因的表达受到抑制或者增强时候,对转基因水稻主要农艺性状的影响最小。
基于以上研究基础,近年来,育种家们通过CRISPR/Cas9技术对Wx基因进行编辑,调节淀粉相关基因的表达,以期达到改良稻米蒸煮食味品质。浙江大学作物科学研究所对水稻品种哈勃601 Wx基因进行定向突变,进而培育出精米与亲本相似纯合突变系,精米为椭圆形,但米粒呈蜡质状,不透明,与哈勃601米粒透亮外观形成显著对比[65]。因此,通过CRISPR/Cas9技术将淀粉合成相关基因进行编辑快速获得不同基因型的纯合突变体是改良稻米蒸煮食味品质的一个重要途径[66]。
基于Wx基因复等位基因的同源重组和淀粉合成相关基因的重组创建新型水稻种质资源(Wxmw/Wxla),而达到直链淀粉含量降低改良稻米蒸煮食味品质的目的。除此之外,Wxop、Wxmp、Wxmq等复等位基因控制介于粳稻和糯稻之间的低直链淀粉含量品种;Wxin等位基因控制介于籼稻和粳稻之间的中等直链淀粉含量品种[23,63,67-68]。研究表明,携带Wxmp基因的水稻品种中,直链淀粉含量约为10%(南粳46为10.6%),且主要分布于江沪一带[69]。而该品种是市场上较为流行的“软米”,具有米饭柔软、富有弹性、冷却后不易变硬等优点,因此Wxop、Wxmp、Wxmq等复等位基因也被成为“软米基因”[70-71]。由于直链淀粉含量受环境条件的影响比较大,如高温、高湿度等气候因素,且江苏地理上南北走向较大,因此培育适合各地的优良食味品质的稻米品种成为科学家的目标。目前,江苏地区推广较广的是南粳5055、南粳46和南粳9108,這些品种可以适合江苏省各不同地区种植,即江苏省不同地区均有了适合种植的优质软米。
在作物育種中,将遗传变异引入到优异推广品种中,是快速推进育种进程的重要手段。伴随着CRISPR/Cas9 系统的基因编辑技术的快速发展,为作物基因组单碱基编辑方法的建立起到了重要作用。中国科学院遗传与发育生物学研究所在前期工作基础上,在小麦、水稻和玉米基因组中实现高效、精确的单碱基定点突变。基于作物基因组单碱基编辑方法的成熟,扬州大学农学院刘巧泉教授课题组利用CRISPR/Cas9编辑技术对Wx基因进行编辑,在Wxb背景下创建了6种直链淀粉含量微调的新型Wx等位基因,新型Wx等位变异的直链淀粉含量介于粳稻和软米之间,且互相之间存在差异,但籽粒外观仍然保持高度透明,且在不同的温度条件下稻米蒸煮食味品质均有所改良[72]。
同时,伴随着基因组编辑效率和精度的提高,遗传变异和高效的筛选体系将不再是困扰作物育种的重要因素。分子模块设计育种的发展也逐步开始进入研究。
5 结论与展望
随着基因工程技术的快速发展,对稻米食味品质的快速改良已经成为了可能。特别是通过对稻米淀粉合成相关基因的功能分析,已经日趋完善对淀粉合成的遗传调控机制理解[73-74],将会给常规育种工作中的难题带来解决方案。从国家粮食安全角度出发,要加强稻麦等主要粮食作物的遗传育种研究,如加强种质资源的保护,推进种子库的建立,以及将常规育种技术与生物技术结合以推进育种目标符合市场的需求。目前市场上备受追捧的主要是东北大米、江苏大米和泰国大米等优良食味品种,我国是一个幅员辽阔、气候环境多样的大国,拥有着丰富的种质资源待开发和利用。不过随着生物技术的发展,特别是近年来CRISPR/Cas9技术在水稻育种中成熟应用及与传统育种技术的结合,将会有利于基因发掘,也将快速地应用到育种实践中。可喜的是我国水稻和小麦2个最基本口粮已完全自主选育品种,并且产量较高,基本满足人们的需要,但是,不同人群以及不同的加工产品对稻米品质的要求越来越高,对水稻育种工作的要求也越来越高。随着对淀粉合成相关基因研究的不断深入,围绕Wx基因和SS基因表达调控改良稻米品质的研究取得了长足进展。纵观过去多年全国各地作物研究所在水稻育种中取得的成绩,已经在稻米食味品质改良中有了一定的基础,通过降低稻米直链淀粉含量,来提高稻米蒸煮食味品质已经有了突出成果,达到全民由“吃得饱”到“吃得好”的跨越,这也是育种工作者的目标。相信通过常规育种与现代分子生物学技术结合也将会培育出更多的适合于中国广袤的土地生长的优质水稻新品种(系)。
参考文献:
[1]高振宇. 水稻稻米糊化温度控制基因的图位克隆及其序列分析[J]. 中国科学(生命科学),2003,33(6):481-487.
[2]Griglione A,Liberto E,Cordero C,et al. High-quality Italian rice cultivars:Chemical indices of ageing and aroma quality[J]. Food Chemistry,2015,172(4):305-313.
[3]汤圣祥,张云康. 籼粳交和妥米胶稠度的遗传特性分析[J]. 中国水稻科学,1996,10(4):197-200.
[4]贾 良,丁雪云,王平荣,等. 稻米淀粉RVA谱特征及其与理化品质性状相关性的研究[J]. 作物学报,2008,(5):790-794.
[5]Knill C J,Kennedy J F. Rye:production,chemistry and technology (2nd edition)[J]. Carbohydrate Polymers,2002,49(4):515-516.
[6]赵 达. 稻米品质性状的全基因组关联分析及品质相关基因的遗传解析[D]. 武汉:华中农业大学,2019:12-18.
[7]龚金龙,张洪程,胡雅杰,等. 灌浆结实期温度对水稻产量和品质形成的影响[J]. 生态学杂志,2013(2):482-491.
[8]禾 谷. 测定太阳辐射和温度预测水稻产量[J]. 农业科学导报,1986(1):30-30.
[9]Lin C J,Li C Y,Lin S K,et al. Influence of high temperature during grain filling on the accumulation of storage proteins and grain quality in rice (Oryza sativa L.)[J]. Journal of Agricultural & Food Chemistry,2014,58(19):10545-10552.
[10]万向元,胡培松,王海莲,等. 水稻品种直链淀粉含量,糊化温度和蛋白质含量的稳定性分析[J]. 中国农业科学,2005(1):1-6.
[11]Hannah L C,James M. The complexities of starch biosynthesis in cereal endosperms[J]. Current Opinion in Biotechnology,2008,19(2):160-165.
[12]于桂玲. 植物淀粉合成酶基因的复制和功能分化研究[D]. 雅安:四川农业大学,2015:7-15.
[13]Jeon J S,Ryoo N,Hahn T R,et al. Starch biosynthesis in cereal endosperm[J]. Plant Physiology and Biochemistry,2010,48(6):383-392.
[14]Dellepiane G. Is There an alternative pathway for starch biosynthesis in cereal seeds[J]. Zeitschrift Für Naturforschung,1994,49(3/4):215-219.
[15]Akihiro T,Mizuno K,Fujimura F. Gene expression of ADP-glucose pyrophosphorylase and starch contents in rice cultured cells are cooperatively regulated by sucrose and ABA[J]. Plant & Cell Physiology,2005,46(6):937-946.
[16]Huang B T. Functions of multiple genes encoding ADP-glucose pyrophosphorylase subunits in maize endosperm,embryo,and leaf[J]. Plant Physiology,2014,164 (2):596-611.
[17]Ballicora M. Adenosine 5′-diphosphate-glucose pyrophosphorylase from potato tuber. Significance of the N terminus of the small subunit for catalytic properties and heat stability[J]. Plant Physiology,1995,109(1):245-251.
[18]Meng Q,Zhang W,Hu X,et al. Two ADP‐glucose pyrophosphorylase subunits,OsAGPL1 and OsAGPS1,modulate phosphorus homeostasis in rice[J]. The Plant Journal,2020,104(5):1269-1284.
[19]Wei X,Jiao G,Lin H,et al. GRAIN INCOMPLETE FILLING 2 regulates grain filling and starch synthesis during rice caryopsis development[J]. Journal of Integrative Plant Biology,2017,59(2):134-153.
[20]Tang X J,Peng C,Zhang J,et al. ADP-glucose pyrophosphorylase large subunit 2 is essential for storage substance accumulation and subunit interactions in rice endosperm[J]. Plant Science,2016,249:70-83.
[21]Sang-Kyu L,Joon-Seob E,Seon-Kap H,et al. Plastidic phosphoglucomutase and ADP-glucose pyrophosphorylase mutants impair starch synthesis in rice pollen grains and cause male sterility[J]. Journal of Experimental Botany,2016,67(18):5557-5569.
[22]Dian W,Jiang H,Chen Q,et al. Cloning and characterization of the granule-bound starch synthase Ⅱ gene in rice:gene expression is regulated by the nitrogen level,sugar and circadian rhythm[J]. Planta,2003,218(2):261-268.
[23]Mikami I,Uwatoko N,Ikeda Y,et al. Allelic diversification at the wx locus in landraces of Asian rice[J]. Theoretical & Applied Genetics,2008,116(7):979-989.
[24]張艳霞,丁艳锋,李刚华,等. 直链淀粉含量不同的稻米淀粉结构,糊化特性研究[J]. 作物学报,2007,33(7):1201-1201.
[25]Chang T S,Wei C. Mapping and comparative proteomic analysis of the starch biosynthetic pathway in rice by 2D PAGE/MS[J]. Plant Molecular Biology,2017,95(4):333-343.
[26]Sano Y. Differential regulation of waxy gene expression in rice endosperm[J]. Theoretical and Applied Genetics,1984,68(5):467-473.
[27]Seung D,Soyk S,Coiro M,et al. PROTEIN TARGETING TO STARCH is required for localising GRANULE-BOUND STARCH SYNTHASE to starch granules and for normal amylose synthesis in Arabidopsis[J]. PLoS Biology,2015,13(2):6-10.
[28]Wang W,Wei X,Jiao G,et al. GBSS‐BINDING PROTEIN,encoding a CBM48 domain containing protein,affects rice quality and yield[J]. Journal of Integrative Plant Biology,2020,62(7):948-966.
[29]邵 科. 低淀粉黏滯性稻米的理化特性及其基因定位研究[D]. 扬州:扬州大学,2010:15-30.
[30]Tian Z. Allelic diversities in rice starch biosynthesis lead to a diverse array of rice eating and cooking qualities[J]. Proceedings of the National Academy of Sciences,2009,106(51):21760-21765.
[31]Ohdan T,Francisco P B,Sawada T,et al. Expression profiling of genes involved in starch synthesis in sink and source organs of rice[J]. Journal of Experimental Botany,2005,56(422):3229-3244.
[32]Fujita N,Rui S,Hayashi A,et al. Starch biosynthesis in rice endosperm requires the presence of either starch synthase Ⅰ or Ⅲa[J]. Journal of Experimental Botany,2011,62(14):4819-4831.
[33]Zhang G,Cheng Z,Zhang X,et al. Double repression of soluble starch synthase genes SSⅡa and SSⅢa in rice (Oryza sativa L.) uncovers interactive effects on the physicochemical properties of starch[J]. Genome,2011,54(6):448-459.
[34]Zhou H,Wang L,Liu G,et al. Critical roles of soluble starch synthase SSⅢa and granule bound starch synthase Waxy in synthesizing resistant starch in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2016,113(45):12844-12849.
[35]Hayashi M,Kodama M,Nakamura Y,et al. Thermal and pasting properties,morphology of starch granules,and crystallinity of endosperm starch in the rice SSⅠ and SSⅢa double mutant[J]. Journal of Applied Glycoscience,2015,62(2):81-86.
[36]Myers A M,James M G,Lin Q,et al. Maize opaque5 encodes Monogalactosyldiacylglycerol synthase and specifically affects galactolipids necessary for amyloplast and chloroplast function[J]. Plant Cell,2011,23(6):2331-2347.
[37]Toyosawa Y,Kawagoe Y,Matsushima R,et al. Deficiency of starch synthase Ⅲa and Ⅳb alters starch granule morphology from polyhedral to spherical in rice endosperm[J]. Plant Physiology,2016,170(3):1255-1270.
[38]Gámez‐Arjona F M,Li J,Raynaud S,et al. Enhancing the expression of starch synthase class Ⅳ results in increased levels of both transitory and long-term storage starch[J]. Plant Biotechnology Journal,2011,9(9):1049-1060.
[39]Roldán I,Wattebled F,Lucas M M,et al. The phenotype of soluble starch synthase Ⅳ defective mutants of Arabidopsis thaliana suggests a novel function of elongation enzymes in the control of starch granule formation[J]. Plant Journal for Cell & Molecular Biology,2010,49(3):492-504.
[40]Rahman S. Comparison of starch-branching enzyme genes reveals evolutionary relationships among isoforms. Characterization of a gene for starch-branching enzyme Ⅱa from the wheat genome donor Aegilops tauschii[J]. Plant Physiology,2001,125(3):1314-1324.
[41]Labes A. Novel members of glycoside hydrolase family 13 derived from environmental DNA[J]. Applied and Environmental Microbiology,2008,74(6):1914-1921.
[42]王兴春,王 敏,季芝娟,等. 水稻糖苷水解酶基因OsBE1在葉绿体发育中的功能[J]. 作物学报,2014,40(12):2090-2097.
[43]Nakamura Y,Utsumi Y,Sawada T,et al. Characterization of the reactions of starch branching enzymes from rice endosperm[J]. Plant & Cell Physiology,2010,51(5):776-794.
[44]Yongwei S,Guiai J,Zupei L,et al. Generation of High-Amylose rice through CRISPR/Cas9 mediated targeted mutagenesis of starch branching enzymes[J]. Frontiers in Plant Science,2017,8(298):15-26
[45]Zhu L,Gu M,Meng X,et al. High-amylose rice improves indices of animal health in normal and diabetic rats[J]. Plant Biotechnology Journal,2012,10(3):353-362.
[46]Sawada T,Itoh M,Nakamura Y. Contributions of three starch branching enzyme isozymes to the fine structure of amylopectin in rice endosperm[J]. Front Plant Science,2018,8(9):1536.
[47]周 会,张军杰,黄玉碧. 淀粉去分支酶研究进展[J]. 河南农业科学,2006,35(9):5-8.
[48]Nakamura Y,Umemoto T,Takahata Y,et al. Changes in structure of starch and enzyme activities affected by sugary mutations in developing rice endosperm. Possible role of starch debranching enzyme (R-enzyme) in amylopectin biosynthesis[J]. 1996,97(3):491-498.
[49]Du L,Xu F,Fang J,et al. Endosperm sugar accumulation caused by mutation of PHS8/ISA1 leads to prearvest sprouting in rice[J]. The Plant Journal,2018,95(3):545-556.
[50]Utsumi Y,Utsumi C,Sawada T,et al. Functional diversity of isoamylase oligomers:the IA1 Homo-Oligomer is essential for amylopectin biosynthesis in rice endosperm[J]. Plant Physiology,2011,156(1):61-77.
[51]Zhi X T,Qian Q,Qiao Q L,et al. Allelic diversities in rice starch biosynthesis lead to a diverse array of rice eating and cooking qualities[J]. Proc Natl Acad Sci U S A,2009,106(51):21760-21765.
[52]Wang Z Y,Zheng F Q,Shen G Z,et al. The amylose content in rice endosperm is related to the post transcriptional regulation of the waxy gene[J]. The Plant Journal,2010,7(4):613-622.
[53]Gao Z,Zeng D,Cui X,et al. Map-based cloning of the ALK gene,which controls the gelatinization temperature of rice[J]. Science in China (Series C:Life Sciences),2003,46(6):661-668.
[54]Nakamura Y,Sakurai A,Inaba Y,et al. The fine Structure of amylopectin in endosperm from Asian cultivated rice can be largely classified into two classes[J]. Starch,2010,54(3/4):117-131.
[55]杨博文,向珣朝,许顺菊,等. Wx基因与SSⅢ-2基因互作对稻米蒸煮食味品质的影响[J]. 西北植物学报,2017,37(5):879-884.
[56]黄李春. 精细调控Wx和SSⅡ基因表达改良稻米蒸煮食味品质[D]. 扬州:扬州大学,2020:62-78.
[57]徐志豪. 无抗性选择标记转OsSSSⅡ-2基因RNA干扰结构水稻的品质分析及其分子特性研究[D]. 扬州:扬州大学,2018:24-25.
[58]Chen H,Chen D,He L,et al. Correlation of taste values with chemical compositions and Rapid Visco Analyser profiles of 36 indica rice (Oryza sativa L.) varieties[J]. Food Chem,2021,349:129-176.
[59]陳培峰,王建平,乔中英,等. 糯稻wx基因的遗传分析[J]. 江西农业学报,2013,25(7):7-9.
[60]Fu F F,Xue H W. Coexpression analysis identifies rice starch regulator1,a rice AP2/EREBP family transcription factor,as a novel rice starch biosynthesis regulator[J]. Plant Physiology,2010,154(2):927-938.
[61]Wang J C,Xu H,Ying Z,et al. OsbZIP58,a basic leucine zipper transcription factor,regulates starch biosynthesis in rice endosperm[J]. Journal of Experimental Botany,2013,(11):3453-3466.
[62]Hirano H Y,Eiguchi M,Sano Y. A single base change altered the regulation of the Waxy gene at the posttranscriptional level during the domestication of rice[J]. Molecular Biology & Evolution,1998,15(8):978-987.
[63]Wanchana S,Toojinda T,Tragoonrung S,et al. Duplicated coding sequence in the waxy allele of tropical glutinous rice (Oryza sativa L.)[J]. Plant Science,2003,165(6):1193-1199.
[64]Zhang C Q,Zhu J H,Chen S J,et al. Wxlv,the ancestral allele of rice Waxy gene[J]. Molecular Plant,2019,12(8):1157-1166.
[65]周 鑫,邓 丽,汪 庆,等. 利用基因编辑技术培育糯性水稻[J]. 分子植物育种,2018,16(17):5608-5615.
[66]沈明晨,薛 超,乔中英,等. CRISPR/Cas9系统在水稻中的发展和利用[J]. 江苏农业科学,2019,47(10):5-10.
[67]Yang J,Wang J,Fan F J,et al. Development of AS-PCR marker based on a key mutation confirmed by resequencing of Wx-mp in Milky Princess and its application injaponicasoft rice (Oryza sativa L.) breeding[J]. Plant Breeding,2013,132(6):595-603.
[68]Hiroyuki S,Yasuhiro S,Makoto S,et al. Molecular characterization of Wx-mq,a novel mutant gene for low-amylose content in endosperm of rice (Oryza sativa L.)[J]. Breeding Science,2002,52(2):131-135.
[69]陈智慧,王芳权,许 扬,等. 软米基因Wxmp在部分粳稻品种资源中的分布[J]. 植物遗传资源学报,2019,20(4):975-981.
[70]陈 定,王 曦. 水稻软米与香米的遗传基因与调控[J]. 农业工程技术,2016,36(35):25-25.
[71]李铮友. 滇型软米杂交籼稻的选育进展[J]. 杂交水稻,2001(5):16-16.
[72]Huang L,Li Q,Zhang C,et al. Creating novel Wx alleles with fine-tuned amylose levels and improved grain quality in rice by promoter editing using CRISPR/Cas9 system[J]. Plant Biotechnology Journal,2020,18(11):2164-2166.
[73]唐秀英,龙起樟,王会民,等. 一种利用CRISPR/Cas9系统敲除BADH2基因创制香稻的方法:CN108913714A[P].
[74]徐善斌,郑洪亮,刘利锋,等. 利用CRISPR/Cas9技术高效创制长粒香型水稻[J]. 中国水稻科学,2020,34(5):26-32.
