体外扩增人CD34+造血干/ 前体细胞培养方法的研究
2021-09-11谢钰珍焦天赐
吴 凡 谢钰珍 封 怡 焦天赐
(苏州工业园区服务外包职业学院,江苏 苏州 215123)
造血干细胞(HSC)是具有永生能力和自我更新能力的一种血细胞,主要包括髓样、红系和淋巴细胞的祖细胞。其生物学功能广泛,具体表现在临床方面,对于HSC 的研究涉及细胞治疗、基因治疗、肿瘤治疗、血液病和遗传病等多个方面。如今HSC 的主要来源,是动员的外周血、骨髓、胎盘和脐带血。由于这些供体中可使用的HSC 数量有限,较为珍贵,因此迫切需要使用体外扩增技术以获得大量可移植的HSC 来满足临床上的需求。
体外扩增研究大多数都集中在内因或者是环境诱导介导的HSC 的更新和存活过程,通过与永生化基质细胞、骨髓间充质基质细胞或过度表达自我更新基因共同实现了合理化干细胞扩增。但是,这些方法面临对基质环境的操作或者对造血干细胞基因组的扰动等因素的干扰,且增加了一些如患癌等意外风险,同时离体培养HSC 成本较高,这些因素阻碍了HSC 的工业化培养和临床使用。本文研究目的在于建立一种简单有效、能够降低受体患病风险、且能够降低成本的细胞体外扩增方法,来满足临床对于造血干细胞的需求。
1 材料与方法
1.1 实验材料
由苏州大学附属医院提供的外周血,血样样本要求:健康供体、无其他疾病。抽取后血液在4℃保存并运输到实验室。之后操作均在生物安全柜中进行。
1.2 实验方法
1.2.1 外周血细胞分选
1.2.1.1 在50mL 的离心管1 中加入2mL 富集后的新鲜外周血,再加入含有2.5%胎牛血清的PBS(以下简称F-PBS)补足30mL;另取一支50mL 的离心管2,加入15mL 的Ficoll 液体,将在离心管1 中稀释的外周血全部缓慢加入到离心管2 中,加入过程中离心管倾斜放置。将离心管2 垂直放入离心机,升速调至6、降速调至5,常温下1900 rpm 离心12 min,离心结束后管内溶液分为上中下三层。用移液枪缓慢吸取中间的白膜层,转移到新的50mL 离心管,加入F-PBS 补齐至30mL,再次离心,4℃、1900 rpm 离心5min,结束后弃去上清;再次加入F-PBS 至30mL,4℃、1900 rpm 离心5min 后弃去上清。在管中加入500 μL 的F-PBS 重悬细胞,进行细胞计数。
1.2.1.2 在上述得到的细胞悬液中加入2g CD34+磁珠及FCR Blocking,用枪头轻轻吹打细胞,充分混匀,注意避免产生气泡。将混合液置于4℃冰箱避光孵育30min,孵育结束后加入30mL 的F-PBS,在4℃条件下1900rpm 离心5 分钟,去除未与细胞结合的磁珠。管中加入500μL 的分选buffer 进行重悬后,将溶液置于已消毒、润洗的分选磁柱中进行分离,结束后再加入3 mL 分选buffer 进行冲洗,重复三次。将分选磁柱内芯从磁架上取下,放入15mL 离心管中,重新加入6mL 分选buffer,用推子快速推动,使细胞全部落入离心管中。得到的细胞悬液在4℃、1900rpm 离心5 分钟,弃去上清,使用1mL 培养液重悬,台盼蓝染色计数。
1.2.2 造血干细胞培养过程中添加细胞因子
1.2.2.1 MS5 细胞经复苏传代后,加入D2.5(DMEM+2.5%FBS)洗涤,4℃下1900rpm 离心5 分钟,去除上清后用1mL 的D10(10%FBS+DMEM)重悬细胞,计数后,取3×106的细胞加入新的15mL 离心管,加入培养基将容积补满1mL,再加入1mL 浓度为10ng/mL 的丝裂霉素C,37℃孵育3 小时,结束后用15mLPBS 溶液清洗并离心两次。重悬细胞后调整细胞密度至0.25M。
1.2.2.2 在96 孔板中,每个孔里加入100μL 的细胞悬浮液,过夜培养,去除上清后按表1 设置三个培养组,每组3 个复孔,各组添加不同细胞因子,细胞培养到第七天进行细胞计数观察。

表1 各组添加的细胞因子组合表
1.2.2.3 细胞培养第七天,加入PE 对CD34+细胞进行染色,对CD38+细胞使用APC 染色,4℃避光孵育半小时,放入流式细胞仪检测。
1.2.3 优化细胞因子浓度
根据1.2.2 结果,选择组合结果佳的一组,调整细胞因子浓度(表2),培养七天后,加入PE 对CD34+细胞进行染色,对CD38+细胞使用APC 染色,4℃避光孵育半小时,放入流式细胞仪检测。同时使用台盼蓝对造血干细胞增殖总数及CD34+细胞进行计数,并计算扩增倍数。

表2 细胞因子浓度组合
根据细胞增殖记录、扩增倍数以及CD34+造血干细胞的纯度,筛选最佳的细胞因子浓度组合。
1.2.4 观察Feeder cell 对培养体系的影响
在1.2.3 基础上,设置添加Feeder cell 的实验组(F)和不添加对照组(G),培养造血干细胞,七天后检测细胞增殖记录、扩增倍数以及CD34+造血干细胞的纯度,研究Feeder cell 对培养结果的影响。
2 结果与分析
2.1 分组添加细胞因子后结果
各组如表1 添加细胞因子组合后,细胞培养7 天,计数结果及细胞扩增倍数来看,C 组细胞扩增七天后达到2.29M,共扩增76.5 倍,细胞总数和扩增倍数明显高于其他两组。
据图1、图2 分析可得,C 组造血干细胞中CD34+比例最高,可达到62.1%,且CD38+比例最低,仅为4.66%,CD34+细胞量最多,且CD34+细胞扩增倍数最大;B 组造血干细胞中CD34+比例略低,为53.4%,而CD38+比例较高,为5.5%,且CD34+细胞量及扩增倍数均低于C;A 组造血干细胞中CD34+比例最低,仅为37.3%,CD38+比例最高,为8.81%,CD34+细胞量及扩增倍数为三组最低,由于本实验为CD34+造血干细胞培养体系,而CD38+为定向祖细胞,并非目标细胞群体,因此根据细胞扩增及流式染色结果可以看出,C 组为培养造血干细胞最适细胞因子组合,即FLT3L 50ng/ML,SCF 30 ng/ML,IL-3 10 ng/ML,IL-6 15ng/ML。
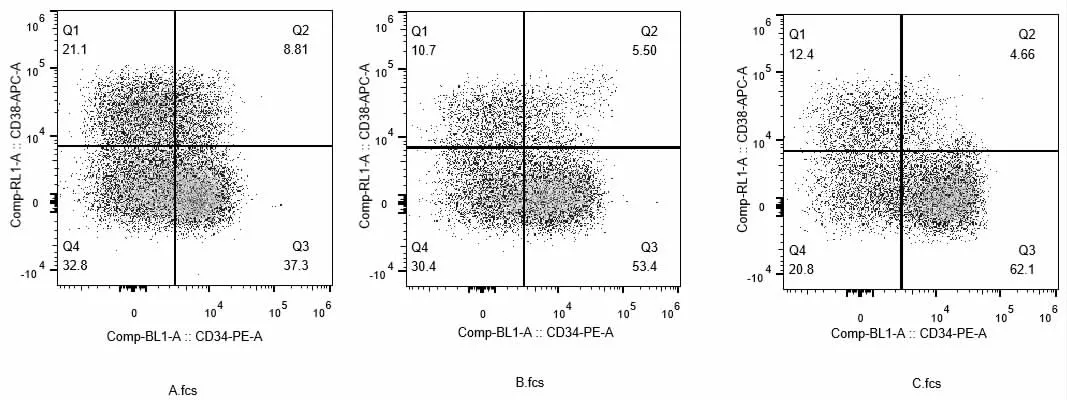
图1 三组细胞培养后CD34+细胞流式染色图(四象限:Q1 为CD38+阳性与CD34+阴性,Q2 为CD38+阳性与CD34+阳性,Q3 为CD38+阴性和CD34+阳性,Q4 为CD38+阴性和CD34+阴性)

图2 培养后第七天各组CD34+细胞计数(A)与扩增倍数(B)统计
2.2 细胞因子浓度优化后结果
三组细胞在不同细胞因子浓度条件下(表2),培养七天后,F 组细胞量达到2.45M,7 天共扩增81.7 倍,是三组中细胞量及扩增倍数最高的一组。
流式染色显示,调整造血干细胞培养体系中的细胞因子浓度,F 组造血干细胞中CD34+比例最高,可达到83.1%,且CD38+比例最低,仅为4.98 %,CD34+细胞量最多,且CD34+细胞扩增倍数最大;E 组造血干细胞中CD34+比例略低,为78.3%,CD38+比例较高,为5.09%,且CD34+细胞量及扩增倍数均低于F;D 组造血干细胞中CD34+比例最低,仅为63.1%,CD38+比例最高,为5.19%,且CD34+细胞量及扩增倍数为三组最低(图3、图4)。由于本实验为CD34 造血干细胞培养体系,而CD38+为定向祖细胞,并非目标细胞群体,因此根据细胞扩增及流式染色结果可以看出,在含有MS5 feeder cell的情况下,F 组中的细胞因组合是培养造血干细胞最适细胞因子 组 合, 分 别 为 FLT3L 100ng/ML,SCF 30 ng/ML,IL-3 10ng/ML,15ng/ML。
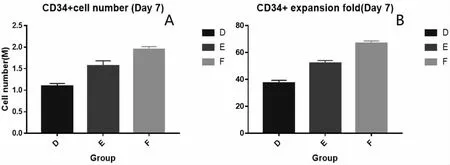
图3 改变细胞因子浓度后各组细胞计数(A)及扩增倍数(B)统计图
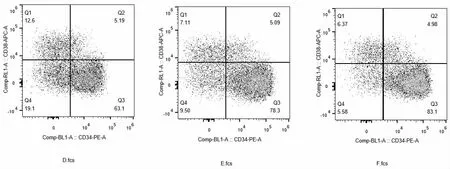
图4 改变细胞因子浓度后三组细胞CD34+流式染色结果
2.3 feeder cell 对造血干细胞培养体系的影响
F 组添加feeder cell 培养七天后,总细胞量达到2.56M,扩增倍数85 倍,较未添加feeder cell的G 组细胞量和扩增倍数明显增高。两组细胞进行流式染色后,图6 结果显示,F 组造血干细胞中CD34+比例最高,可达到85.7%,且CD38+比例最低,仅为3.76 %,CD34+细胞量最多,且CD34+细胞扩增倍数最大;G 组造血干细胞中CD34+比例低,为46%,CD38+比例较高,为6.29%,且CD34+细胞量及扩增倍数均低于F 组;因此根据细胞扩增及流式染色结果可以看出,在培养造血干细胞过程中,添加feeder cell 有利于细胞生长。
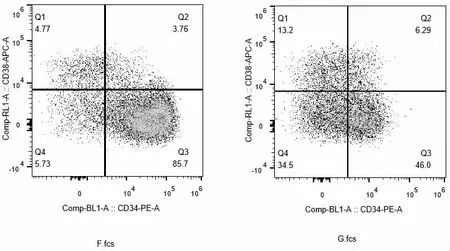
图5 改变feeder cell 添加条件后两组细胞CD34+流式染色结果
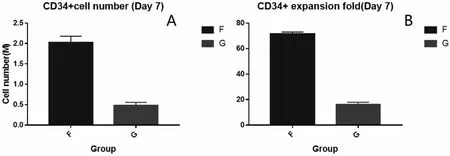
图6 改变feeder cell 添加条件后两组CD34+细胞计数(A)与扩增倍数(B)统计
3 结论与讨论
本实验研究的人CD34+细胞在科研研究过程中需求量大,一直处于供应相对紧张的状态,而细胞获取途径有限,因此建立合适的体外扩增培养体系是非常必要的。本次实验通过调整培养基中的细胞因子组合、浓度以及有无基质细胞三方面来优化CD34+造血干/前体细胞的体外扩增条件。经实验确定,在使用细胞因子及浓度分别为FLT3L 100ng/mL、SCF 30ng/mL、IL-3 20ng/mL、IL-6 15ng/mL 的条件下,添加基质细胞feeder cell 可作为人CD34+HSPC 的最佳体外扩增方案。
CD34+在临床实验研究和应用方面发挥着举足轻重的作用,在多种疾病的治疗研究方案中都有采用。但CD34+HSPC 多数存在于脐带血、动员的外周血和胎盘、骨髓中,来源或多或少存在一些缺陷,无法保证来源稳定可靠,且移植较为困难,对成人患者、造血干细胞需求量大的患者较难满足治疗需要。本实验研究结果对CD34+HSPC 在体外高效扩增提供了一个可行性较高的方案,待成熟完善后,可以实现体外大量且无毒副作用的细胞扩增,能够解决部分血液病或者遗传病的治疗问题,造福人类。
