拟南芥细胞色素P450 707A3电化学传感检测脱落酸
2021-09-11吴云华
王 政, 姜 楠, 吴云华*
(中南民族大学生命科学学院,湖北武汉 430074)
脱落酸(Abscisic Acid,ABA)是一种重要的植物信号分子,能调控很多植物生理过程,包括种子萌发、根系发育、叶片生长、细胞的程序性死亡等生理进程以及植物对逆境胁迫的应答[1]。ABA在植物体内的重要作用使其成为植物学领域研究热点。因此,建立ABA的快速灵敏、高效准确检测方法,研究植物体内ABA浓度的变化,对解析ABA的信号传导机制具有重要意义[2]。当前ABA常用的检测方法有免疫法和色-质联用法。其中,免疫法主要有ELISA法[3]和电化学免疫传感器法[4]。免疫法灵敏度较高,但抗体制备纯化较为困难,而且很难排除ABA前体物、结构类似物引起的交叉反应。色-质联用法因其高选择性及高灵敏成为当前被广泛采用的检测方法[5]。但是在色-质联用测定过程中都必须先分离提取植物组织的ABA,再定量检测,费时费力,而且需要大型的仪器设备。电化学传感器法具有仪器价格低廉、操作方便、检测快速等优点,但是存在选择性差的问题。酶电极利用酶的专一性,可以提高检测的专一性,因而受到了广泛关注,有望实现植物激素ABA的高特异性和高灵敏检测[6]。
拟南芥细胞色素CYP 707A3是高等植物体内ABA羟基化失活途径的关键酶,催化ABA生成活性较低的红花菜豆酸,该酶促反应特异性高[7]。本实验利用细胞色素CYP 707A3对ABA的特异催化作用,结合电化学传感技术,制备了用于检测ABA的生物传感器。采用表面活性剂双十六烷基磷酸(DHP),制备类生物膜结构,固定CYP 707A3于热裂解石墨电极表面,研究了CYP 707A3的电子传递行为,以及其对ABA的电化学催化过程,实现了ABA的特异检测。
1 实验部分
1.1 仪器及试剂
电化学工作站(上海辰华仪器公司,CHI660C);标准三电极体系:CYP 707A3/DHP修饰的热解石墨电极(PGE)为工作电极,甘汞电极(SCE)为参比电极,铂电极为对电极。
CYP 707A3膜蛋白的表达纯化参照文献报道[8],浓度按照文献方法[9]测定为16.3 μmol/L。双十六烷基磷酸(DHP)(Fluka);脱落酸(ABA)、生长素、细胞分裂素、油菜素内酯(Sigma);其他常用实验试剂均购自国药集团有限公司。水为二次蒸馏水。
1.2 实验方法
1.2.1 DHP膜及DHP-707A3修饰PGE的制备将PGE(直径3 mm)于抛光布上用Al2O3粉末(粒径为0.05 μm)充分抛光后,置于30%HNO3中超声清洗1次,无水乙醇中超声波清洗1次,二次蒸馏水中超声清洗2次,每次1 min,室温晾干。取10 μL CYP 707A3膜蛋白混悬液(pH=7.0的PBS混悬),与10 μL 1 mg·mL-1DHP溶液混合均匀,用移液器吸取10 μL混合溶液于电极表面,4 ℃冰箱过夜干燥,得到CYP 707A3-DHP/PGE。以固定10 μL 1 mg·mL-1DHP溶液的DHP/PGE作为对照。
1.2.2 CYP 707A3 -DHP修饰PGE检测ABA检测池中加入5 mL 0.1 mol·L-1PBS,将三支电极置于检测池中,不断加入ABA溶液,磁力搅拌混合均匀后,进行循环伏安(CV)扫描,扫速为0.5 V·s-1。
1.2.3 CYP 707A3-DHP修饰PGE选择性将修饰电极放入装有5 mL 0.1 mol·L-1PBS的检测池中,分别加入与ABA等浓度的反式玉米素(细胞分裂素)、生长素和油菜素内酯。采用CV法进行电化学检测,扫速为0.5 V·s-1。重复实验3次,取其平均值。
2 结果与讨论
2.1 CYP 707A3的直接电化学行为研究
图1为DHP/PGE和CYP 707A3-DHP/PGE在通氮除氧20 min的PBS中的CV图,扫速为0.5 V·s-1。未固定蛋白的PGE未观察到氧化还原峰(曲线a);而固定有CYP 707A3的PGE有一对氧化还原峰(曲线b),其氧化还原峰电位分别为-0.58 V和-0.50 V。上述结果表明,DHP固定在PGE表面不具有电化学信号,而CYP 707A3包埋在DHP膜内,实现了直接电化学。

图1 无氧条件下0.1 mol·L-1PBS(pH=7.0)中DHP/PGE(a)和CYP 707A3-DHP/PGE(b)的循环伏安(CV)图Fig.1 CVs of DHP/PGE(a) CYP 707A3-DHP(b) in 0.1 mol·L-1 oxygen-free PBS(pH=7.0)Scan rate:0.5 V·s-1.
将CYP 707A3-DHP置于pH=7.0的PBS中,在 0.1~1 V·s-1范围内改变扫速,考察扫速对电化学行为的影响(图2)。其氧化还原峰峰电位基本不变,氧化还原峰峰电流随扫速的增加而增大,且与扫速呈良好的线性关系。表明CYP 707A3的电极反应由吸附控制[10]。

图2 (A)无氧条件下CYP 707A3-DHP/PGE在不同扫速下的CV图;(B)CYP 707A3氧化还原峰电流与扫速关系Fig.2 (A)CVs of CYP 707A3-DHP/PGE in PBS(pH=7.0 ) at the scan rate from 0.1 to 1.0 V·s-1;(B) The plot of cathodic and anodic peak currents vs the scan rate
根据公式:Г=Q/nFA,对CV图的还原峰面积进行积分,可求得CYP 707A3在电极表面的电活性物质的量。此处,Г为电极表面的电活性物质的量;Q为涉及还原反应的电量;n为涉及电极反应的电子传递数目;F为法拉第常数;A为电极的面积,使用[Fe(CN)6]3-/4-可逆氧化还原电对求得为1.05 cm2。其电极表面的电活性物质的量为3.46×10-12mol·cm-2。实验测得的数据是固定在电极表面DHP膜内的蛋白质总量的5%左右,说明在DHP膜内一些蛋白质没有参与电极反应。
根据Laviron理论[11],对于无扩散控制的CV图,当nΔEp<200 mV(这里n为涉及电极反应的电子传递数目,ΔEp为氧化还原峰的电位差),其电子传递速率ks由下式求得:ks=nFv/(RTm-1)。一般认为每一个血红素基团参与电极反应只涉及一个电子,因此可认为CYP 707A3的n值为1,根据文献报道[11]查得其m值为2.9。由此求得DHP膜内CYP 707A的电子传递速率ks=57±3 s-1,稍低于固定于黏土中的cytochrome P450 2B4的电子传递速率(ks=80 s-1[12])。
2.2 CYP 707A3-DHP/PGE电化学检测ABA
将CYP 707A3-DHP/PGE放入pH=7.0的PBS中时,出现CYP 707A3的一对血红素Fe(Ⅲ/Ⅱ)的氧化还原峰(图3)。在有氧条件下,向电解池中不断加入ABA溶液后,在-0.55 V 处还原峰电流不断增加,同时伴随着Fe(Ⅱ)的氧化峰电流的逐渐减小,而DHP/PGE无此现象。这些结果表明,图3中的还原峰是CYP 707A3在有氧条件下催化氧化ABA引起的。
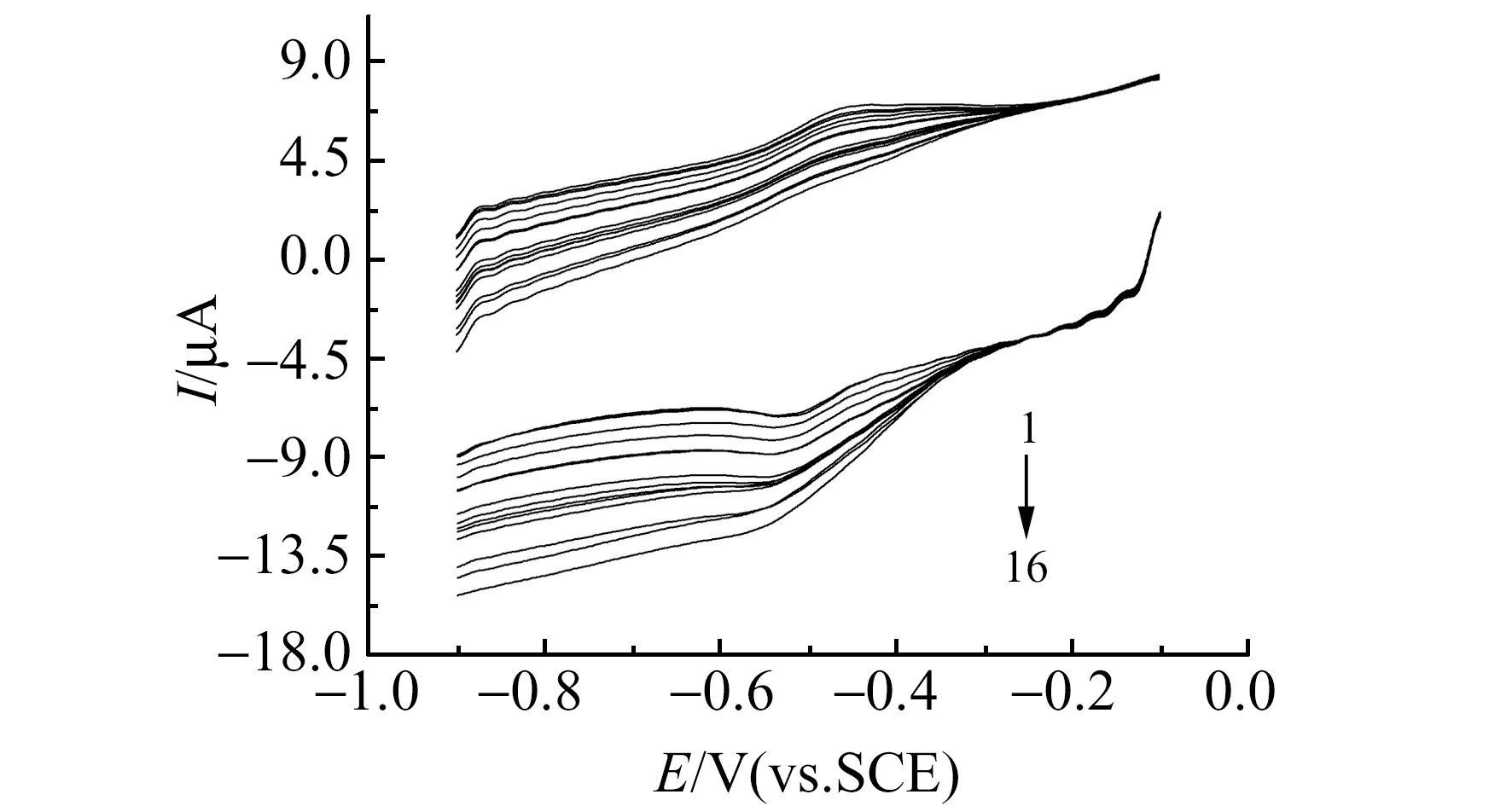
图3 CYP 707A3-DHP/PGE在不同浓度ABA的pH=7.0 PBS中的CVFig.3 CVs of CYP 707A3-DHP/PGE in PBS (pH=7.0) with different concentration of ABA1-16:0,5,10,15,20,25,30,40,50,60,70,80,90,100,150,200 nmoL·L-1,respectively.
图4为ABA浓度与相应的CYP 707A3-DHP/PGE催化还原峰电流变化值的关系图。可以观察到,当ABA的浓度高于70 nmol·L-1时,还原峰电流的变化与ABA浓度的关系趋于平稳状态,符合Michaelis-Menten动力学机制的典型特征。从Lineweaver-Burk方程的电化学形式获得表观的Michaelis-Menten常数Kmapp,该常数成为酶对其底物亲和力的量度。根据Lineweaver-Burk方程:1/Iss=1/Imax+Kmapp/Imaxc。其中Iss是添加ABA后的稳态电流,Imax是在饱和ABA浓度条件下测得的最大电流,c是测定中ABA的浓度。将相应数值代入上述方程,计算得到CYP 707A3-DHP/PGE的Kmapp值为77.075 nmol·L-1,低于溶液中CYP 707A3催化ABA的Km值(1.3 μmol·L-1[7])。表明固定于DHP膜内的CYP 707A3与ABA的亲和性高。由图4的内插图可知:ABA的浓度在5~70 nmol·L-1范围内,CYP 707A3-DHP/PGE的还原峰电流改变值与ABA的浓度呈线性关系,线性回归方程为:y=-0.3056+0.0799x,相关系数R2=0.991,检测限为0.16 nmol·L-1。

图4 CYP 707A3-DHP/PGE还原峰电流差值与不同浓度ABA关系(内插图:CYP 707A3-DHP/PGE还原峰电流差值与不同浓度ABA的线性关系)Fig.4 The relationship between the change of the reductive peak current of CYP 707A3-DHP/PGE and the concentration of ABA(The inset:the linear relationship between the change of the reductive peak of CYP 707A3-DHP/PGE and the concentration of ABA)
2.3 CYP 707A3-DHP/PGE的选择性
在检测池中加入与ABA相同浓度的油菜素内酯(BR)、异戊烯基腺嘌呤(CK)和生长素(IAA),进行CV法检测,3次重复实验,选取ABA、BR、CK和IAA的50、100、150、200 nmol·L-14个浓度下,作还原峰电流差值图与植物激素浓度关系对比图,如图5所示。当浓度为50 nmol·L-1时,ABA对应的峰电流差值明显高于另外3种激素,且随着浓度增加有明显增大趋势而CYP 707A3-DHP/PGE对另外3种激素信号响应很小。说明了ABA与CYP 707A3的识别和结合具有高度亲和力和特异性,而对常见植物激素如生长素、细胞分裂素和油菜素内酯,CYP 707A3-DHP/PGE不具有电化学催化作用,表明CYP 707A3-DHP/PGE的选择性良好。

图5 CYP 707A3 -DHP/PGE的选择性Fig.5 Selectivity of CYP 707A3-DHP/PGE
2.4 CYP 707A3-DHP/PGE的稳定性及重现性
将CYP 707A3-DHP/PGE于4 ℃保存,每天检测其电流响应,15 d后,CYP 707A3-DHP/PGE的氧化峰电流保持原来的85%,CYP 707A3-DHP/PGE的还原峰电流保持原来的80%,该ABA传感器良好的稳定性。对50 nmol·L-1的ABA在CYP 707A3-DHP/PGE上的响应进行7次重复测定,其相对标准偏差为5.6%,表明传感器的精确度较高。同一支电极重复修饰CYP 707A3-DHP混合膜7次,分别检测50 nmol·L-1的ABA,相对标准偏差为8.6%,显示CYP 707A3-DHP传感器具有较好的重现性。
3 结论
原核表达纯化的细胞色素P450 707A3(CYP 707A3),采用表面活性剂DHP固定于热裂解石墨电极表面,固定在DHP膜内的CYP 707A3能够实现直接电化学,在pH=7.0的PBS中,扫速为0.5 V·s-1时其氧化还原峰电位分别为-0.58 V和-0.50 V,电子传递速率ks=57±3 s-1。在有氧条件下CYP 707A3对ABA氧化催化,其还原峰电流的变化值与ABA浓度在5~70 nmol·L-1范围内呈线性关系,可用于ABA的检测。激素干扰实验证明了CYP 707A3电化学催化检测ABA具有高的特异性,而且此修饰电极具有较好的稳定性和重现性。
