药品接触材料相容性研究方案设计思路
2021-09-10程莹灿
摘要:药品包装系统、生产工艺组件、一次性使用系统、给药器具总称为药品接触材料,药品接触材料与药品的相容性研究是评估药品安全风险的重要研究,目前国内外均有相关的指导原则,尽管指导原则已相对全面,但是指导原则给出的都是框架性的思路,针对不同药品接触材料相容性研究方案的设计思路及设计细节并没有明确提出。固国内的研发企业或研究机构在方案设计中,经常忽略一些潜在的风险,尤其一些至关重要的细节,导致不能可靠的评估药品接触材料的风险。本文参考国内外相关专著和国外研究文献,结合实际项目经验,对不同药品接触材料在相容性研究的研究思路、方案设计、分析方法等方面进行阐述,并列举常见的容易被忽略、且存在潜在风险的细节点。
关键词:包材相容性研究 可提取物研究 生產工艺组件相容性研究 给药器相容性研究
Abstract:E&L study of Pharmaceutical packaging/delivery systems and Plastic components is a critical dimension to assess potential safety risk for drug product , but principle presents general information and framework and does not describe the details of extraction conditions, analytical procedures or acceptance criteria.In order to assess the risks and manage the potential issues posed by extractable and leachable, it is necessary to design a suitable protocol which can evaluate and manage risk during the drug development and manufacturing processes.This paper describe critical details of E&L study protocol and list common analytical procedure, results assessment.
Key words:Extractable Study and Leachable Study, Packaging, Delivery systems Compatibility
药品接触材料是药品包装系统、生产工艺组件、一次性使用系统、给药器具的总称,其不但要满足功能性的要求,还应与药品有良好的相容性,即不引入有风险的化合物又不会对药品产生吸附,不影响药品的质量、疗效和安全性。药品接触材料的相容性研究贯穿于药品的整个生命周期,是药品申报中一项非常重要的研究,国内外均发布了相关指导原则,如2006年美国产品质量研究学会(PQRI)提出的经口吸入和鼻用制剂(OINDP)可提取物研究和浸出物研究的最佳实践进展,国家药品监督管理局2012年起先后发布的《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》、《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》、《化学药品与弹性体密封件相容性研究技术指导原则(试行)》,人用药品注射技术要求国际协调会(ICH)发布的一系列指导原则,美国药典发布的一系列相关章节等。相容性研究内容包含可提取物研究、浸出物研究、吸附研究。合理的相容性研究方案,可以考察并控制药品接触材料的风险,保证药品在生产、存储、临床使用时的质量和疗效。设计既能满足要求又不过度研究的相容性方案,首先要收集信息,依据收集的信息确定研究内容和研究思路,设定合理的分析评价阈值,选择合适的提取溶剂,建立适合的分析方法,最终对药品接触材料进行评价。
1信息收集
信息收集对设计合理的相容性研究方案至关重要,需要收集的信息至少包含但不限于以下内容:
l药品包装系统的类型、供应商、常见的添加剂及其CAS号、常见降解产物及其CAS号、基本的工艺流程。比如胶塞的常见类型有聚异戊二烯橡胶类、丁基/卤化丁基橡胶类、硅橡胶类、乙丙橡胶类、丁腈橡胶类等,胶塞常用到硫化剂、老化剂、爽滑剂、着色剂、抗氧剂等,胶塞生产常见流程有原材料混炼工序、硫化工序、清洗工序、硅化处理等。
l药品信息及其临床使用信息,如药品的性状、规格、临床给药途径、药品的配方、pH范围、药品的治疗周期和临床使用最大用量、药品生产过程中的灭菌方式、药品比较敏感的金属离子或有机化合、药品的存贮条件和有效期等。
l生产工艺组件或一次性给药系统的类型、供应商、常见的添加剂及其CAS号、常见降解产物及其CAS号、在实际生产工艺中的实际使用温度,接触工艺流体的时间,实际使用的数量-如总内表面积、工艺流体的配方、工艺流体的pH值范围、工艺流体与最终制剂药品的换算关系等。
l给药器的材料、供应商、常见的添加剂及其CAS号、常见降解产物及其CAS号、临床使用方法、数量、可能接触到的药品配伍信息等。
2确定项目的研究内容
依据已收集的项目信息、材料信息、药品信息和国内外相关指导原则项目进行评估和确定可提取物研究内容。
2.1药品包装系统
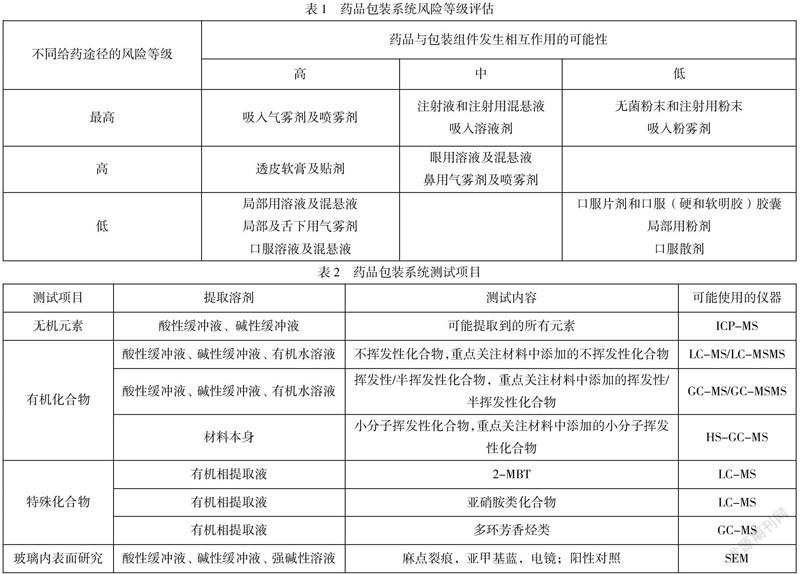
参考表1,依据不同的给药途径和包材信息,确认待考察的药品包装系统是否需进行相容性研究。低风险的口服片剂等不需要进行相容性研究,而中高风险给药的包装系统,均需考察相容性研究。参考表2,按照药品包材系统的材质确认需考察的测试项目,如玻璃安瓿瓶需要考察无机元素和玻璃内表面研究;而塑料安瓿瓶则需考察无机元素、有机化合物;含弹性体的药品包装系统除了需要考察有机化合物、无机化合物,还需重点关注特殊化合物研究。值得注意的是,塑料瓶或塑料软袋属于半透性材料,考察这类药品包装系统时也需要关注次级包装,如油墨印字或标签,这一点很关键且在相容性研究方案容易忽略,应在可提取物研究的包装材料和浸出物稳定性放置用到的包装材料均要考虑次级包装。
2.2生产工艺组件
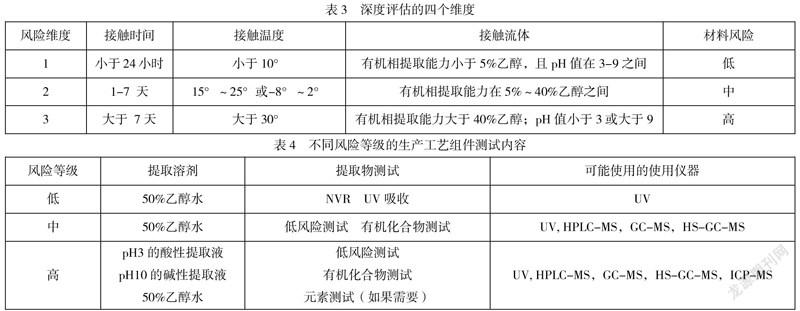
生产工艺组件基本的评估思路分为2个步骤,首先依据USP 665进行初步评估,然后依据USP 1665进行深入评估,通过表3的4个维度打分并评估出组件的风险等级,结合临床实际使用情况评估消除因子,从而得到组件的最终风险等级。如果生产工艺组件存在于生产线上且接触液体型工艺流体,那么直接进入深度评估,深度评估即通过组件与药液的接触时间、接触温度、药液的提取能力、组件材料风险等四个维度进行打分,然后通过打分结果进行关联,最后结合临床实际使用情况,评估消除因子,确认是否需要调整组件的风险等级。按照表4,不同风险等级的组件进行相关测试考察。另外,针对国内外指导原则均未提到的不锈钢组件、玻璃组件等,可考察元素以证明其安全性。
2.3给药器具
给药器接触的药品会直接进入人体,其相容性研究尤为重要。常用的给药器具有输液器、注射器、雾化器等。市面上给药器材质、厂家种类众多,以输液器举例,常见的材质有PVC材质输液器、低密度聚乙烯材质输液器、TPE材质输液器等。若药品说明书无特殊要求,则建议选择2-3种不同材质的给药器进行研究,且至少含1种比较严苛的、医院中最常使用的PVC材质。依据不同材质的给药器,其考察内容可参考表2。目前国内外没有相关指导原则对其进行安全评估,若需评估则可参考一次性使用系统,用USP665和USP 1665对其评估,大部分给药器属于中风险或高风险。
3可提取物研究
可提取物研究是通过采用合适的提取溶剂和提取条件对药品接触材料进行提取,对可提取物进行分析以评估可能的浸出物。参考指导原则,综合考虑包装容器组成材料的性质、药品的性质(如pH、极性等)等因素,并适当加严加剧,以模拟产品在实际生产、使用和运输过程中可能遇到的极端条件。可提取物研究方案主要含提取溶剂、提取过程、分析评价阈值(AET)、提取液测试。
3.1提取溶剂
选择提取溶剂的依据是,提取溶剂要在pH值、离子强度、极性等方面严苛与药液本身,要从多角度选择提取能力严苛于药液的溶剂,针对提取能力较强的辅料,不能单一的按照有机溶剂的百分比去证明提取能力,这是相容性研究方案中很容易忽略的风险点,会使可提取物研究不够充分且无法评估到所有的潜在化合物。如多西他赛注射液配方中吐温80的比例约50%,这种情况下用无水乙醇作为提取溶剂的话是完全没有代表性的,原因是无水乙醇的提取能力弱于80%的吐温80,一般情况下若配方中吐温80含量为0.5%,需要至少用40%的无水乙醇模拟其提取能力。USP665中提出了针对生产工艺组件的标准化提取溶剂,即pH3磷酸盐溶液、pH10磷酸盐溶液、50%乙醇溶液,但这并不代表任何项目都用标准化提取的3种提取溶剂,当标准化提取溶剂的提取能力不满足产品要求时,需要增加或调整提取溶剂。给药器的提取溶剂是参考配伍后的药液的pH值、离子强度、极性等进行选择。
3.2提取过程
药品包装系统的提取过程,要综合考虑到使用、运输、存储中可能遇到的极端条件,并适当加严,可以选择将提取溶剂加入药品包装系统的方式进行提取,也可以选择用提取溶剂浸泡药品包装系统的方式进行提取。生产工艺组件则要在温度、接触时间等方面严苛于实际生产过程,BPOG中提出至少严苛10%的理念,如某过滤器实际使用时与工艺流体在30℃条件下最长接触10小时,那么可提取物研究至少要高于33℃且超过11小时。生产工艺组件一般建议动态提取,如采用蠕动泵串联组件进行提取或置于生物摇床中震摇提取。给药器具一般建议严苛于临床使用的条件进行提取,比如某输液器30℃滴注最长3小时,那么可提取物研究至少要高于33℃且超过3.3小时,提取方式一般建议采用模拟临床滴注的方式。
3.3分析评价阈值(AET)
AET为一个阈值,当某个化合物的浓度超过该阈值时,化学家应对该化合物进行鉴定、定量和报告。当某个浸出物的浓度低于该阈值时,则认为化合物的含量非常低,不会对人体产生危害。参考美国产品质量研究所(Product Quality Research Institute, PQRI)、肠外及眼用药物(Parenteral and Ophthalmic Drµg Product, PODP)工作组推荐的安全评估阈值(SCT)1.5 µg/day。国际气雾剂联盟(IPAC)推荐的吸入制剂安全评估阈值(SCT)为0.15 µg/day。依据美国产品质量研究所(Product Quality Research Institute, PQRI)指导原则,分析评价阈值(AET)是根据合适的安全评估阈值(SCT)或者毒理关注阈值(TTC)等并结合产品的给药方式、给药方案、治疗周期等转换而来。比如某注射剂品种,每日最大用量为1瓶,GC-MS分析方法的不确定度为50%,则该品种的AET为1.5μg/天÷1瓶/天×(1-50%)=0.75μg/瓶。值得注意的是,可提取物研究時可能会出现未知的不确定风险等级的化合物,则其AET的计算不可以采用毒理关注阈值(TTC)进行换算,而评估大于AET的化合物风险时,在适用的情况下可以使用毒理关注阈值(TTC),这也是相容性方案中容易出现的风险点。
3.4提取液测试
针对提取液中可能出现的各种化合物,需采用半定量扫描的方法,应用多种仪器、多种分析手段对其进行全面的考察,考察提取液中可能出现的有机化合物和无机化合物。如采用电感耦合等离子体-质谱法(ICP-MS)对提取液中的元素进行测试;采用气相色谱-质谱法(GC-MS)考察提取液中可能出现挥发性/半挥发性化合物;采用液相色谱-质谱法(LC-MSMS)对考察提取液可能出现的不挥发性化合物;采用顶空气相色谱-质谱法(HS-GCMS)对包材或组件中小分子有机物进行测试等。
3.4.1半定量扫描法
可提取物研究是发现风险的过程,为了尽可能的发现已知的和未知的所有风险,一般选择半定量扫描的方法对提取液进行测试。针对半定量扫描法,《化学药品与弹性体密封件相容性研究技术指导原则(试行)》建议要选择合适的化合物考察方法的灵敏度和系统适用性。实验室分析研究中,无机元素种类相对固定,可考察各个元素的灵敏度、系统适用性、线性等;但是对于有机化合物,不但种类多,还有可能出现未知的化合物,则一般建议选择合适的内标或有代表性的化合物来考察方法的灵敏度和系统适用性。
3.4.2考察的化合物种类
可提取物研究中待考察的化合物分为两大类,无机元素和有机化合物。无机元素一般考察包材配方中的元素、ICH Q3D和玻璃指导原则中提出的有风险的元素,种类相对固定,可以对所有元素进行全面的考察。有机化合物种类非常多,除了已知的添加剂外还有可能出现未知的化合物,大部分项目负责人都会建立一个化合物库来考察可能出现的有机化合物。值得提醒的是,化合物库忌固定化,而且并不是化合物库的列表越长考察就越全面,而是要充分依据材料的配方,分析汇总可能出现的所有的化合物,材料配方受限的情况下,也可以依据已有的经验或文献中对材料的剖析确定待考察的有机化合物库。这一点非常关键,但相容性研究方案中,经常被忽略。比如棕色输液器和透明输液器比较,棕色输液器需要在化合物库中增加可能添加的遮光剂;比如印有油墨字体的塑料软袋与无油墨字体的塑料软袋比较,印有油墨字体的塑料软袋需要在化合物库中增加油墨中可能提取到的化合物。需要重点指出的是,即便是半定量扫描法,依据材料剖析建立的化合物库要与提取液同法上机考察,否则无法证明分析方法的适用性。
4 浸出物研究
浸出物研究是为了研究包装系统、生产工艺组件、一次性使用系统、给药器具在与药品实际接触、实际使用的情况下,浸出物是否会对药物产生安全性风险。对于可提取物研究中或包材配方中的有风险的化合物,一般采用经验证后的方法进行考察;对于药品接触材料在实际使用中可能出现的新的化合物,一般采用半定量扫描法进行考察。值得提醒的是对于一些基质复杂的药品,采用半定量扫描法考察浸出物时可能会被药品本身干扰而无法准确考察,需要依据每个产品的实际情况,选择浸出物研究考察思路。浸出物试验时间点参考相容性指导原则以及药品的效期进行设定,一般情况下会包含0月,加速3月、加速6月、长期6月、长期12月、长期24月、货架期终点等。
5 吸附研究
吸附研究是对药品活性成分或功能性辅料是否会被药品接触材料吸附的相关研究,通常与稳定性试验同时进行,应同时进行平行对照,以扣除药品本身降解的影响。
6结果评估
应对所有大于AET的化合物进行鉴定、报告并评估其风险,评估风险可采用每日允许最大暴露量(PDE)法或毒理关注阈值(TTC)法。需要提醒的是,若无法查到已有的PDE数据,需要用无可见作用水平(NOEL)计算化合物的PDE值,要由有资质的毒理学家依据采用不同的修正因子进行计算,无毒理学资质的计算,则不具有参考意义。
综上所述,参考国内外相关文献和指导原则,本文汇总了相容性研究的方案思路、不同藥品接触材料的评估和研究项目,可提取物研究需关注的细节,保证相容性研究方案可以合理的考察并控制药品接触材料的风险,保证药品在生产、存储、临床使用时的质量和疗效。
参考文献
[1]《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》
[2]《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》
[3]《化学药品与弹性体密封件相容性研究技术指导原则(试行)》
[4]《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(试行)》
[5]已知可沥滤物测定方法验证及确认技术审查指导原则
[6]医疗器械未知可沥滤物评价方法建立及表征技术审查指导原则
[7]USP<1663> Assessment of Extractables Associated with Pharmaceutical Packaging/Delivery Systems.
[8]USP<1664>Assessment of Drug Product Leachables Associated with Pharmaceutical Packing Delivery Systems.
[9]USP<233> Elemental Impurities-Procedures
[10]Safety Thresholds aN.D Best Practices for Extractables aN.DLeachables In Orally Inhaled aN.D Nasal Drug Products.RecommeN.Dations submitted to the PQRI Drug Product Tecchnical Committee, PQRI Steering Committee, aN.D U.S.Food aN.D Drug Administration by the PQRI Leachables aN.D Extractables Working Group in september 2006.
[11]Guideline for Elemental Impurities, ICH Q3D Current Step 4 version
[12]Assessment aN.D control of DNA reactive (mutagenic) impurities in pharmaceuticals to limit potential carcinogenic risk, ICH M7 Current Step 4 version
[13]Jenke, D.; Castner, J.; Egert, T.; Feinberg, T.; HeN.Dricker, A.; Houston, C.; Hunt, D.G.; Lynch, M.; Shaw, A.; Nicholas, K.; Norwood, D.L.; Paskiet, D.; Ruberto, M.; Smith, E.J.; Holcomb, F., Extractables Characterization for Five Materials of Construction Representative of Packaging Systems Used for Parenteral aN.D Ophthalmic Drug Products, PDA Journal of Pharmaceutical Science aN.D Technology 2013, 67, 448.
[14]Impurities: Guideline for residual solvents Q3C (R7)
[15]Kim Li, Gary Rogers, Yasser Nashed-Samuel, et al.Creating a Holistic Extractables and Leachables (E&L) Program for Biotechnology Products, PDA Journal of Pharmaceutical Science and Technology 2015, 69, 590-619.
[16]Dennis Jenke and Tage Carlson, A Compilation of Safety Impact Information for Extractables Associated with Materials Used in Pharmaceutical Packaging, Delivery, Administration, and Manufacturing Systems.PDA Journal of Pharmaceutical Science and Tech
[17]G.M.Cramer and R.A.Ford, et al.Estimation of Toxic Hazard-A Decision Tree Approach, Fd Cosmet Toxicol.Vol.16. pp.:255-276
[18]R.Kroes, A.G.Renwick, et al.Structure-based Thresholds of Toxicological Concern(TTC): Guidance for Application to Substances Present at Low Level in the Diet
[19]USP<665>Plastic Materials,Components and Systems Used in the Manufacturing of Pharmaceutical Drug Products and Biopharmaceutical Drug Substances and Products.
[20]USP<1665>Characterization of Plastic Materials, Components and Systems Used in the Manufacturing of Pharmaceutical Drug Products and Biopharmaceutical Drug Substances and Products.
[21]Biophorum best practices guide for extractables testing of polymeric single-use components used in biopharmaceutical manufacturing
作者簡介:程莹灿 女 19860915 黑龙江省哈尔滨市 本科 无职称,预计今年申请中级职称 方向为生物医药 英格尔医药科技有限公司 邮编为201109。
(英格尔医药科技有限公司 上海 201109)
