氯化钠溶液的配制实验精讲
2021-09-10赵培龙
赵培龙
一定质量分数的氯化钠溶液的配制实验是初中非常重要的定量实验。本实验旨在引导同学们学习一定质量分数的溶液的配制方法和过程,掌握配制过程中的基本操作,提升科学素养。明确实验步骤、注意事项是正确解答此类题目的关键。
[夯实基础]
1. 实验仪器:托盘天平(含砝码)、纸片、药匙、烧杯、量筒、胶头滴管、玻璃棒、细口瓶等。
2. 实验药品:食盐、蒸馏水等。
3. 实验目的:用氯化钠固体和水配制50 g质量分数为6%的氯化钠溶液。
4. 实验步骤:
(1)计算:氯化钠的质量为50 g × 6%=3 g,水的质量为50 g - 3 g=47 g,即水的体积为47 mL。
注意事项:计算依据是溶质质量=溶液质量 × 溶质的质量分数,溶剂质量=溶液质量-溶质质量,溶剂的体积可根据密度公式进行转化。
(2)称取氯化钠:用托盘天平称量3 g氯化钠,放入烧杯中。
注意事项:称量干燥的固体前,应在两个托盘上各放一张质量相同的纸,然后把药品放在纸上称量,易潮解的药品(如氢氧化钠)必须放在玻璃器皿(如小烧杯、表面皿)里称量。称量时,应先固定右盘中砝码和游码的质量,然后再向左盘中添加固体试剂。在天平接近平衡时,一手拿药匙,另一只手轻轻拍击拿药匙的手腕,使药品少量地加入,直至天平平衡。
(3)量取水:用量筒量取47 mL的水,倒入盛有3 g氯化钠固体的烧杯中。
注意事项:根据水的体积,选取量程为50 mL的量筒(量筒选取原则:“大而近”的原则)。在加入液体的过程中,当液面所对刻度接近47 mL时,改用滴管滴加,直至液面达到47 mL为止。读数时,视线应与液体凹液面的最低处相平。
(4)溶解:用玻璃棒搅拌,使氯化钠全部溶解。
注意事项:溶解必须在烧杯中进行,不可以在量筒中配制溶液。
(5)转移:把配制好的氯化钠溶液装入细口瓶中,盖好瓶塞并贴上标签,放到试剂柜中。
[实验拓展]
实验过程中的误差分析:
1. 如果配制的氯化钠溶液的质量分数小于6%,可能的原因有:
(1)氯化钠中有杂质;(2)称量前天平未调零且向左偏;(3)称量氯化钠时只左盘垫纸;(4)左码右物且移动了游码;(5)转移时氯化钠洒落;(6)量取水时仰视;(7)溶解前烧杯中有水;(8)试剂瓶内有水等。其中操作(1)~(5)会导致溶质氯化钠的质量偏小,而操作(6)~(8)会导致溶剂水的质量偏大。
2. 如果配制的氯化钠溶液的质量分数大于6%,可能的原因有:
(1)稱量前天平未调零且向右偏;(2)量取水时俯视;(3)将水倒入烧杯时,有水溅出等。其中操作(1)会导致溶质氯化钠的质量偏大,而操作(2)和(3)会导致溶剂水的质量偏小。
[实战演练]
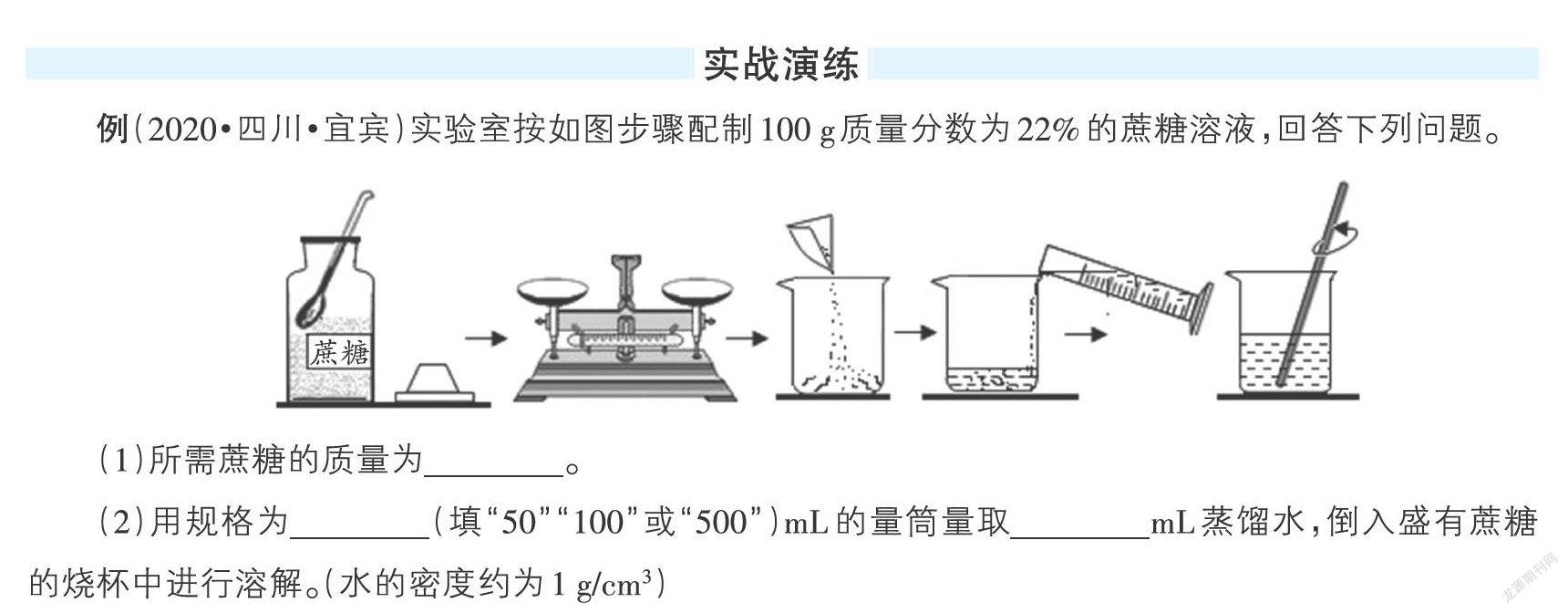
例(2020·四川·宜宾)实验室按如图步骤配制100 g质量分数为22%的蔗糖溶液,回答下列问题。
(1)所需蔗糖的质量为 。
(2)用规格为 (填“50”“100”或“500”)mL的量筒量取 mL蒸馏水,倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1 g/cm3)
(3)溶解时玻璃棒的作用是 。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是 (填字母序号)。
A. 蔗糖中混有少量杂质
B. 称量时蔗糖和砝码位置放反了(使用了游码)
C. 用于溶解蔗糖的烧杯洗净后残留有少量的水
D. 用量筒量取水时,俯视读数
解析:(1)溶质质量=溶液质量 × 溶质的质量分数,配制100 g质量分数为22%的蔗糖溶液,需蔗糖的质量=100 g × 22%=22 g。
(2)从减小实验误差的角度去选择量筒的量程,量筒的选取应依据“大而近”的原则。溶剂质量=溶液质量 - 溶质质量,所需溶剂的质量为100 g - 22 g=78 g,即所需溶剂的体积为78 mL,应选用规格为100 mL的量筒量取水。
(3)溶解时玻璃棒的作用是搅拌,加快溶解速率。
(4)若蔗糖中混有少量杂质或称量时蔗糖和砝码位置放反了(同时使用了游码),均会造成实际所取的溶质的质量偏小,即溶质质量分数偏小,即A、B错误;若用于溶解蔗糖的烧杯洗净后残留有少量的水,会造成实际量取的水的体积偏大,即溶质质量分数偏小,C错误;若用量筒量取水时俯视读数,会造成实际量取的水的体积偏小,即溶质质量分数偏大,D正确。所以本题选择D。
答案:(1)22 g (2)100 78 (3)搅拌,加快溶解速率 (4)D
