抗蓖麻毒素精制免疫球蛋白的制备及免疫防治效果评价
2021-09-10杨晓岚谷宏婧李欣昱段跃强范铁炯杨鹏辉刘国凤赵忠鹏
杨晓岚,李 敏,谷宏婧,李欣昱,段跃强,范铁炯,李 鑫,杨鹏辉,刘国凤,刘 媛,闫 芳,贺 威,赵忠鹏*
(1.军事科学院 军事医学研究院 微生物流行病研究所 感染免疫与防治研究室,北京 100071;2.上海赛伦生物技术有限公司,上海201418;3.解放军总医院 第五医学中心,北京 100039;4.青岛市妇女儿童医院,山东 青岛 266034;5.山西农业大学 动物科技学院,山西 太谷 030800;6.安徽医科大学 基础医学院,安徽 合肥 230032)
蓖麻毒素是最为重要的毒素类生物战剂,易获得、易提取、易使用、难监管,已列入1972年的生物武器公约及1997年的化学武器公约中[1]。自美国“911”恐怖袭击和炭疽袭击事件以来,特别是蓖麻毒素惊现伦敦后,蓖麻毒素正式被美欧列为最有可能被用作恐怖袭击的生物战剂,引起了世界各国的高度重视[2]。早在2002年,美国政府就提出:“蓖麻毒素防治药物是生物毒素战剂医学防护的重要研究方向”,每年都投入大量资金资助蓖麻毒素医学防护领域的研究,重点集中在中毒治疗性药物和预防性疫苗,已取得了一定进展[3]。而我国在救治药物、预防疫苗研究方面还存有大量空白,研制安全、有效的防治药物势在必行[4]。
鉴于人类与中毒病斗争的经验,最有效、最经济的手段是抗血清的免疫防治。虽然抗体研究和使用历经百年,多次迭代,但是现今市场上仍流通着不同时代的产品,他们相互补充,无法完全取代[5]。尤其是马抗血清制品的安全性、有效性、稳定性在多个产品上已获证实,针对不同的抗血清产品仅是更换了相应的免疫抗原,对制品的质量标准及安全性并无影响,是最便捷、最经济的抗体研发技术平台,应得到充分利用[6]。

1 材料与方法
1.1 蓖麻毒素纯品的制备及检定称取500 g去壳蓖麻籽,在5 mmol/L磷酸缓冲液中匀浆,用4层纱布滤去残渣,于4℃ 20 000×g离心30 min,取上清,加入固体(NH4)2SO4达到60%饱和度,置4℃ 3 h;20 000×g离心30 min,把沉淀溶解在适量缓冲液中,4℃透析24 h;4℃ 20 000×g离心10 min,上清液即为粗品。用4-氨苯基-β-D-硫代吡喃半乳糖苷衍生化的琼脂糖作为亲和介质,用半乳糖洗脱以除去粗品中的杂蛋白;根据蓖麻毒素与凝集素对离子交换树脂的结合能力不同,将凝集素与蓖麻毒素分离,最终得到纯品。将纯品进行SDS-PAGE和HPLC纯度检定,并用小鼠测定半数致死量(LD50)值。
1.2 蓖麻毒素脱毒将蓖麻毒素纯品按甲醛1∶1 000 ~1∶8 000进行脱毒,室温条件下分别放置48,72,96,120,144 h,进行透析袋浓缩、生理盐水平衡、0.22 μm滤膜除菌试验,Lowry法测蛋白含量并适量稀释后,接种小鼠,每只接种0.5 mL,观察1周,通过BALB/c小鼠存活情况,观察脱毒效果。
1.3 实验动物和细胞体质健康蒙古马,4~6岁,10匹,经检疫符合现行《中国药典》要求。SPF级BALB/c小鼠,6~8 周龄,购自斯贝福(北京)生物技术有限公司;Vero细胞,由军事医学研究院微生物流行病研究所细胞库提供。
1.4 马抗蓖麻毒素原料血浆的制备将纯化脱毒蓖麻毒素抗原(1∶1)与等体积的弗氏不完全佐剂混合,乳化,经马匹颌下、腹股沟淋巴结多点注射免疫,前4次基础免疫剂量分别为4,4,5,6 mg,每次间隔21 d,末次免疫后14 d, MTT法测定血清效价不低于1∶64 000时,采血,分离血清。

1.6 MTT法测定蓖麻毒素精制免疫球蛋白对蓖麻毒素的中和效果将Vero细胞接种于96孔板,每孔100 μL,含细胞2×104个/孔,37℃培养24 h,细胞长成单层。用DMEM培养基对蓖麻毒素精制免疫球蛋白(中和抗体活性10 000 U/mL)倍比稀释,起始稀释度为1∶4 000,共8梯度,而后用无血清DMEM培养液稀释蓖麻毒素(起始质量浓度0.75 g/L),再加入等量的蓖麻毒素液(含100 TCID50),37℃共孵育1 h,然后200 μL/孔依次加入预先吸出上清液的细胞孔,每个稀释度设4个复孔,并设正常细胞对照(不加毒素不加蓖麻毒素精制免疫球蛋白)、蓖麻毒素对照(加毒素不加蓖麻毒素精制免疫球蛋白)、正常马免疫球蛋白对照(加毒素加正常马免疫球蛋白)。每天观察,当蓖麻毒素对照孔细胞病变时,加MTT(0.5 g/L)200 μL/孔染色4 h,吸去液体加终止液(10%SDS+0.01 mol/L HCl)200 μL/孔溶解8 h,测定D570值。
1.7 动物法测定蓖麻毒素精制免疫球蛋白对蓖麻毒素的中和效果选用BALB/c小鼠30只,分6组,5只/组。用0.01 mol/L PBS对蓖麻毒素稀释5个梯度,分别为10,50,100,500,1 000 LD50,每个梯度的终体积为0.2 mL;用0.01 mol/L PBS将蓖麻毒素精制免疫球蛋白稀释4倍,按终体积0.2 mL/梯度,分别加入不同稀释度的蓖麻毒素,37℃温箱孵育1 h,同时设正常马免疫球蛋白对照组。将中和后的混合液腹腔注射BALB/c小鼠0.4 mL/只,每天观察小鼠死亡情况,连续观察72 h并记录结果。以在BALB/c小鼠体内中和1 LD50蓖麻毒素所需用精制免疫球蛋白的量为1个用药单位(U),标示精制免疫球蛋白含量。
1.8 蓖麻毒素精制免疫球蛋白制品在动物体内有效性研究
1.8.1测定蓖麻毒素对小鼠的LD50小鼠30只,5只/组,共6组。腹腔注射蓖麻毒素量分别为0.02,0.04,0.06,0.08,0.10,0.12 μg,每只注射剂量为0.2 mL。每天观察并记录小鼠存活数,根据Reed-Munch公式计算LD50值。
1.8.2小鼠体内预防试验 选用小鼠25只,分5组,5只/组,称体质量。用0.01 mol/L PBS 1∶400稀释制品,每只小鼠静脉注射0.2 mL,对照组每只小鼠注射同等量的0.01 mol/L PBS 0.2 mL。分别于注射免疫球蛋白后3,4,5,6 d腹腔注射0.01 mol/L PBS稀释的蓖麻毒素5 LD50,每天称小鼠体质量,并记录死亡情况。
1.8.3小鼠体内治疗试验 选用小鼠25只,分5组,5只/组,称体质量。用0.01 mol/L PBS稀释蓖麻毒素,每只小鼠腹腔注射5 LD50/0.2 mL建立感染动物模型。分别于注射蓖麻毒素后2,3,4,5 h静脉注射0.01 mol/L PBS 稀释的免疫球蛋白25 U/0.2 mL,每天称小鼠体质量,并记录死亡情况。
1.9 安全性检测按照现行《中国药典》要求,对制品进行无菌试验、热原检查、异常毒性试验、一般药理试验、急性毒性试验、免疫毒性试验、溶血和血管刺激性试验。
2 结果
2.1 蓖麻毒素纯品的制备及检定对制备的蓖麻毒素纯品进行检测,检测结果显示,经初步优化后,纯化的蓖麻毒素纯度均在90%以上,腹腔注射对小鼠LD50值约为6.38 μg/kg(图1)。
A.蓖麻毒素 SDS-PAGE代表性结果(M.蛋白Marker;1.亲和层析洗脱液;2.离子交换层析穿过液;3.洗脱液);B.蓖麻毒素 HPLC检测
2.2 蓖麻毒素纯品的脱毒及验证经常规毒素脱毒试验验证(表1),甲醛浓度为1∶4 000,室温脱毒96 h,蓖麻毒素被完全脱毒。


表1 不同甲醛浓度脱毒蓖麻毒素纯品效果

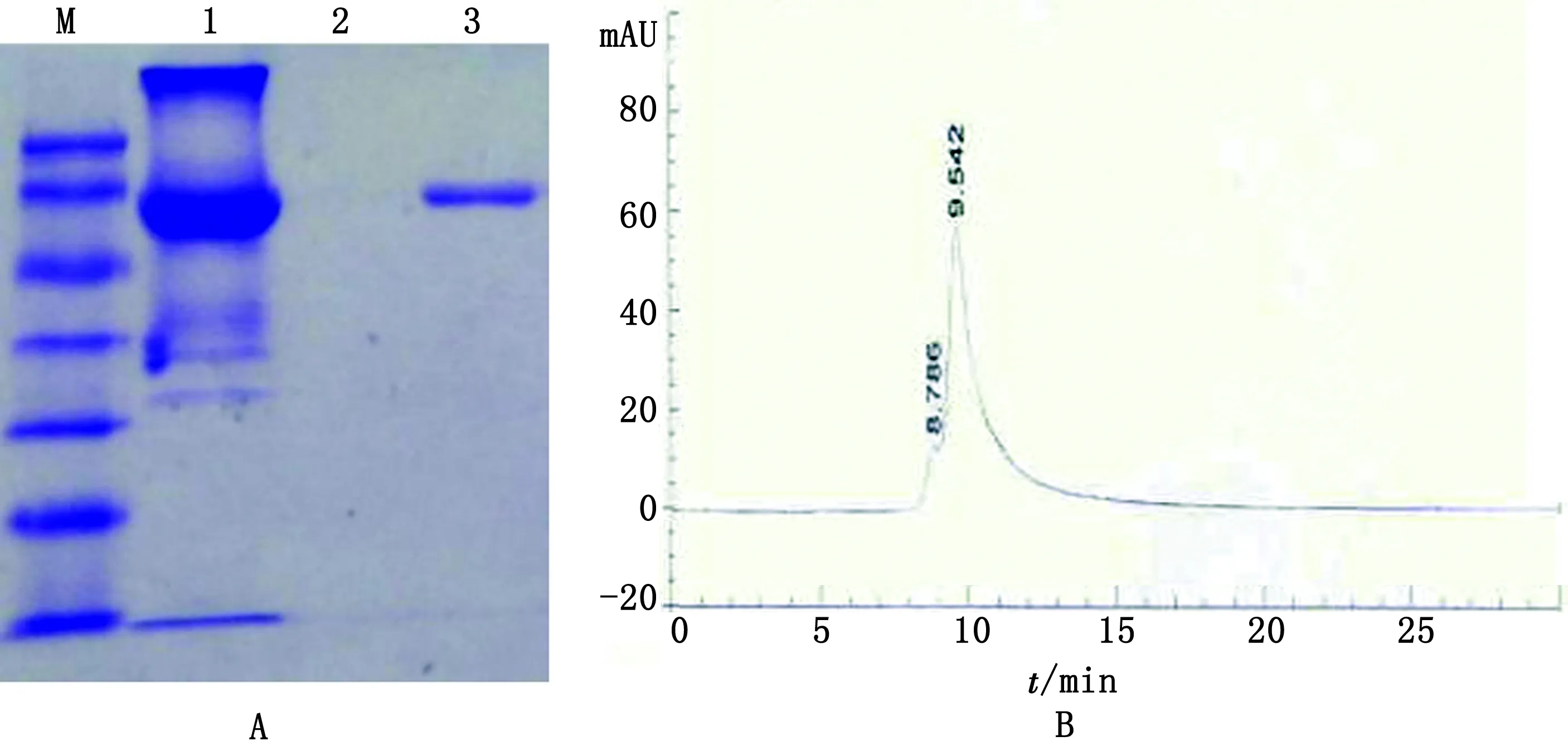
A.蓖麻毒素精制免疫球蛋白SDS-PAGE结果(M.蛋白Marker;1.血浆;2.S/D灭活血浆;3.蓖麻毒素精制免疫球蛋白);B.蓖麻毒素精制免疫球蛋白HPLC结果
2.4 MTT法测定蓖麻毒素精制免疫球蛋白效价MTT法测得正常马血清免疫球蛋白对蓖麻毒素没有中和效果,蓖麻毒素精制免疫球蛋白对蓖麻毒素的抗体效价为1∶128 000,说明研制的蓖麻毒素精制免疫球蛋白具有很好的中和抗体活性(表2)。
表2 MTT法测定蓖麻毒素精制免疫球蛋白对蓖麻毒素中和效果 D570值
2.5 动物法测定蓖麻毒素精制免疫球蛋白对蓖麻毒素的中和抗体效价动物法测定蓖麻毒素精制免疫球蛋白可完全中和500 LD50蓖麻毒素,小鼠健康存活,而正常马免疫球蛋白对照组小鼠48 h内全部死亡,中和抗体效价超过6 000 U/mL(表3)。

表3 蓖麻毒素精制免疫球蛋白在小鼠体内的中和抗体效价(存活数比例,n=5)
2.6 蓖麻毒素精制免疫球蛋白在小鼠体内的防治效果当小鼠腹腔注射用量为1 250 U/kg蓖麻毒素精制免疫球蛋白时,分别于3,4,5 d注射5 LD50蓖麻毒素后,给药小鼠均未见死亡,并且7 d 后体质量均可恢复至给药前水平;而给药后6 d 注射蓖麻毒素的小鼠,于注射毒素72 h内全部死亡;对照组在注射蓖麻毒素后48 h内全部死亡(表4)。

表4 蓖麻毒素精制免疫球蛋白在小鼠体内的预防效果(n=5)
当腹腔注射5 LD50蓖麻毒素感染小鼠发病后,分别在2,3,4 h静脉注射蓖麻毒素精制免疫球蛋白,发病的小鼠全部存活,给药后体质量虽有下降,但7 d小鼠体质量均恢复至注射毒素前水平;当5 h 后给予蓖麻毒素精制免疫球蛋白小鼠于144 h 内全部死亡,而没有给予蓖麻毒素精制免疫球蛋白的对照组小鼠48 h内也全部死亡(表5)。
表5 蓖麻毒素精制免疫球蛋白在小鼠体内的治疗效果(n=5)
2.7 蓖麻毒素精制免疫球蛋白的安全性按照现行《中国药典》要求,委托北京昭衍新药研究中心,开展无菌试验、热原检查、异常毒性试验、一般药理试验、急性毒性试验、免疫毒性试验、溶血和血管刺激性试验,试验结果均符合现行《中国药典》要求,具有良好的安全性。
3 讨论
蓖麻毒素作为最有可能被用作恐怖袭击的生物战剂,防治药物研究是医学防护的重中之重。蓖麻毒素预防性疫苗在美国已经完成Ⅰ期临床试验,具有一定的安全性和有效性,在我国还未见报道[8];蓖麻毒素中和性单抗国内外均有报道,可在紧急条件下有条件批准使用,其难于生产、价格贵,限制了其临床应用[9]。

抗体研发最核心的环节之一是免疫原的制备。由于功能性蓖麻毒素的工程性表达难度大、成本高[10],故本研究选择从蓖麻籽中提取,原料充足、成本低廉,在借鉴其他团队成功提取蓖麻毒素粗品经验的基础上,根据蓖麻毒素的性质,增加了亲和层析和离子交换层析方法,获得了纯度90%以上的纯品,为免疫动物用抗原提供了物质基础,也为动物模型建立提供了高品质的毒素。蓖麻毒素脱毒是制备免疫用抗原较为重要的环节,脱毒不足,会造成马匹的死亡;脱毒过量,会造成免疫马匹中和效价降低,导致最终制品杂质多、品质差,在不断摸索中,课题组找到了最佳的灭活条件。
抗体研发最关键的环节之一是治疗性抗体的评价。本研究建立了蓖麻毒素中毒细胞模型和动物模型。在2个模型中,均证明制品的有效性,为临床试验奠定了药理学基础,也为药效学评价中细胞替代动物研究奠定基础。遵从动物伦理学的要求,在制品批签发时,尽量用细胞模型测定制品的抗体效价,以减少实验动物的使用量[11]。
总之,利用现代生物制药技术,本试验成功制备蓖麻毒素精制免疫球蛋白,有望成为蓖麻毒素中毒的“救命药”,正在加紧进行临床研究,以争取早日上市,为中毒患者服务。
