山西省犊牛腹泻致病性大肠杆菌毒力因子筛查
2021-09-10李红丽闫益波乔国峰温永亮郭锦龙张国权
刘 源,李红丽*,闫益波,乔国峰,温永亮,郭锦龙,张国权
(1.山西农业大学 动物医学学院,山西 太谷 030801;2.山西省方山县教育科技局,山西 方山 033100)
新生犊牛腹泻是引起犊牛死亡的重要原因之一[1],该疾病涉及多重因素,包括犊牛的免疫状况、环境因素和畜舍、饲养和卫生条件等牧场管理措施,以及细菌、病毒和原生动物等不同病原体的相互作用[1-2]。大肠杆菌是哺乳动物肠道的正常寄生菌,在宿主代谢、免疫和营养方面起着重要作用。然而,有少量致病性菌株可引起肠内或肠外疾病,并可引起极大的经济损失[3]。致病性大肠杆菌是引起犊牛腹泻的一种重要因素[4]。
致病型大肠杆菌菌株具有不同的毒力因子,使其能够在宿主小肠中定植,避免免疫反应,刺激有害的炎症反应并产生腹泻。这些毒力因子包括定植或黏附因子(F2-F6、F17、F18、F41)、外毒素(热敏性肠毒素LTⅠ和LTⅡ、热稳定肠毒素STa和STb、志贺毒素(Stx)、细胞毒性坏死因子 (CNF) 等[5]。目前牛源致病型大肠杆菌主要有产肠毒素型大肠杆菌(enteotoxigenicE.coli,ETEC),肠致病型大肠杆菌(entropathogenicE.coli,EPEC),肠出血型大肠杆菌(enterohaemorrhagicE.coli,EHEC),产细胞毒性坏死因子型大肠杆菌(necrotoxigenicE.coli,NTEC)[5]。不同型致病性大肠杆菌的划分是依据其所包含的毒力因子和毒性机制例如肠致病性大肠杆菌[6]或尿道致病性大肠杆菌。
ETEC已被确定为几种重要的动物和人类腹泻疾病的病原体。这些细菌可能产生热敏性(LT)和热稳定性(STa和STb)肠毒素中的一种或多种[7]。EPEC感染后在患者或受感染动物的肠道组织中可观察到附着和消退(A/E)组织病理学损伤,不产生肠毒素和Stx[8],其与上皮细胞的紧密结合是由亲密素(intimin)的外膜蛋白介导的,而参与编码该蛋白的基因eae最早由JERSE等[9]报道。EHEC隶属于STEC亚类,可产生Stx并引起肠道组织A/E损伤[8]。NTEC能产生CNF(包括CNF1,2,3)[10]。已有研究报道从腹泻的犊牛中分离出CNF1、CNF2[11-12]。
在中国,引起犊牛腹泻的致病性大肠杆菌被广泛研究。然而,近5年的研究仅限于少数畜群,集中在病原的流行病学调查[13-14]、系统进化树分析[15]、耐药性分析[16]以及功能研究[17]等方面。本研究对随机取样的新生牛犊中分离出的致病性大肠杆菌菌株进行毒力因子(F5、F17、STa、LTII、eae、Stx1、Stx2、CNF1、CNF2)筛查,通过PCR检测分析腹泻犊牛分离的大肠杆菌致病性相关的毒力因子的流行情况,初步探究这些毒力因子与腹泻率的关系。本研究为山西省牛群的致病性大肠杆菌毒力因子特征研究提供了最新信息,对预警犊牛腹泻的暴发和治疗致病性大肠杆菌引起的犊牛腹泻具有重要意义。
1 材料与方法
1.1 试验材料选取山西省母牛数量为100~250头的西门塔尔杂交肉牛场33个,33个牛场覆盖了山西省11个市,每个市随机选取3个牛场。LB培养基、PCR试剂购自生工生物工程(上海)股份有限公司;PCR扩增阳性对照菌株C83539(F5+、Sta+)、C83684(Stx2+)、C83901(LTⅡ+),均购自中国兽医药品监察所;FX-01(F17+、CNF2+)、FX-02(Stx1+、eae+)、XN-01(CNF1+),均由本实验室保存。
1.2 采集样品采集所选33个牛场出生10 d以内腹泻犊牛肠拭子。采样时间为2019年6—8月(夏季)。记录采样时所有牛场犊牛数量,对采样时犊牛的腹泻状况进行描述统计。
1.3 致病型大肠杆菌分离与毒力因子PCR鉴定收集单个直肠拭子(n=205),转移至含有LB培养液的试管中,于摇床37℃培养6~8 h菌液变浑浊后,抽取菌液1 μL作为模板进行PCR反应,鉴定其是否含有毒力因子。PCR扩增体系:2×Direct PCR Mix 10 μL、模板1 μL、Hot Start DNA Polymerase 0.5 μL、上下游引物(10 μmol/L)各1 μL、灭菌ddH2O 补足至20 μL。PCR程序:预变性98℃ 30 s;变性98℃ 5 s,退火5 s,延伸72℃ 20 s,35个循环;72℃延伸1 min,于4℃保存(表1)。将PCR结果为阳性(至少扩出1个毒力因子)的菌液涂抹于麦康凯琼脂平板(山西科教仪器服务公司),37℃培养24 h,挑选平板长出单菌落约10个分别作为模板进行PCR验证其所含的毒力因子。将结果为阳性的菌落进行革兰染色、生化试验,确定为肠杆菌科、大肠杆菌属的菌落转移到含有LB培养液的细菌培养瓶中,37℃摇床培养6~8 h,菌液变浑浊后将1 mL菌液转移至1.5 mL EP管,加30%甘油后于-80℃保存。
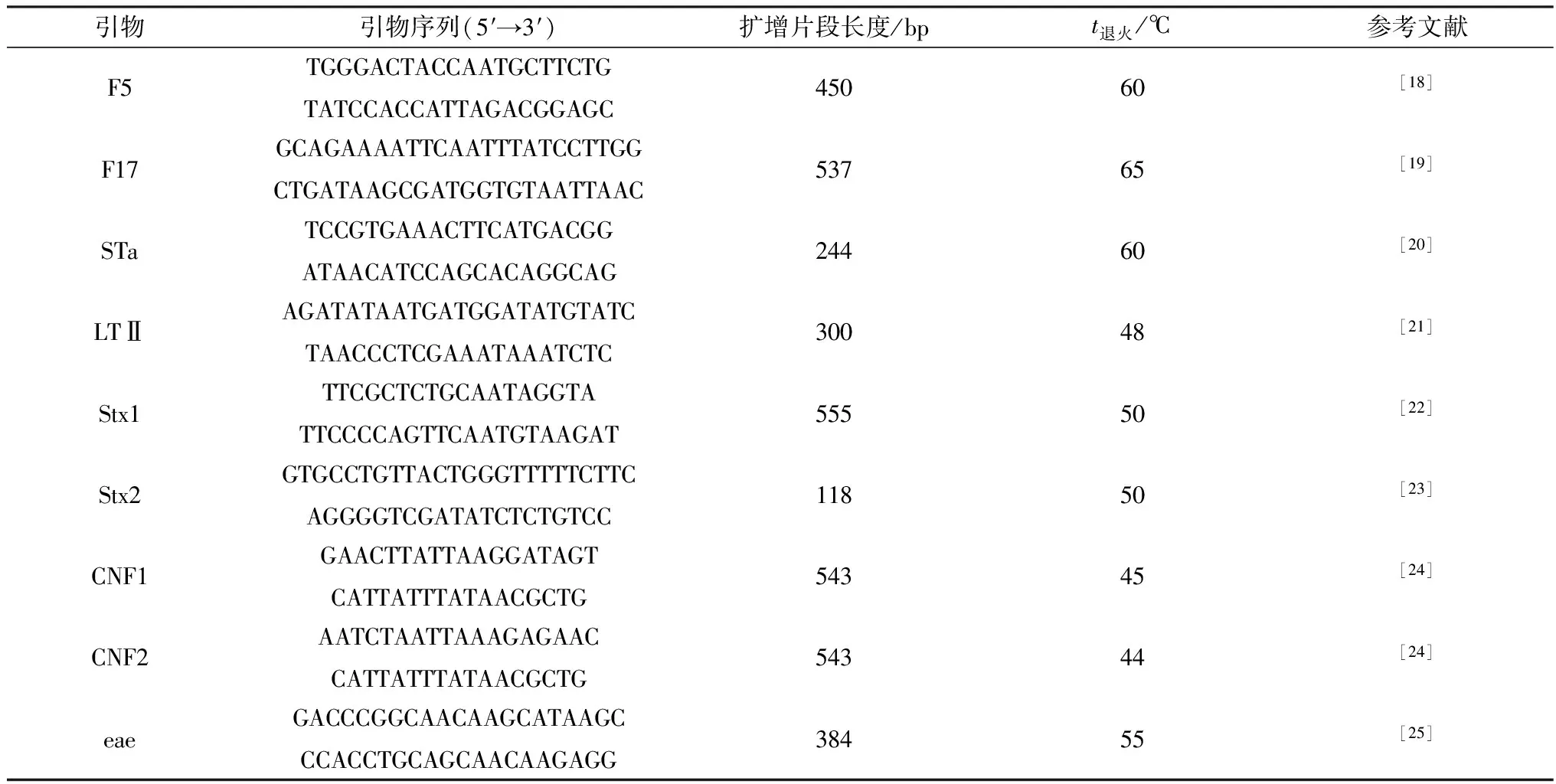
表1 PCR反应引物基本信息
1.4 统计与分析所有数据分析均使用统计软件SPSS 18.0,P< 0.05有统计学意义;使用全球定位系统(GPS)记录牛群的地理坐标;使用Originpro 2019b将研究区域内的牛场按照毒力谱的种类和频率进行聚类分析;使用ArcGIS 10.2 (ESRI,Redlands,CA,USA)对聚类的结果进行空间描述;依据各牛场的腹泻率和其毒力谱计数,使用SPSS 18.0,采用逐步回归法建立犊牛腹泻率对毒力谱计数多元线性回归方程。
2 结果
2.1 犊牛的腹泻状况33个牛场共有205头腹泻犊牛。各牛场平均采样(6.21±3.05)头。各牛场犊牛采样时的平均腹泻率为33.1%。各牛场犊牛腹泻率为15.4%~62.5%。中位数为29.4%(百分位数25∶23.9%,百分位数75∶39.5%)。5个牛场(5,7,17,20,33)腹泻率高于50%;5个牛场(1,9,13,23,28)的腹泻率低于20%(图1)。
2.2 毒力因子鉴定根据不同基因组合,从33个牛场采样的腹泻犊牛(n=205)中分离得到101株致病性大肠杆菌(PCR毒力基因阳性)中,鉴定出18种不同毒力谱(表2)。检测到的毒力谱广泛分布于所调查牛场,不同牛场毒力谱呈现不同组合,并检测到所有9种毒力因子。黏附因子和毒素结合较普遍。检测到的最普遍的阳性毒力因子为F17,其次为F5、Sta,而仅有2株菌为CNF1阳性(表2),其中,F17仅与其他基因结合。
2.3 牛场聚类分析将各牛场按照其毒力谱的种类和频率进行聚类分析(图1),可聚为4类。牛场1,2,3,5,6,8,9,10,11,12,13,14,16,18,19,23,24,25,26,27,28,29,30,31聚为第Ⅰ类;牛场4,17,20,21,22,33聚为第Ⅱ类;牛场7,32聚为第Ⅲ类;牛场15单独聚为第Ⅳ类。使用ArcGIS (ESRI,Redlands,CA,USA)对牛场的聚类结果进行空间描述(图2),结果表明聚为第Ⅰ类的牛场数量最多,集中连片地分布在山西省广大地区;聚为第Ⅱ类的牛场中,牛场17,20,21,22集中连片地分布在山西省的中部地区。
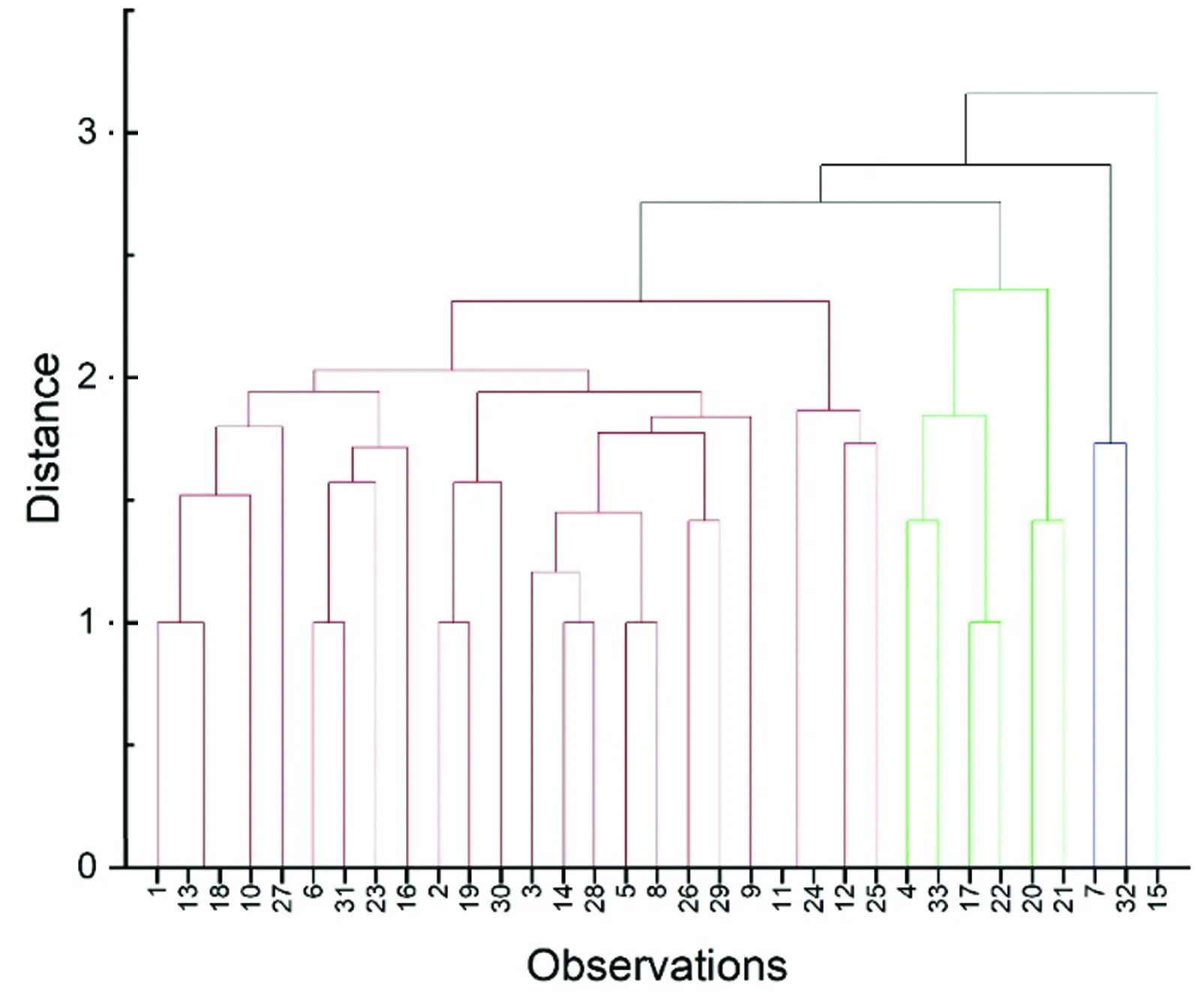
图1 牛场聚类分析
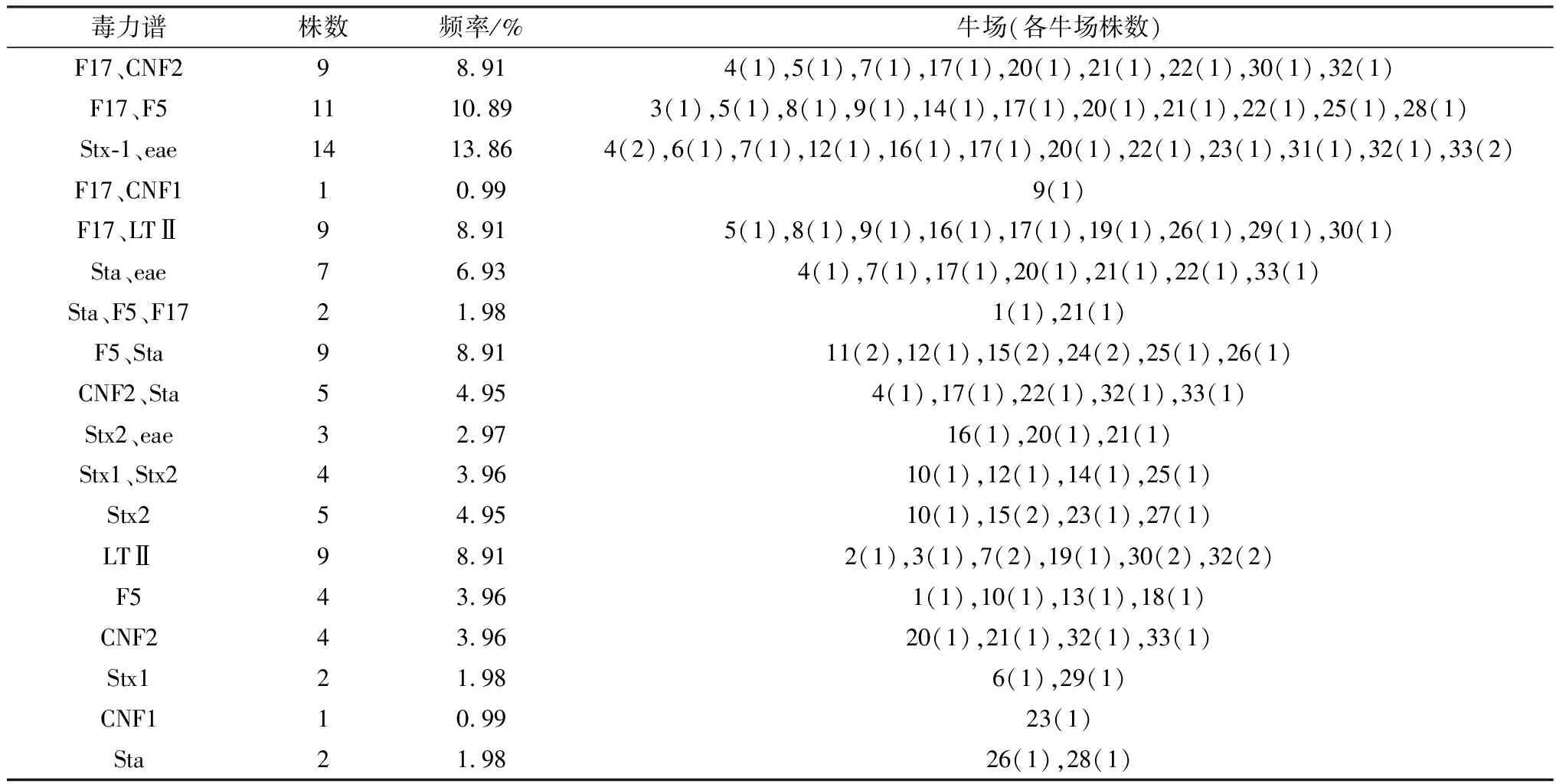
表2 33个牛场毒力谱(n=101)
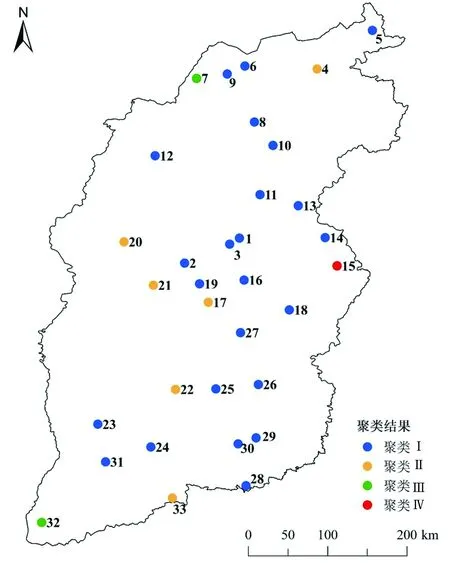
图2 牛场聚类的空间描述(圆点表示牛场的地理坐标)
3 讨论
致病性大肠杆菌对新生犊牛,尤其是出生1周内的犊牛发病率、死亡率影响相对较高[26]。因此本试验样本只采自出生10 d以内犊牛肠拭子,有利于研究犊牛的毒力谱与其腹泻率之间的关系。
利用PCR技术鉴定毒力因子已被广泛用于区分致病性大肠杆菌和正常肠道菌群。本研究PCR结果表明检测到的多数阳性毒力谱与ETEC的毒力谱相兼容。NAGY等[27]报道,ETEC引起的腹泻被认为是断奶前和断奶期新生犊牛的主要传染病类型。F5是新生犊牛大多数感染ETEC的罪魁祸首[28]。本研究F5阳性菌占比为25.7%。世界范围内巴西的F5阳性菌株感染率较高(35.0%)[29],而美国(1.8%)[30]、荷兰(2.6%)[31]的F5阳性菌株感染率较低。
本试验检测到腹泻犊牛中最普遍的毒力因子是F17(31.7%)。这也印证了MAINIL等[5]报道F17普遍存在于分离自牛的各种主要致病性大肠杆菌(ETEC、EHEC、STEC、NTEC)。
ETEC菌株在黏附肠黏膜后,可产生耐热性(LT)和热稳定性(STa和STb)肠毒素中的一种或多种[7],这2种肠毒素负责将电解质和水大量分泌到小肠内。NAGY等[27]研究报道Sta肠毒素来源于猪和牛的ETEC菌株,而Stb肠毒素来源于人类和猪的ETEC菌株。MAINIL[5]报道Sta肠毒素主要来源于牛、猪、犬、人和绵羊的ETEC菌株,而Stb肠毒素主要来源于猪的ETEC菌株。因此本研究并没有涉及Stb,而Sta阳性菌株占比25.8%。MAINIL[5]指出,不同于分离自腹泻猪的LTp主要阳性菌和分离自腹泻病人的LTh主要阳性菌,LTⅡ阳性菌可以从腹泻病人、牛、水牛中分离得到。本研究中分离到LTⅡ阳性菌株18株,占比17.8%。
牛场聚类结果表明犊牛腹泻率在40%以上的8个牛场中,牛场4,17,33,22,20聚到第Ⅱ类;犊牛腹泻率在25%以下的所有8个牛场聚到第Ⅰ类。因此推测牛场的犊牛腹泻率与毒力谱之间存在相关关系;因此将各牛场的毒力谱计数作为自变量,其犊牛腹泻率作为因变量来建立多元线性回归方程。建立的方程为y=0.264+0.217x1+0.079x2(R=0.723)。其中,x1是组合为Sta、eae毒力谱计数,x2是组合为F17、LTⅡ毒力谱计数。由于其他毒力谱偏回归系数的检验概率P>0.05,已不显著,引入方程无意义。
犊牛致病性大肠杆菌的获得通常是通过与母牛接触,在犊牛未出生之前,可通过该方程由某牛场待产母牛检测的Sta+eae、F17+LTⅡ这2种毒力谱的计数来预测该牛场所产犊牛腹泻率的高低;通过预测结果,对检出这2种毒力谱的母牛进行大肠杆菌病针对性治疗,并对该牛场采取积极的防制措施,从而减少新生犊牛大肠杆菌病的发病率,减小经济损失。该方程的建立可预警新生犊牛腹泻的暴发。由于该方程的复相关系数R=0.723,相对较低,牛场也不一定包含所有这2种阳性毒力谱,加之腹泻与诸多因素有关,故该方程只能大致预测。要研究牛场犊牛的毒力谱与其腹泻率的关系还需要进行更深入的探索和反复验证。
牛场聚类结果的空间分布呈现第Ⅰ类牛场和第Ⅱ类17,20,21,22牛场集中连片分布形态,提示集中分布牛场的牛来源于同一疫源地,后续试验将对这一推论进行求证。
综上所述,本研究对山西省腹泻犊牛的致病性大肠杆菌菌株9种毒力因子进行PCR筛查,其中F17和F5是从腹泻的肉犊牛分离的致病性大肠杆菌中最常见的毒力因子;发现了18个不同的毒力谱;将牛场按照毒力谱的种类和频率进行聚类分析,建立犊牛腹泻率对其毒力谱的线性回归方程。本研究在国内针对犊牛大肠杆菌毒力谱进行广泛分析,为山西省致病性大肠杆菌菌株的分子特征研究提供了最新信息,对预警牛场犊牛大肠杆菌的暴发和预防及治疗致病性大肠杆菌引起的犊牛腹泻具有重要意义。为了研究与大肠杆菌病相关毒性因子的特性,后续需要对涉及不同牛种和牛场类型(奶牛或肉牛)的动物进行更广泛研究。
