区分NDV强弱毒株的抗鸡新城疫病毒La Sota株NP蛋白单克隆抗体1E3的制备与鉴定
2021-09-10王赛楠李利杰赵振超孙文杰张世华何春辉李新生
王赛楠,李利杰,赵振超,孙文杰,张世华,何春辉,李新生
(河南农业大学 动物医学院,河南 郑州 450002)
鸡新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的禽类的一种急性、高度接触性、传染性疫病[1],其主要症状为高热,精神沉郁,呼吸加快,食欲减退,下痢,以及翅、腿麻痹,运动失调等[2],该病传播快、发病率和死亡率高,世界动物卫生组织(OIE)将其列为A类动物疫病[3]。自1926年被报道以来,ND在世界范围内广泛传播,伴随着疫苗的广泛应用,ND的毁灭性大流行已基本得到控制[4],因为缺乏区域性协调的NDV综合防控策略,其在全球主要养鸡地区鸡群仍时有发生。
NDV属于副黏病毒科副黏病毒属的禽副黏病毒Ⅰ型,是具囊膜的负链RNA病毒,仅有1个血清型[5]。ND的确诊常常使用病毒分离鉴定、RT-PCR、血凝试验(HA)和血凝抑制试验(HI)等,但这些方法均难以区分分离到的NDV是流行强毒株还是是弱毒疫苗株[6]。单克隆抗体有潜力作为NDV不同毒株抗原性差异区分的重要鉴别手段[7-8]。区分NDV毒力强弱的常用方法是测定NDV分离毒株的脑内致病指数(ICPI),结合F2蛋白羧基端113~116位是否含有至少3个精氨酸或者赖氨酸,F1蛋白的第117位是否为苯丙氨酸来进行综合判定[9]。到目前为止,尚未见显著区分NDV强、弱毒单克隆抗体制备和鉴定的报道。本课题组为建立快速区分NDV强毒和弱毒疫苗株病毒的检测方法,进行相关探索和研究。
1 材料与方法
1.1 病毒、实验动物和主要试剂NDV La Sota株(基因Ⅱ型,ICPI=0.3)、F48E9株(基因Ⅸ型,ICPI=2.0)、HN09-68株(基因Ⅶ型,ICPI=1.5)、AIV H9N2亚型X-13株、IBDV C4株、FAdV-4 WZ株、NS0细胞均由河南农业大学鉴定保存;BALB/c小鼠购自郑州大学动物实验中心;SPF鸡胚购自北京勃林格殷格翰维通生物技术有限公司;弗氏佐剂、HAT培养基等购自Sigma公司。
1.2 病毒的增殖和浓缩纯化采用鸡胚尿囊腔接种法增殖NDV La Sota株,收获尿囊液,4℃,3 000 r/min离心30 min,弃沉淀,取上清4℃,20 000 r/min离心2 h,沉淀以适量PBS缓冲液重悬,10%~60%蔗糖连续密度梯度,38 000 r/min离心4 h,收集病毒液,脱糖,检测HA效价,作为免疫原,-70℃冻存备用。
1.3 动物免疫用0.1%的甲醛灭活上述纯化的La Sota病毒,与等体积的弗氏完全佐剂充分乳化,皮下分点接种6周龄BALB/c小鼠2只,0.2 mL/只。二免和三免用弗氏不完全佐剂制备,每次接种0.2 mL/只。免疫间隔为2周。三免后1周,断尾采血,测定血清效价,达到要求后,于融合前3 d以病毒液腹腔接种加强免疫。
1.4 间接ELISA方法的初步建立按照棋盘法倍比稀释La Sota株病毒抗原和对照血清,确定最佳抗原稀释倍数、阳性血清稀释倍数,建立间接ELISA方法。随机选取未免疫的健康小鼠10只,断尾,采集阴性血清。在最佳ELISA条件下,计算阴阳临界值(阴阳临界值=阴性标本D450平均值+3×标准差)。
1.5 小鼠血清效价的测定将待检小鼠断尾采血,用建立的间接ELISA方法检测抗体效价。
1.6 细胞融合按照文献[10]方法,无菌采集免疫小鼠的脾脏,研磨分离成单个脾细胞,与NS0进行融合。将细胞悬液加入有饲养细胞的96孔HAT选择性培养基细胞培养板中,置37℃、5% CO2培育箱中培养。
1.7 阳性杂交瘤细胞的筛选及亚克隆培养10~14 d时,选择只有单个细胞群落的细胞孔,吸取培养液,检测其ELISA效价。对阳性单克隆细胞用有限稀释法进行3次亚克隆。稳定分泌特异性单抗的杂交瘤细胞扩大培养、冻存备用。
1.8 腹水的制备和纯化取12周龄经产BALB/c母鼠,腹腔注入无菌液体石蜡,0.5 mL/只。7~10 d后每只小鼠腹腔注射1.0×106个杂交瘤细胞。连续观察,待小鼠腹部明显膨大有波动感时,用穿刺针无菌收集腹水,离心取上清,亲和层析法纯化,-20℃保存备用。
1.9 单抗效价的测定用上述间接ELISA方法测定单克隆杂交瘤上清液和纯化单抗效价。
1.10 杂交瘤细胞分泌抗体稳定性检测将杂交瘤细胞进行传代培养10代以上,冻存,2个月后复苏,然后再连续传至10代,用建立的间接ELISA方法检测其效价。
1.11 单抗特异性鉴定分别用AIV H9N2亚型X-13株、IBDV C4株、FAdV-4 WZ株包被96孔酶标板,采用间接ELISA方法鉴定各株单抗反应特异性,用本研究制备的单克隆抗体作为一抗,HRP标记的羊抗鼠IgG作为二抗,测定筛选鉴定的阳性单抗与上述参考病毒的反应性。
1.12 单抗中和活性测定将NDV La Sota株鸡胚尿囊液用PBS缓冲液进行10-5,10-6,10-7,10-8稀释,分别与等体积的纯化单抗混合,37℃作用1 h,与不加单抗的病毒稀释液,各尿囊腔接种10日龄SPF鸡胚,0.2 mL/枚,37℃培养96 h后收集接种鸡胚的尿囊液,测定HA效价,检测单抗的中和效果。
1.13 单抗亚型鉴定按照IsoStrip Mouse Monoclonal Antibody Isotyping Kit说明书,对获得的单克隆抗体进行亚型鉴定。
1.14 阳性单抗与不同毒力NDV的结合能力鉴定按照1.4中的抗原最佳包被浓度,用NDV La Sota株、F48E9株和HN09-68株纯化病毒液分别包被96孔酶标板,用上述阳性单抗作为一抗,HRP标记的羊抗鼠IgG作为二抗,TMB显色,测定D450值,判定单抗与不同毒力NDV毒株的结合特性。
1.15 Western blot鉴定将纯化的La Sota病毒进行SDS-PAGE电泳,电转印至PVDF膜,5%脱脂奶粉封闭,分别使用1E3、7A8、8F11作为一抗,HRP标记的羊抗鼠IgG作为二抗,DAB避光显色10 min,确定一抗对应的目的带。
1.16 蛋白鉴定收集纯化Western blot中单抗对应的目的蛋白,送生工生物工程有限公司进行二级质谱测定。
2 结果
2.1 间接ELISA方法的初步建立将纯化后的La Sota株抗原用碳酸盐缓冲液分别稀释为54.8,27.4,13.7,6.9 mg/L,包被酶标板。使用SPF健康小鼠的阴性血清或免疫制备的阳性血清作为一抗,将血清1∶12 800~1∶204 800作倍比稀释,进行ELI-SA检测,测定结果见表1。当抗原的包被质量浓度为13.7 mg/L,血清稀释度为1∶102 400时,阳性血清D450值最接近1.0,同时P/N>2.0,阴性血清D450值也最低,所以13.7 mg/L为La Sota株最佳包被质量浓度。

表1 抗原包被质量浓度和血清最佳稀释倍数的确定
2.2 阴阳临界值的确定取10只SPF健康小鼠的血清,按照13.7 mg/L包被酶标板,将阴性血清用5%脱脂奶粉稀释至1∶102 400,测定D450值。10只阴性小鼠血清D450平均值为0.085,标准差为0.015,根据公式:阴阳临界值=阴性标本D450平均值+3×标准差,阴阳临界值为0.130。
2.3 阳性杂交瘤细胞的建立经细胞融合和亚克隆培养,使用上述ELISA方法筛选获得3株分泌抗NDV La Sota株单克隆抗体的杂交瘤细胞株,其分泌的单抗分别命名为1E3、7A8、8F11。
2.4 阳性杂交瘤细胞的稳定性和单克隆抗体效价的测定将上述3株定株的杂交瘤细胞株冻存2个月后复苏,然后连续传至第10代,测定杂交瘤细胞培养上清和相应腹水的效价(表2)。
2.5 单抗特异性鉴定3株单抗仅与La Sota株包被的酶标板呈阳性反应,而与AIV H9N2亚型X-13株、IBDV C4株、FAdV-4 WZ株均呈阴性反应(表3),证明3株单抗均具有良好的特异性。
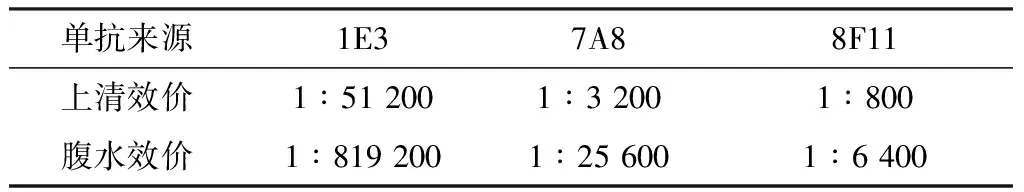
表2 第10代杂交瘤细胞上清和腹水中不同单抗的ELISA效价

表3 不同单抗与不同包被抗原ELISA测定结果
2.6 单抗中和活性测定鸡胚中和试验结果(表4)显示,1E3中和组和8F11中和组与对照组相比,鸡胚感染数量无显著性差异,对NDV La Sota株无中和活性。7A8中和组,在10-7稀释度时对NDV La Sota株具有显著的中和活性。
2.7 单抗亚型鉴定如图1所示,使用罗氏抗体分型诊断试纸判定1E3和8F11为IgG1亚型,7A8为IgM亚型,其轻链均为κ链。
2.8 不同单抗与不同毒力NDV结合能力的鉴定如表5所示,当上述纯化的单克隆抗体1∶51 200倍稀释时,只有1E3与La Sota呈强阳性反应。使用不同毒力的NDV包被的酶标板,1E3与La Sota反应的D450值为2.543,呈阳性反应,而强毒株F48E9和HN09-68与单克隆抗体的反应小于阴阳临界值,呈阴性反应。1E3与弱毒的反应和与强毒F48E9、HN09-68的反应之间P<0.05,差异性显著。由此可见,1E3具备区分NDV强毒和弱毒的能力。
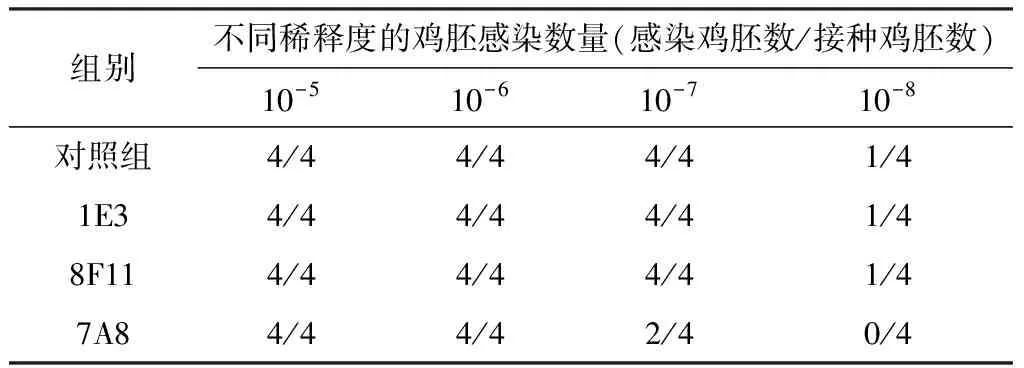
表4 不同单抗对NDV La Sota株鸡胚中和试验结果

图1 单抗亚型的鉴定
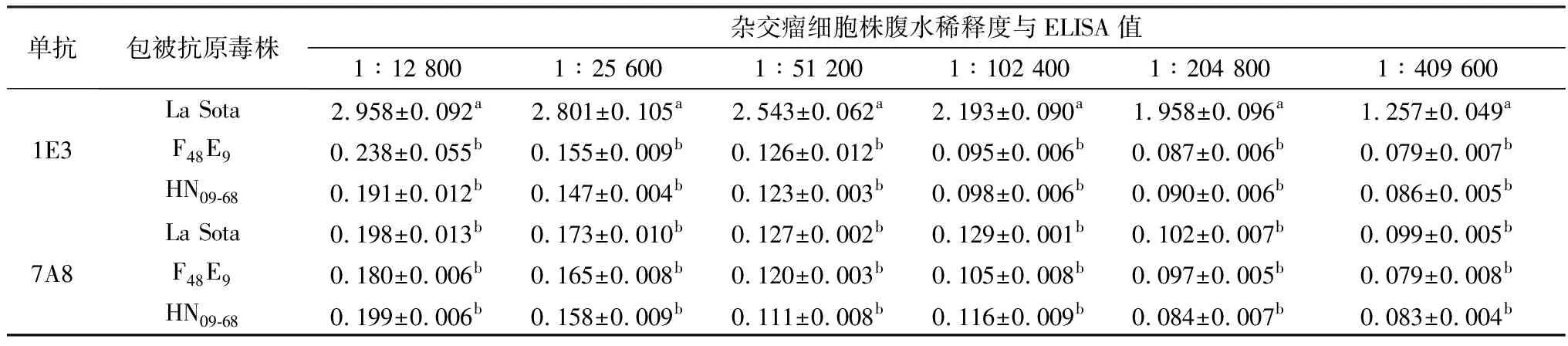
表5 单克隆抗体与不同NDV毒株反应
2.9 NDV La Sota株病毒SDS-PAGE电泳、Western blot和二级质谱鉴定为识别1E3、7A8、8F11所针对的NDV抗原种类,使用纯化的La Sota病毒进行SDS-PAGE、Western blot,只有单抗1E3可见稳定清晰的结果(图2B),La Sota病毒颗粒中相对分子质量约为53.8 kDa与1E3发生了特异性反应。二级质谱测定证明该抗原蛋白的一级结构含有LGVEYAQAQGSSINE DMAAELK序列(图3),经De novo,确认该蛋白为La Sota株NP蛋白。
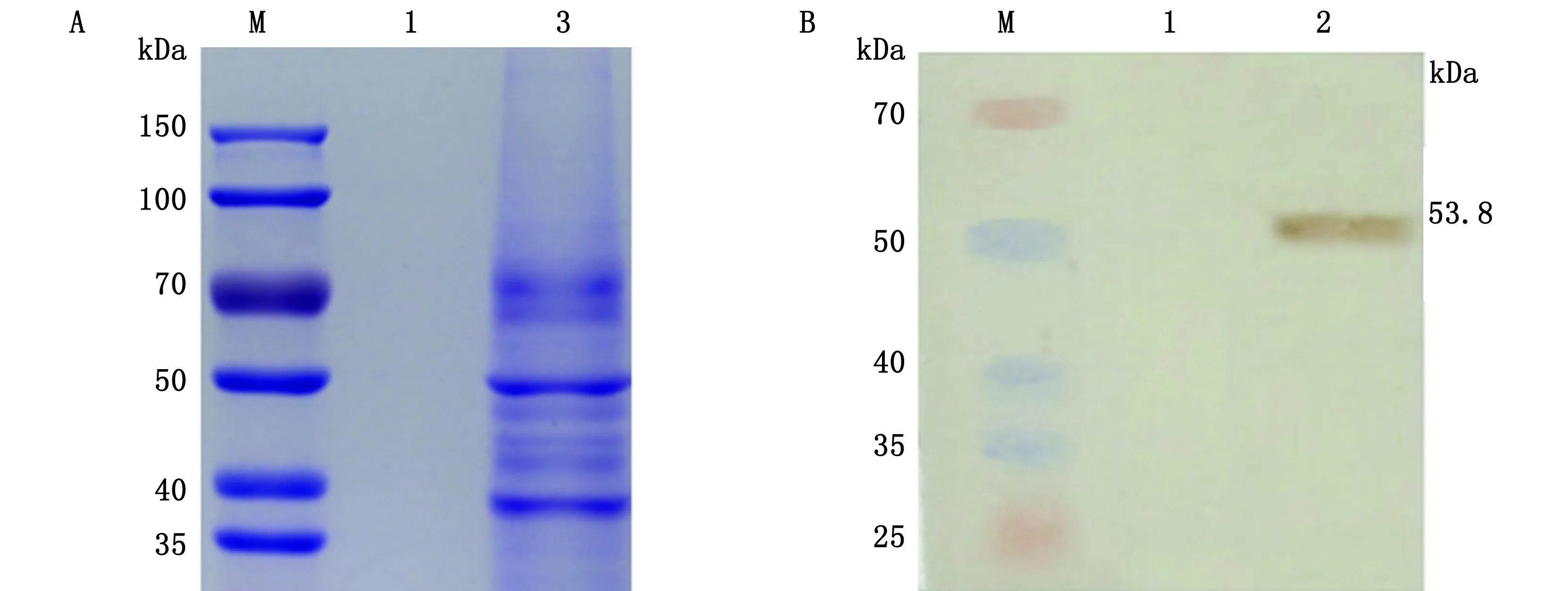
A.纯化的La Sota病毒SDS-PAGE分析; B.Western blot分析。M.蛋白Marker;1.空白对照;2.纯化的La Sota病毒
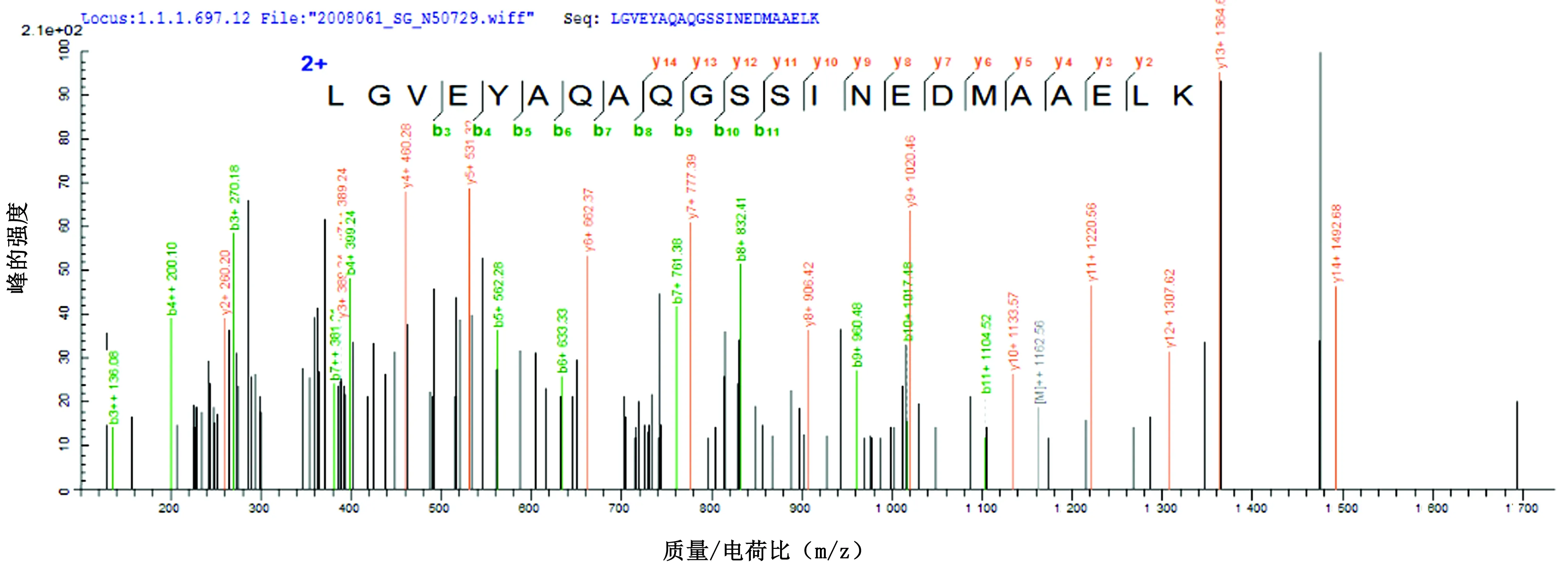
图3 结合单克隆抗体1E3的蛋白部分片段的二级质谱图
3 讨论
多年来,我国一直采用弱毒疫苗联合灭活疫苗接种来预防和控制ND的感染和传播。由于免疫程序安排不当,或者疫苗存放或使用不当等,常致免疫失败[11]。当前,ND仍是我国养禽业必须预防的禽类重大疫病之一[12]。临床诊断中,常分离到NDV,由于ND弱毒疫苗的广泛使用,很难短时间内区分分离到的NDV是流行的强毒株,还是疫苗弱毒株。
NDV强毒株和弱毒株不同的抗原性是由于强毒株和弱毒株所含抗原表位的差异所致,单克隆抗体可以特异性识别单个抗原表位,常用于NDV抗原差异性的研究[13]。ALEXANDER等[14]对单抗在毒株鉴定和分类方面进行了深入研究,应用针对病毒表面糖蛋白的单克隆抗体进行强毒株的鉴定和分型,以区别抗原性的变异。本研究筛选获得3株生长状态良好且稳定分泌抗NDV单克隆抗体杂交瘤细胞株。单抗7A8重链为IgM亚型,轻链为κ链,其对NDV La Sota株有显著的中和活性,具有重要的临床治疗潜力;1E3与NDV的强毒和弱毒存在截然不同的结合能力,可与疫苗弱毒株La Sota株发生强烈的结合反应,而与基因Ⅶ型NDV HN09-68株和经典基因Ⅸ型NDV F48E9株结合反应呈阴性。基因Ⅶ型的NDV是当前我国流行的强毒NDV的主要优势基因型。由此可见,1E3具有区分NDV流行强毒和疫苗弱毒的重要应用价值。
经SDS-PAGE电泳、Western blot、二级质谱测定,证实1E3对应的抗原为NDV的NP蛋白。通常认为,NDV的F蛋白裂解位点两侧碱性氨基酸的含量决定了NDV毒力的强弱[3]。对比NDV弱毒株La Sota株、强毒株F48E9株、HN09-68株的NP蛋白的氨基酸序列发现:La Sota株与F48E9株NP蛋白的氨基酸差异有38个氨基酸,La Sota株与HN09-68株NP蛋白的氨基酸差异有46个。胡顺林等[15]把NDV强毒株ZJ1株NP蛋白基因替换为中等毒力毒株BC株NP蛋白基因,拯救获得的重组NDV毒力显著减弱,可见,NDV毒力的强弱与NDV NP蛋白氨基酸的组成相关。DORTMANS等[16]也证实NP蛋白与NDV的毒力密切相关。提示除F蛋白外,NP蛋白变异氨基酸也可能是NDV毒力强弱分子基础的重要组成,可以利用能够识别这种变异的单抗来区分NDV毒株毒力强弱。
众所周知,NDV强、弱毒的快速鉴别一直是NDV临床快速诊断的瓶颈,区分NDV毒株毒力的强弱,常常需要测定F基因裂解位点特征序列,并进行1日龄SPF鸡脑内致病指数测定(ICPI),该方法要求较高,且费时费力[17]。单抗1E3的发现,预示可以利用1E3与疫苗弱毒株La Sota株超强的结合能力以及与经典和现行流行强毒的阴性结合反应的显著差异,研发快速诊断试纸或者夹心ELISA试剂盒,丰富NDV分离株毒力强弱的快速区分诊断工具。
