猪圆环病毒2型和4型双重PCR检测方法的建立
2021-09-10侯承尧田润博崔建涛陈红英
徐 通,侯承尧,田润博,崔建涛,赵 丽,陈红英*
(1.河南农业大学 动物医学院,河南 郑州 450002;2.河南牧业经济学院 动物医药学院,河南 郑州 450046)
猪圆环病毒2型(porcine circovirus type 2,PCV2)属于圆环病毒科圆环病毒属,是迄今为止发现的一种最小的、无囊膜的、单股环状DNA病毒,其全基因组含有1 766~1 779个碱基[1-2]。猪圆环病毒病(PCVAD)是由PCV2引起的一系列疾病的总称,主要包括患断奶仔猪多系统衰竭综合征(PMWS)、仔猪先天性震颤(CT)、猪皮炎和肾病综合征(PDNS)、猪呼吸道疾病综合征(PRDC)以及繁殖障碍疾病[3-6]。自2000年郎洪武等[7]在我国报道PCV2以来,我国猪群PCVAD频发,且死亡率不断增加,给我国养猪业造成了巨大的经济损失。
2019年ZHANG等[8]报道在患有PCVAD的猪中发现了1种新型PCV,命名为猪圆环病毒4型(PCV4)。该病毒的基因组大小为1 770 nt,其结构与PCV2相似,主要编码Cap和Rep2个基因,其中Cap基因为687 nt,编码228个氨基酸;Rep基因为891 nt,编码296个氨基酸。TIAN等[9]从患有严重临床疾病(包括PDNS、腹泻和呼吸道症状)的猪中鉴定出PCV4,表明PCV4与PCVAD密切相关。
PCV2感染可引起猪免疫抑制,临床上经常出现 PCV2 与猪其他病原共感染,使PCVAD的临床表现变得复杂,且发病猪死亡率增加[10-11]。已有多个研究表明临床上PCV4常与PCV2混合感染[8-9]。为了监控PCVAD疫情,急需建立一种快速、准确、操作简单、灵敏和特异的PCV2/4检测方法。目前PCV2和PCV4已有单一PCR检测方法,迄今尚未有同时检测2种病原的方法。因此,本试验建立了一种特异、灵敏且同时检测和鉴别PCV2/4的双重PCR方法,为监测PCV2/4在我国的发生与流行提供分子诊断技术支持,对于PCV2/4的流行病学调查具有重要现实意义。
1 材料与方法
1.1 病毒株和临床样品PCV2、伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、猪流行性腹泻病毒(PEDV)、猪瘟病毒(CSFV)、猪传染性胃肠炎(TGEV)、大肠杆菌(E.coli)、猪伤寒沙门菌(Salmonellatyphisuis)均保存于郑州猪重大疫病防控重点实验室。利用本试验室田润博等[12]建立的单一PCR方法对保存于郑州猪重大疫病防控重点实验室的病料进行PCV4检测,对检测为阳性的病料进行扩增、测序,作为PCV4阳性对照。
2018—2020年,从河南、山西不同地区猪场,采集60份疑似PCV感染的组织样品(包括脾、淋巴结和肝脏)。取适量组织,经研磨后反复冻融3次,12 000 r/min 离心5 min,-80℃保存备用。
1.2 主要试剂UNIQ-10柱式病毒基因组DNA抽提试剂盒购自生工生物工程(上海)股份有限公司;SanPrep柱式质粒DNA小量抽提试剂盒购自康为世纪生物科技有限公司;微柱浓缩DNA凝胶回收试剂盒购自北京庄盟国际生物基因科技有限公司;2×Taq Master Mix 购自南京诺唯赞生物科技有限公司。
1.3 引物设计参照GenBank中收录的PCV2(EU148503、HM038017、KX828234、KX831480)和PCV4(MK986820)全基因序列,用Megalign(DNA Star)进行比对,针对PCV2Rep基因和PCV4Cap基因高度保守区域,利用引物设计软件Primer 5.0,分别设计1对特异性检测引物P1F/R和P2F/R (表1),用于扩增PCV2(264 bp)和 PCV4 (391 bp)。引物由武汉奥科鼎盛生物科技有限公司合成。
1.4 单一PCR扩增及标准阳性质粒的构建病毒基因组DNA抽提试剂盒提取病毒DNA,利用引物P1F/R和P2F/R分别对PCV2和PCV4扩增。反应体系均为25 μL:2×Taq Master Mix 12.5 μL、上下游引物各0.5 μL、模板2 μL、ddH2O补充至25 μL。反应程序为95℃ 5 min;95℃ 25 s,55℃ 25 s,72℃ 35 s(共35个循环);72℃ 10 min。PCR反应结束后,用1%凝胶电泳检测扩增结果。
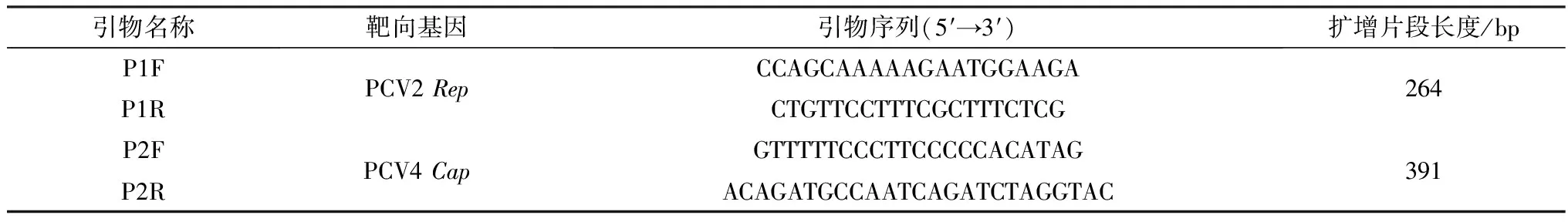
表1 双重PCR引物序列
利用微柱浓缩DNA凝胶回收试剂盒对PCR扩增产物进行纯化回收,并与 pMD18-T连接。将连接产物转至DH5α感受态细胞,将鉴定为阳性的菌落扩大培养,提取重组质粒(pMD18-PCV2和pMD18-PCV4)进行测序,并将测序结果与GenBank登录的参考序列进行同源性对比。用紫外分光光度计分别测定2种阳性重组质粒的浓度,同时计算其拷贝数。
1.5 双重PCR检测方法的建立与条件的优化对双重PCR检测方法的引物浓度比例、退火温度(53~63℃)、时间(变性、退火、延伸)进行摸索,最后得出最佳反应条件。
1.6 双重PCR特异性试验以PCV2、PCV4、CSFV、PPV、PEDV、TGEV、PRRSV、PRV、E.coli、Salmonellatyphisuis的核酸为模板,同时设立阴性对照,用1.5建立的双重PCR方法进行扩增,以检测该双重PCR方法的特异性。
1.7 双重PCR的灵敏性试验将质粒pMD18-PCV2和pMD18-PCV4等体积混合,将混合的质粒进行10倍系列稀释。通过1.5中摸索的最佳条件,以各个稀释度的标准质粒作为模板进行PCR扩增,以检测本方法的灵敏度。
1.8 双重PCR方法的重复性试验对来自不同地区的3份PCV2和PCV4混合感染的病料,通过1.5建立的双重PCR检测方法进行扩增,并且在随后的2周内重复3次,以检测该方法的重复性。
1.9 临床样品检测利用双重PCR检测方法,对采自河南和山西的洛阳、濮阳、焦作、许昌、汶水等10个地级市16个养殖场的60份病料进行检测,并与单一PCR检测结果作比较,评价其临床实用性。
2 结果
2.1 单一PCR扩增结果利用P1F/R和P2F/R对PCV2和PCV4阳性病料DNA进行PCR扩增,琼脂糖凝胶电泳结果显示,扩增的片段位置约在264 bp (PCV2)和391 bp (PCV4)处(图1),与预期大小相符。将单一PCR纯化产物连接到pMD18-T并测序,测序结果与参考序列之间的同源性为99%以上,表明PCR产物为PCV2和PCV4的目的片段。
2.2 双重PCR扩增条件优化及扩增结果通过对双重PCR扩增条件的摸索,最终确定反应体系为25 μL:2×Taq Master Mix 12.5 μL,P1F/R各0.7 μL,P2F/R各0.3 μL,模板2 μL,ddH2O补充至25 μL。反应程序为95℃ 5 min;95℃ 25 s,56℃ 25 s,72℃ 30 s(35个循环);72℃ 10 min。
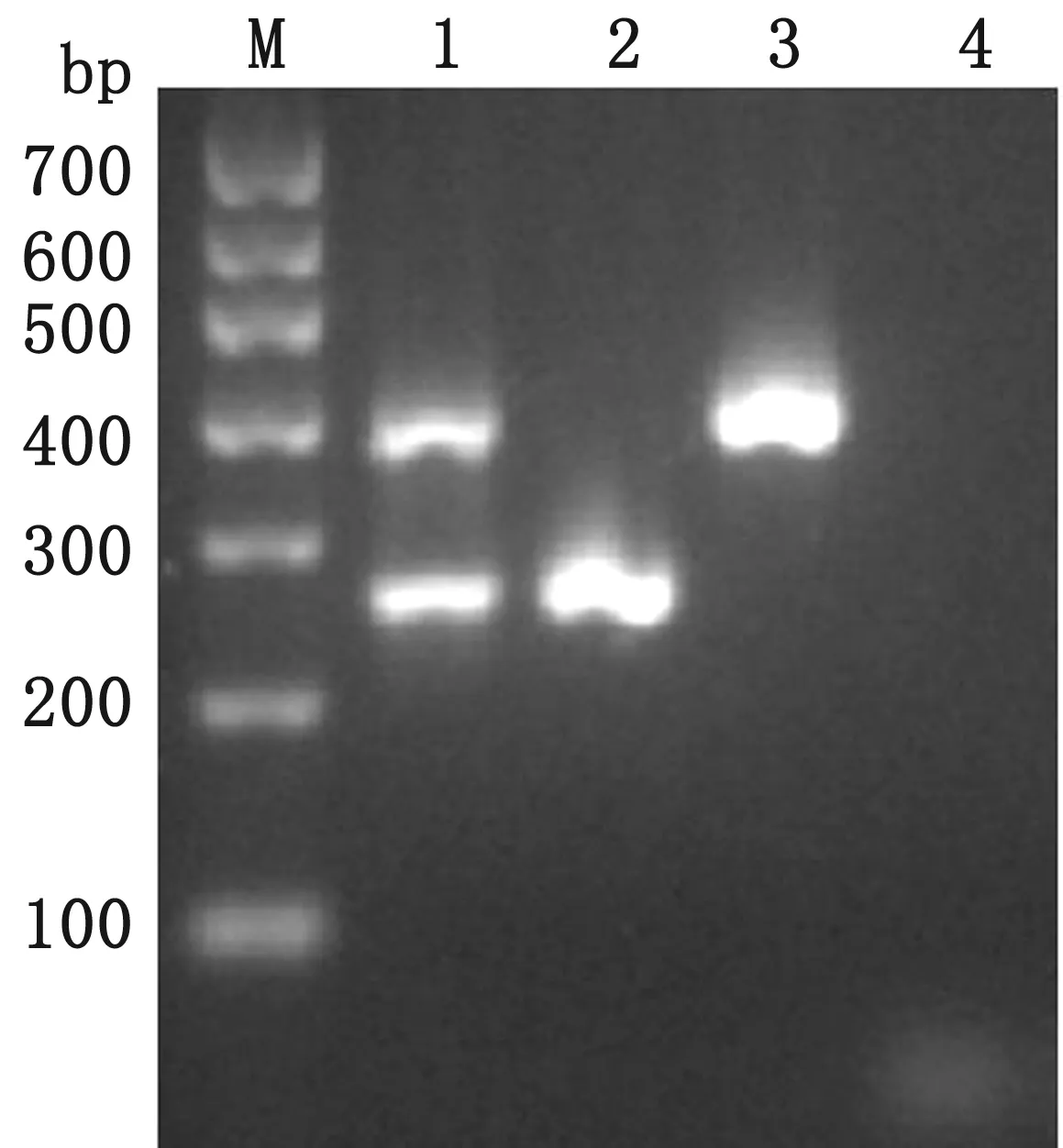
M.DL1000 DNA Marker;1.PCV2/4双重PCR产物;2.PCV2产物;3.PCV4产物;4.阴性对照
2.3 双重PCR的特异性试验结果利用已优化的双重PCR方法对PCV2/4、CSFV、PPV、PEDV、TGEV、PRRSV、PRV、E.coli和Salmonellatyphisuis核酸进行扩增,同时设立阴性对照。结果显示,PCV2/4混合模板扩增出了2个条带(图2),大小分别为264(PCV2)和391 bp(PCV4),而其他病原的核酸及阴性对照均未出现特异性条带,表明该方法具有良好的特异性。

M.DL1000 DNA Marker;1.PCV2/4 PCR产物;2~9.CSFV、PPV、PEDV、TGEV、PRRSV、PRV、E.oli、Salmonella typhisuis PCR产物;10.阴性对照
2.4 双重PCR的灵敏度试验结果经紫外分光光度计测量标准阳性质粒的浓度,计算出PCV2/4的拷贝数分别为6.11×1010,5.49×1010拷贝/μL。将2种标准阳性质粒(pMD18-PCV2和pMD18-PCV4)等体积混合,然后进行10倍系列稀释。以10-1~10-10稀释浓度的混合质粒为模板,ddH2O为阴性对照,进行双重PCR扩增。PCV2/4混合质粒在10-9稀释浓度时能扩增出目的条带,最低检测限分别为61.1,54.9 拷贝/μL,表明该方法具有很好的敏感性(图3)。

M.DL1000 DNA Marker;1~10.PCV2/4混合阳性模板10-1~10-10梯度稀释后扩增结果;11.阴性对照
2.5 双重PCR重复性试验结果通过已优化的双重PCR方法对来自不同地区的3份PCV2/4混感病料的DNA进行扩增,同时设立阴性对照,并在不同的时间段做3次重复,每次检测结果都是PCV2/4为阳性,表明本试验所建立的方法具有良好的重复性。
2.6 临床诊断应用利用本试验建立的双重PCR方法对从山西和河南省不同地区采取的60份临床样品进行检测,结果显示PCV2的检出率为51.67%(31/60),PCV4的检出率为18.33%(11/60),混合感染检出率为16.67%(10/57),双重PCR检测结果与单一PCR检测结果一致,表明该方法可用于临床检测。
3 讨论
目前,PCV2仍然在我国大多数省份流行,且各个地区PCV2阳性检出率存在一定差异[13-15]。ZHANG等[8]从患有PCV的病料中发现一种新型的猪圆环病毒,命名为PCV4,而且本试验从1份患有PMWS的仔猪检测出PCV4,而未检测到PCV2和PCV3,表明PCV4可能与PCV有关。PCV4在河南、四川、山西省等多个省份广泛存在,而且PCV2和PCV4存在混合感染[8-9]。因此,为了更好地防控PCVAD,临床上迫切需要建立一种可以同时检测这2种病毒的PCR方法。
田润博等[12]建立检测PCV4的单一PCR检测方法,而无法检测临床上出现的PCV2和PCV4混合感染。已有研究者分别建立了针对PCV2和PCV4的荧光定量PCR方法[16-17],但荧光定量PCR方法成本和操作要求都比较高,很难满足实际生产中养猪业大批量样品的检测。因此,本试验建立了一种快捷、操作简单且成本低的双重PCR方法,为实际生产中PCV2/4的防控提供技术支持。
针对PCV2检测引物设计时,发现PCV1在Rep基因的65~73 bp处有9个碱基缺失,而在这段序列附近PCV2各基因型毒株之间相对保守。因此,将PCV2检测引物P1F的3′端设计在这个区域,既可以确保扩增PCV2不同基因型,又可以避免因PCV1引起的非特异性扩增。本试验进行一系列引物浓度比摸索时,发现P2F/R的扩增效率高于P1F/R,当P1∶P2引物浓度比为7∶3对扩增效果最佳。同时对退火温度、时间(变性、退火、延伸)进行优化。通过优化后的PCR方法扩增出的片段分别在264 (PCV2)和391 bp(PCV4)的位置,相差127 bp,凝胶电泳成像仪中能够清晰地分辨出两种病原体。而其他8种常见的病原体检测为阴性,并且本试验在不同的时间段做3次重复,每次结果一致,说明本试验所建立的双重PCR检测方法具有良好的特异性。本试验对3份PCV2/4混合感染样品在不同的时间段重复3次,每次单一PCR方法和双重PCR方法扩增结果完全一致,说明该方法具有良好的重复性和准确性。本试验的灵敏度检测结果显示PCV2最低检测限为61.1拷贝/μL,这与周忠涛等[18]建立的PCV2的PCR检测下限相当;PCV4最低检测限为54.9 拷贝/μL,与田润博等[12]建立的检测PCV4的PCR方法检测下限相当,说明本试验建立的双重PCR方法具有良好的灵敏度。
运用本试验建立的双重PCR方法,对河南洛阳、焦作、济源和山西地区汶水、长治等10个地市16个猪场收集的60份病料样品进行检测,PCV2的检出率为51.67%(31/60),PCV4的检出率为18.33%(11/60),PCV2/4混合感染的检出率为16.67%(10/60),双重PCR结果与单一PCR结果完全一致,表明PCV2和PCV4在河南和山西存在单独感染和混合感染的情况且比较严重,应加强对其的检测及防控。PCV2是PCVAD的主要致病原,但单独感染PCV2很难复制出PCVAD临床症状[19]。DORRD等[20]报道大多数PCVAD由PCV2和其他猪病原共感染引起的,仅少数PCVAD由 PCV2单独感染引起。而且,其他猪病原与PCV2有协调作用,能增强PCV2对所感染组织器官所造成的损伤,还会提高PCVAD的传播风险[10-11]。推测PCV4与 PCV2共感染可能会引起PCVAD,并且使发病猪病情加重、病死率增加,给养猪业带来更大的危害。
目前PCV4没有被分离出来,从本试验的临床检测结果可以看出,PCV4可能是PCV的病原之一,且PCV2/4混合感染已经存在于国内山西、河南、四川等多个省份,可能促进PCVAD在我国的传播。本研究建立了一种特异性好、灵敏度高且成本低易操作的双重PCR方法,可达到单重PCR检测效果的同时极大地节约试验成本,更符合临床上大批量样品诊断的需求,大大减少检测时的任务量,为我国临床上PCV2/4的检测和防控提供技术支持。
