根际激发效应对土壤有机碳累积及分解的影响
2021-09-10莫朝阳张鑫林杨京平
莫朝阳,张鑫林,杨京平
(浙江大学环境与资源学院,杭州 310058)
土壤呼吸是陆地生态系统与大气之间碳流动的 主要途径,是土壤碳固存的重要调节因子[1],其占整个陆地生态系统呼吸的60%~90%,是大气二氧化碳(CO2)的重要来源[2-3]。与纯土培养相比,植物根系的存在可抑制或加速土壤有机质的分解(-50%~380%)[4],这种现象被称为根际激发效应(rhizosphere priming effects,RPE)。根际激发效应普遍存在于土壤中,调节着根际养分的可利用性并影响着土壤碳库。
土壤有机碳可通过高密度溶液进行密度分级,可分为轻组有机碳和重组有机碳,其中密度低于1.7 g/cm3的组分为轻组有机碳,密度高于1.7 g/cm3的组分为重组有机碳[5]。之前的大多数根际激发效应研究中,并未将土壤有机碳分为轻、重组有机碳,而这样的分组在研究根际激发效应对土壤有机碳动态的影响上至关重要[5]。重组有机碳是土壤碳库的重要组成部分,比轻组有机碳有更长的平均停留时间。重组有机碳被认为是大部分与土壤矿物质有关的顽固碳源,与轻组有机碳相比,它对固存土壤碳更为重要[6]。轻组有机碳基本上由部分分解的植物、动物和真菌残留物组成[7],是总土壤碳库更敏感的不稳定组分[8]。
尽管很多研究已经揭示根际激发效应能够促进土壤原有的有机碳分解[9],但这部分分解的碳是由活性碳库还是惰性碳库或者二者共同引发的,目前还不明确。此外,根系分泌物为微生物提供了大量能源和碳源。研究表明,土壤有机碳总输入的30%~40%来自根分泌物和死亡的根,在根际激发效应产生过程中依然有一部分根际分泌碳残留在土壤中,从而弥补因激发效应引起的碳损失[10-12]。因此,这部分碳的去向至关重要。如果根际激发效应促进了土壤中原有的有机碳矿化,而残留的根系分泌物滞留在易分解碳库中,那么土壤有机碳的增加可能是一种假象,随着可利用碳库的消耗,这部分根系分泌物碳还是会很快被释放到大气中,因而根际激发效应对土壤有机碳的影响依然较大。相反,如果这部分碳进入了惰性碳库,那么根际激发效应并没有因促进土壤有机碳分解而影响土壤有机碳的截留[12]。因此,本研究通过玉米和高粱的盆栽实验,探索土壤轻、重组有机碳对根际激发效应的敏感性,为降低大气CO2排放及提高土壤碳固存提供理论指导。
1 材料与方法
1.1 实验设计

2种供试土壤分别采自长期种植水稻与小麦的农田,即浙江省杭州市西湖区袁浦镇老沙村(水稻土)和陕西省西北农林科技大学农作一站长期定位试验地(小麦土)。选取种植水稻和小麦20 年以上的表层土壤(0~20 cm土层),取土时将土壤中石块以及作物残根、枯枝落叶等去除,风干后过4 mm筛,备用。供试土壤性质见表1。

表1 供试土壤性质Table 1 Properties of the tested soil
1.2 实验装置
实验使用聚氯乙烯(polyvinyl chloride,PVC)土柱盆栽(图1),内面直径为20 cm,高30 cm,底部采用纱网护垫,铺上一层2 cm厚的砂石(砂石粒径3~5 mm,用1 mol/L HCl 浸泡24 h,自来水洗净后晾干备用)以保证土壤通风和CO2的吸收。将风干的2种土壤(筛分孔径<4 mm,各5 kg)填装入每个土柱盆栽中,用去离子水将土壤湿度调节至最大田间持水量的60%(采用室内环刀法测定土壤田间持水量后,计算得出需添加的水量),并在网室自然条件下预培养1 周,以稳定土壤。种子预培养3 d 后种下,每个土柱盆栽中种植3 颗种子。待作物幼苗长至10 cm 高时进行间苗,保证实验开始时每个土柱盆栽中有一株10 cm高的幼苗。
以硫酸铵作为氮肥,施氮水平为N 225 kg/hm2,以水溶液形式输入,施用量为1/3氮肥作为基肥,2/3氮肥在拔节期追施。此外,为确保作物正常生长,在移栽25 d后(比当地农业肥料管理时间晚2 d),向所有处理中施以过磷酸钙溶液(土壤水平为P 625 mg/kg,田间水平为P 75 kg/hm2)和氯化钾溶液(土壤水平为K 100 mg/kg,田间水平为K 60 kg/hm2)。
1.3 CO2吸收
采用图1 所示的循环系统对CO2进行吸收;采用13C 自然丰度法来区分源于根系和源于土壤有机碳的CO2。测定土壤呼吸速率时,塑料板与植物根部及塑料板和盆缘的空隙用密封条密封,然后用无毒密封硅胶铺在塑料板与密封条组成的密封表面上,确保每盆土壤表面得到密封,随后堵住浇水管,打开蠕动泵,采用150 mL 1 mol/L NaOH 溶液吸收进气中的CO2,以去除实验起始时装置内的CO2。使用150 mL 1 mol/L NaOH溶液吸收密封后每盆装置产生的CO2,循环系统间隔时间为6 h,循环时间为30 min,共进行2 d。每个密封PVC 盆内产生的所有CO2通过NaOH 溶液进行吸收,同时设置空白校正实验。
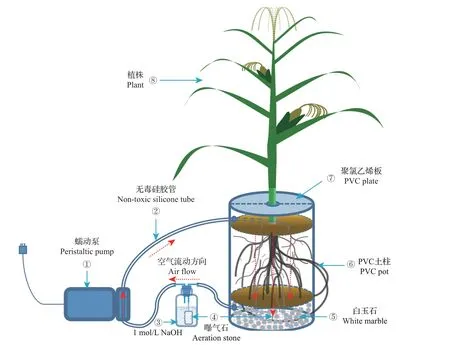
图1 封闭循环的CO2吸收系统Fig.1 CO2 trapping system in closed circulation
实验得到150 mL CO2吸收液,从中量取20 mL,向其加入20 mL 1 mol/L SrCl2溶液,然后使用浓度为1 mol/L的HCl进行滴定,分析并计算总CO2吸收量。另取20 mL吸收液于离心管中,向其加入20 mL 1 mol/L SrCl2溶液,随后以8 000 r/min 离心10 min,弃上清液;加入20 mL去离子水,以4 000 r/min离心10 min,弃上清液;烘干、研磨SrCO3,利用同位素质谱仪测定13C丰度值。
在捕获CO2后,立即将植物分离成植株和根,并使土壤分散均匀,从种植盆栽中取出细根,采集新鲜土壤样品。对每个土柱盆栽的植株和根进行清洗,并于105 ℃条件下杀青,再在60 ℃烘箱中烘干48 h,称量、研磨后,测定其13C 丰度值。此外,对所有处理的土样进行风干,研磨后过2 mm筛,备用。
1.4 轻、重组有机碳的测定
对过筛后的干土进行轻、重组有机碳的分离[13]。取5 g 风干土壤,置于含有20 mL 1.70 g/cm3NaI 溶液的离心管中,用涡旋仪振荡离心管3 min,然后以1 000 r/min 离心10 min,将上清液放入装有玻璃纤维滤纸(英国Whatman 公司)的抽滤漏斗中。重复上述过程至少2 次,直到没有多余的漂浮物。用去离子水彻底冲洗玻璃纤维滤纸上的样品并收集过滤物,此时收集到的过滤物为轻组有机碳[14]。将过滤物在60 ℃条件下干燥24 h后,置于研钵中精细研磨,然后进行有机碳含量分析。
残留在离心管底部的物质为重组有机碳。将其定量洗涤到一个单独的漏斗中,用去离子水(约300 mL)反复漂洗重馏分,并在60 ℃条件下干燥48 h,然后将重馏分材料在研钵中研磨以进行有机碳分析。其中,小麦土为碱性,在进行轻、重组有机碳含量分析测试之前,需用1 mol/L HCl溶液进行酸洗,以去除土样中的无机碳成分。
1.5 数据统计与分析
采用双源模型将土壤总呼吸分为土壤有机碳分解和根系呼吸;采用下列公式计算土壤总呼吸、源于土壤有机碳及根系呼吸的CO2碳通量。

式中:C土壤为源于土壤有机碳的CO2碳通量,mg/(kg•d);C总为土壤呼吸的CO2总碳释放量,即150 mL 吸收液中的总CO2碳通量,mg/(kg•d);C根为源于根部呼吸的CO2碳通量,mg/(kg•d);δ根为源于根部呼吸的CO2的13C 丰度值,‰,利用作物根部生物量的13C 丰度值代替;δ总为土壤呼吸释放的CO2的13C 丰度值,‰;δ土壤为源于土壤有机碳的13C 丰度值,‰,通过未种植物处理组测定。
13C 自然丰度法的原理是植物根系和土壤具有不同的13C丰度值,根据这一区别估计各来源的碳贡献率[15],该方法的使用建立在纯根呼吸的13C丰度值与根系组织呼吸的13C丰度值差异不大的前提下[16]。
将根际激发效应强度(C激发)量化为种植植物处理(C土壤-种植作物)和未种植物处理(C土壤-未种植作物)之间的碳排放差异,由以下公式计算:

实验所得数据采用统计分析软件SPSS 26.0 进行处理,采用三因素方差分析方法分析土壤类型、作物种类及生育期对根际激发效应强度等指标的影响,采用单因素方差分析方法分析在同一生育期和土壤类型中不同处理间的差异。
2 结果与分析
2.1 CO2排放量及根际激发效应
如图2所示:在所有处理中,水稻土中未种植作物时,来源于土壤有机质的CO2碳通量最少,为6.75 mg/(kg•d);在大喇叭口期,种植玉米的水稻土中来源于土壤有机质的CO2碳通量最多,达到18.49 mg/(kg•d)。在拔节期和大喇叭口期,未种植植株的小麦土释放的碳量接近;而在大喇叭口期,未种植植株的水稻土释放的碳量远高于同种处理拔节期。由此可得,土壤类型、取样时间对土壤有机质分解有显著影响。此外,在同一时期的小麦土中,种植玉米对土壤有机质分解的促进效果显著优于高粱(P<0.05)。

图2 不同处理中来源于土壤有机质的CO2碳通量Fig.2 CO2-C flux derived from soil organic matter in different treatments
通过双源模型计算得到根际激发效应强度。从图3可知,种植高粱后,根际激发效应强度为2.34~3.17 mg/(kg•d),种植玉米后,根际激发效应强度在4.09~6.84 mg/(kg•d)之间。小麦土中,大喇叭口期的样本相比拔节期样本产生的根际激发效应更强(P<0.05)。总体而言,玉米产生的根际激发效应均强于高粱(P<0.05)。

图3 不同处理间根际激发效应强度Fig.3 Intensity of rhizosphere priming effects in different treatments
2.2 土壤有机碳组分对根际激发效应的影响
2.2.1 轻组有机碳含量的变化
由图4可见:在所有处理中,土壤轻组有机碳含量为0.17~1.43 g/kg。在对照组土壤样品中,轻组有机碳保持恒定状态,而且小麦土的轻组有机碳含量远高于水稻土(P<0.05)。种植作物后,在高粱-水稻土中,拔节期的轻组有机碳大量积累;在大喇叭口期,水稻土中轻组有机碳的分解大于合成,导致高粱组轻组有机碳含量减少。在高粱-小麦土中,随着作物生长,土壤中轻组有机碳含量升高,而在玉米-小麦土中,轻组有机碳含量下降(P<0.05)。
在拔节期,玉米-水稻土中积累的轻组有机碳低于高粱-水稻土,而在小麦土中,种植玉米后积累的轻组有机碳高于种植高粱的。伴随着作物生长,玉米-水稻土中的轻组有机碳有所积累,但在玉米-小麦土中,轻组有机碳的消耗远远大于作物输送的碳,轻组有机碳含量急剧下降(图4)。
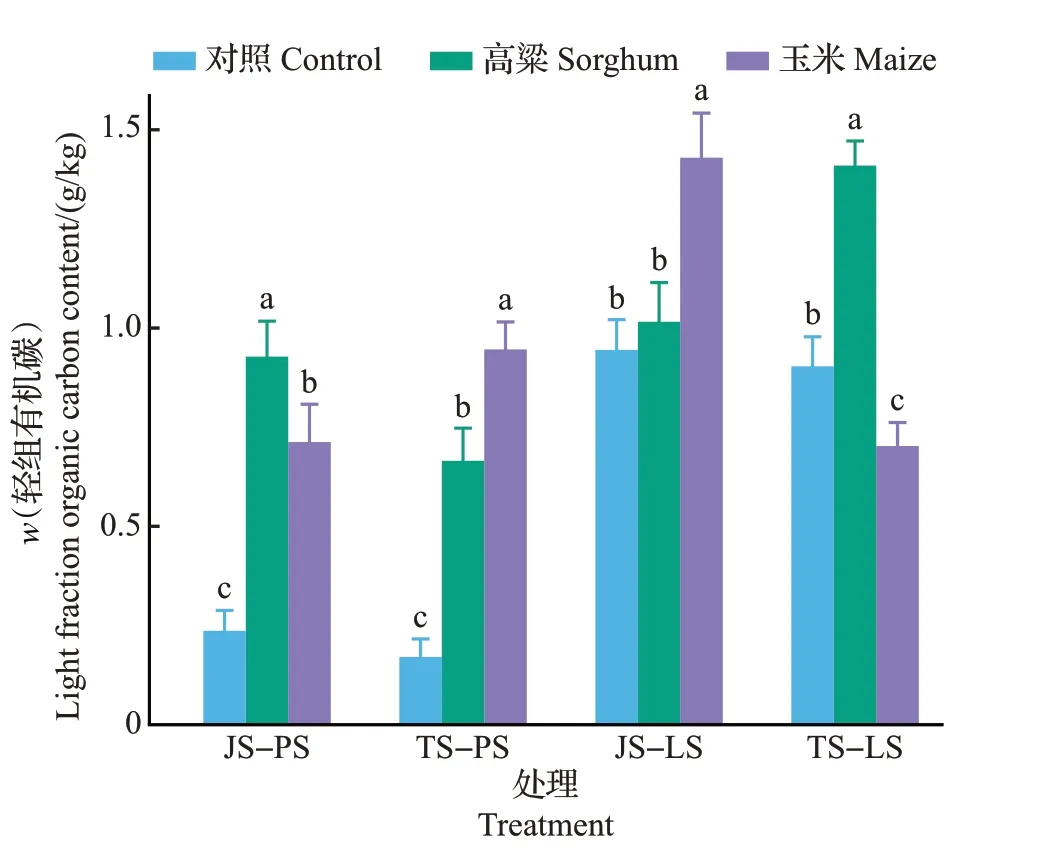
图4 不同处理中土壤轻组有机碳含量Fig.4 Contents of light fraction organic carbon of soil in different treatments
2.2.2 重组有机碳含量的变化
从图5中可以看出,在所有处理组中,原有重组有机碳为10.31~16.67 g/kg,水稻土的重组有机碳含量高于小麦土(P<0.05)。相同土壤中同一时期内所有样品的重组有机碳含量没有显著性差异(P>0.05),作物对于重组有机碳含量的影响不显著;而在不同的时期内,种植同一作物后土壤重组有机碳含量也保持在稳定状态。
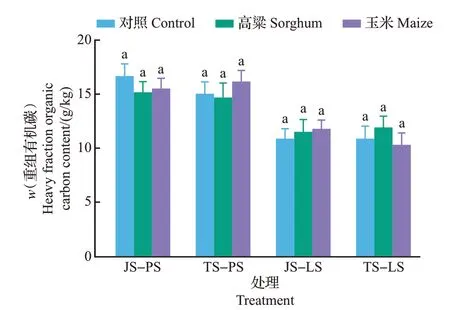
图5 不同处理中土壤重组有机碳含量Fig.5 Contents of heavy fraction organic carbon of soil in different treatments
3 讨论
3.1 根际激发效应与影响因素的关系
与对照土壤相比,种植植物后土壤有机质分解率明显增加。高粱和玉米产生的根际激发效应在所有处理中为17.5%~76.0%,其强度与以往的实验结果相当[4]。不同处理间根际激发效应强度与作物种类的关系更大,作物种类是其主要影响因素(P<0.05)。但土壤类型、取样时间对根际激发效应的影响也是不可忽视的[9],然而本实验并未观测到土壤类型和取样时间对根际激发效应的显著影响。
在本实验的2 种供试土壤中,玉米的根际激发效应强于高粱,这可能是由于玉米的根系较高粱发达,从而形成更加庞大的根系网络;且玉米相较于高粱可能分泌了更多的根系分泌物,对根际微生物进行了更多的活化[17],从而产生了较强的根际激发效应。
这些研究结果表明,植物和土壤之间可通过根际激发效应的内部机制来有效控制土壤有机质分解,这种相互作用在控制土壤有机质分解中的重要性正日益被科学界所认识。
3.2 轻、重组有机碳与根际激发效应的关系
根际激发效应对土壤轻组有机碳含量的影响巨大。一方面,根际激发效应会增加微生物数量和活性,促进有机碳的分解;另一方面,当土壤的氮素有效性受到限制时,植物会转移较多的光合产物到地下,根际微生物可以利用根际沉积物获取碳和能量,并由此引发正的根际激发效应[9-11],从而根际土壤的根系分泌物会增加,导致轻组有机碳的含量增加。因此,轻组有机碳含量的变化既受到植物生长状态的影响,又受到微生物数量和活性的影响,二者共同作用影响轻组有机碳的分配。
重组有机碳含量反映土壤碳库的动态变化,对调节气候变化和全球碳循环起重要作用[5]。然而,本实验由于作物植株较少,实验持续周期短,土壤重组有机碳库组分含量未发生足够量变,重组有机碳含量在实验期间保持恒定,不能突显根际激发效应在短期内对重组有机碳的贡献。因此,本实验中的根际激发效应研究更着眼于轻组有机碳的变化趋势对其的作用,而和轻组有机碳相比,重组有机碳在实验过程中始终维持一定的值,根际激发效应对其基本没有影响。
4 结论
由实验结果可知:种植作物会导致土壤原有的有机碳分解,引发根际激发效应;作物种类对土壤有机碳分解有显著影响,其中玉米较高粱更能促进土壤有机碳分解,而土壤类型和取样时间对根际激发效应强度无显著影响;根际激发效应主要影响轻组有机碳含量,而在短期内,其对重组有机碳的含量无显著影响。除此之外,在根际激发效应发生过程中,作物向土壤中输送的根系分泌物的去向也是影响土壤碳库变化的一个重要因素。今后的研究需要利用13C同位素丰度值区分轻、重组有机碳的组成中,哪些是新形成的有机碳,以便更深入地解释作物种植及根际激发效应过程中轻、重组有机碳的动态变化。
