低温对桂花万点金叶肉细胞超微结构的影响*
2021-09-10尤扬张晓云
尤扬,张晓云
1. 河南科技学院园艺园林学院,河南新乡 453003
2. 河南省特色园艺植物开发利用工程技术研究中心,河南新乡 453003
桂花Osmanthus fragrans为木犀科木犀属常见园林植物,原产中国西南地区,在秦岭、淮河以南等地均可露地越冬,河南新乡为其自然分布的北线[1]。据南京林业大学国际木犀属品种登录权威向其柏教授研究,目前获得国际品种登录的桂花共有166 个品种。在这166 个桂花品种中,绝大多数分布于中国南方地区,北方地区由于低温和盐碱的影响,分布甚少。万点金为金桂品种群桂花,主要分布在江浙一带,为小乔木或丛生大灌木,高达5~7 m;叶片长椭圆形,基部宽楔形,尖端长渐尖,全缘叶常因叶缘波状而皱;着花密集呈一个个花球,花深黄色或略呈浅橙黄色,雌蕊完全败育而不结实;花期9 月下旬至10 月中旬[2]。
目前对桂花研究多集中于冻害调查[3]、低温胁迫下生理生化指标的测定[4]、分子生物学研究[5]和野桂花群落调查[6]等方面。有关桂花叶片光学显微镜下的解剖结构偶有报道[7],而北引桂花模拟外界低温环境胁迫处理后叶片超微结构的研究鲜有报道[8]。本研究以从浙江金华引种到河南新乡栽植的桂花品种万点金为材料,采用超薄切片法,通过透射电子显微镜观察拍照,研究一系列低温胁迫下万点金叶肉细胞的超微结构,摸清低温胁迫下叶绿体、线粒体及溶酶体等细胞器的变化规律,以期在细胞学水平上厘清北引桂花叶肉细胞中细胞器的变化规律,为桂花的合理栽培及耐寒性鉴定提供依据,也为桂花品种耐寒性筛选提供一定的理论参考。
1 材料与方法
1.1 仪器和试剂
HITACHI-HT7700 型透射电子显微镜;LEICA EMUC7 切片机;智能人工气候室;超净工作台;包埋板;磁力搅拌器等。0.1 mol·L-1的磷酸缓冲液(PBS);φ=4% 戊二醛;系列体积分数梯度乙醇;φ=1.0 %锇酸固定液;Epon 812;柠檬酸铅染色液;醋酸双氧铀染色液等。
1.2 供试材料及低温处理
桂花万点金O. fragrans‘Wandian Jin’幼苗从浙江金华引种到河南新乡,3 年生扦插苗,苗高100 cm 左右。引种苗栽于陶质盆钵之中,盆高为20 cm,盆口直径为30 cm,盆内土壤养分含量如下: 碱 解 氮 含 量79.6 mg·kg-1, 速 效 磷 含 量28.6 mg·kg-1,速效钾含量205.2 mg·kg-1,土壤容重1.29 g·cm-3,有机质含量为0.93%。桂花苗木日常土、肥、水、病虫害等的管理措施同大田生产。
对照及低温处理:对照材料于25 ℃常温下取样,叶片直接用φ=4%戊二醛固定。在低温胁迫前先把各处理的5 株盆栽万点金幼苗于10 ℃下预冷处理48 h;在智能人工气候室中进行模拟低温处理:温度依次设定为5、0 和-5 ℃;光照强度设置为150 μmol·m-2·s-1,光照时间设定为12 h;温度下降速率设定为每10 min下降1 ℃,当温度降至既定温度时保持48 h后立即进行取样固定。
1.3 叶片细胞超薄切片制备
试验参照李和平[9]的方法进行超薄切片的制备,略有改动。每个低温处理随机选取5株万点金盆栽幼苗的3 个枝条,从该枝条顶端向下数第3 或4 片叶(健壮、无病虫害)取样:在事先预冷的石蜡面板上和叶片拟取样部位各滴上一滴预冷的φ=4%戊二醛溶液,使得取样部位完全接触到φ=4%戊二醛溶液;在叶片取样部位用Leica 刀片避开叶片主脉快速切取1.0 mm×0.5 mm 大小的组织块,立即用预冷过的医用镊子谨慎地把材料转移到事先装有φ=4%预冷戊二醛溶液的青霉素小瓶中;用医用注射器(20 mL)抽气20 min 左右至绝大多数组织块下沉至瓶底部为止,材料置于冰箱上层4 ℃条件下前固定6 h;用0.1 mol·L-1的磷酸缓冲液(PBS,pH 为7.0)冲洗3 次,每次30 min;用锇酸(φ=1.0%)进行后固定6 h;再用同种磷酸缓冲液漂洗3 次,每次30 min;乙醇溶液系列脱水(由于材料较嫩,从较低的体积分数开始)30%、50%、70%、80%、90%、95%和100%(重复一次),每个梯度30 min;丙酮过渡;环氧树脂Epon812 渗透、包埋;于35、45 和60 ℃下分别聚合12、12、和48 h;用LEICA EMUC7 型超薄切片机钻石刀切片;25 ℃下进行醋酸双氧铀—柠檬酸铅双重染色;HITACHI-HT7700 型透射电子显微镜下观察拍照,每个处理取20个观察视野进行研究。
2 实验结果
2.1 常温下万点金叶肉细胞超微结构
桂花万点金在常温(25 ℃)下叶肉细胞的解剖结构如图1所示:细胞结构正常,细胞壁清晰完整(图1-A,图1-B)。细胞核被中央大液泡挤向了细胞边缘,核膜完整清晰,电子密度较高的核仁呈不规则棱柱状,位于核的近似中央部位(图1-A,图1-B)。观察视野中非导管细胞叶绿体数量为1~13个,叶绿体结构完整,呈饼状或凸透镜状分布于细胞壁的内侧,叶绿体膜清晰可辨,由于尚未形成基粒内囊体结构,这种叶绿体为前叶绿体(图1-B)。叶绿体内有少量白色的淀粉粒和电子密度较高的嗜锇体(图1-B)。观察视野中单个细胞内线粒体数量为0~4 个。叶肉细胞中还发现少许初级溶酶体(图1-C):单层膜围绕的囊状细胞器,球形,内容物均一;常温下万点金叶肉细胞次级溶酶体的数量较少。观察视野中单个细胞溶酶体的数量为2~6 个。试验中发现了环纹导管的纵切结构,每隔一定的距离有一木化增厚的次生壁结构加在导管里面的初生壁上(图1-D);在导管分子的横切图上发现其侧壁并非完全增厚,未增厚的部分形成了纹孔(pit)(图1-E,图1-F);导管分子在形成过程中,次生壁整体加厚,液泡膜破裂,分解成多个小液泡,细胞核变形呈不规则柱状(图1-F)。随着导管分子的进一步发育,其内部的一些细胞器逐步消失,成熟的导管形成一个中空的结构(图1-E)。
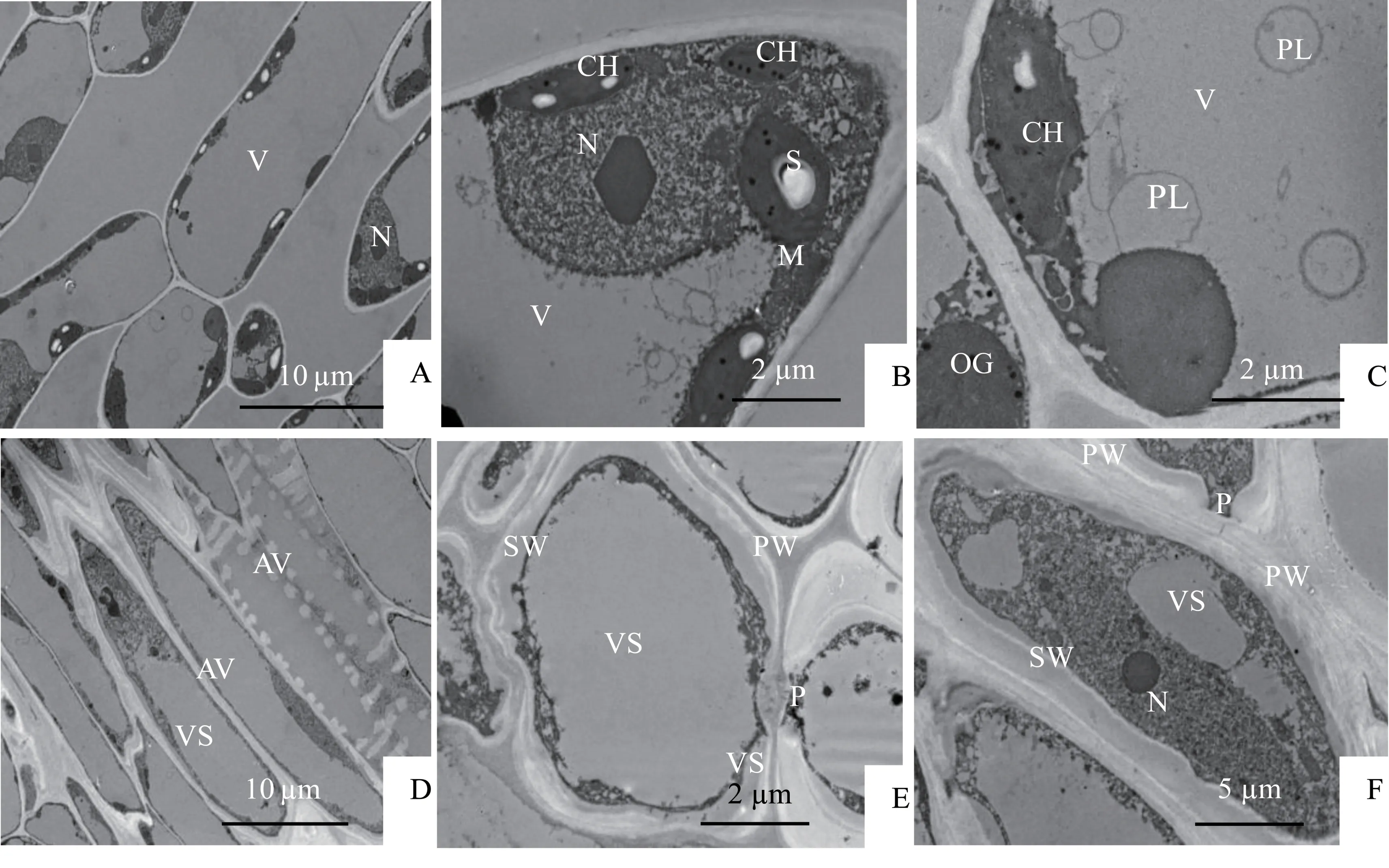
图1 常温下万点金叶肉细胞超微结构Fig.1 Ultrastructure of O.fragrans‘Wandian Jin’at normal temperature
2.2 5 ℃处理下万点金叶肉细胞超微结构
随着处理温度的降低,在5 ℃胁迫时万点金叶肉细胞核结构正常(图2-A)。观察视野中叶绿体数量为2~13个;部分叶绿体较之常温时发生了一定程度的肿胀(图2-A),而有些叶绿体则并未发生肿胀现象(图2-C),这也为低温过后的恢复生长提供了光合作用的物质基础;叶绿体基粒片层电子密度较高、垛叠整齐有序、清晰可辨(图2-C);5 ℃的低温处理时,叶绿体内嗜锇体的数量较常温时有了一定的增加;叶绿体内含的淀粉粒有明暗相间的条纹(图2-A)。此温度下,线粒体的数量也较之常温有了数量上的增加,观察视野中单个细胞内线粒体数量为1~6 个,并且聚集在叶绿体周围(图2-A)。溶酶体是一种异质性的细胞器,形态大小都有很大不同[10]。5 ℃低温胁迫下,观察视野内单个细胞内溶酶体的数量较常温时有了明显增加,观察视野中单个细胞内溶酶体数量为3~12个。初级溶酶体结构简单呈球形,内容物均一,没有明显的颗粒物(图2-A,图2-B,图2-D)。次级溶酶体结构复杂多样,形态不规则,有的次级溶酶体呈极度不规则形(图2-A);有的则呈圆球形(图2-B、图2-E),内含颗粒、膜片等;有的呈近似同心圆环状(图2-C)。图2-C 左下角溶酶体(SL 字母所示,标尺为1 μm)为该图中黑色箭头所指溶酶体的放大图,这种近似同心圆环状的溶酶体可看作是图2-E 所示溶酶体的后期状态,而图2-D中溶酶体可以看作是图2-E中溶酶体的早期状态。试验中还发现了胞间连丝(图2-F中黑色箭头所示)。
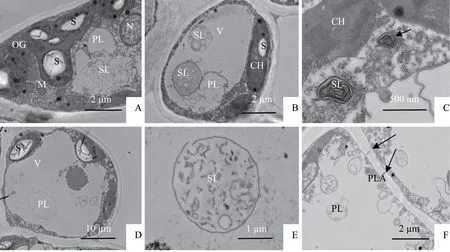
图2 5 ℃处理下万点金叶肉细胞超微结构Fig.2 Mesophyll cells ultrastructure of O. fragrans‘Wandian Jin’at 5 ℃
2.3 0 ℃处理下万点金叶肉细胞超微结构
0 ℃低温胁迫下,万点金叶肉细胞结构正常,细胞壁层次清晰,质膜完整(图3-A,图3-B),试验中发现了胞间连丝(图3-A 黑色箭头所示)。细胞核核膜清晰,核质均匀,电子密度较高的核仁在观察视野中呈黑色立方体状(图3-A)。观察视野中叶绿体数量为3~13个;叶绿体肿胀,部分叶绿体呈椭球形(图3-B,图3-C),基粒内囊体电子密度较高呈黑色,基粒片层垛叠整齐;嗜锇体较多;淀粉粒有亮暗相间的条纹(图3-B,图3-C),并且淀粉粒有肿胀变大的现象(图3-C)。线粒体数量较常温时有增多现象,观察视野中单个细胞内线粒体数量为2~8个,呈圆球形聚集于叶绿体的附近(图3-A)。0 ℃低温胁迫时,万点金叶肉细胞初级溶酶体、次级溶酶体、残质体共存。初级溶酶体结构简单,内容物均一,呈圆球形(图3-B)。次级溶酶体结构复杂多样,大小不一,内含多种生物大分子、膜片、颗粒等结构(图3-C,图3-D)。近似同心圆环状的多泡体聚集在一起构成了次级溶酶体(图3-E),试验中还发现有电子密度较高的蛛网状次级溶酶体(图3-F)。观察视野中单个细胞内溶酶体数量为4~12个。
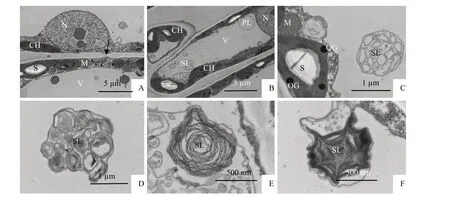
图3 0 ℃处理下万点金叶肉细胞超微结构Fig.3 Mesophyll cells ultrastructure O. fragrans‘Wandian Jin’at 0 ℃
2.4 -5 ℃处理下万点金叶肉细胞超微结构
桂花万点金叶肉细胞在-5 ℃低温胁迫下细胞壁结构完整,层次清晰。细胞核核膜清晰,核质均匀,电子密度较高的核仁位于核的一侧(图4-A)。观察视野中叶绿体数量为4~12个;叶绿体较前期的低温胁迫肿胀更加剧烈,呈椭球形、半球形,部分叶绿体离开细胞壁的内侧,向细胞中央游离(图4-A,图4-B);部分叶绿体有缢缩现象(图4-B);由于胁迫温度较低,淀粉粒加剧水解转化为可溶性糖,提高了细胞渗透势,从而有利于抵御低温带来的伤害,故此,叶绿体中淀粉粒的数量较之前期低温处理变得非常少见,只在极个别的叶绿体中发现了淀粉粒;叶绿体中油体(oil body)的数量较多,呈球形或椭球形,近圆球形的油体是植物体内贮藏形式较为经济的营养物质(图4-B)。线粒体数量比常温时有了一定的增加,这可能是缘于植物对低温的一种响应;线粒体呈球形、椭球形,结构完整,内嵴清晰,聚集在叶绿体周围,观察视野中单个细胞内线粒体数量为4~10个。-5 ℃低温胁迫下,初级溶酶体结构简单,内容物均匀,呈圆球形(图4-C)、新月形(图4-D);此温度下次级溶酶体结构复杂,呈球形(图4-E)、不规则形(图4-F)等。观察视野中单个细胞内溶酶体数量为4~15个。溶酶体的主要功能是消化作用,在维持细胞正常代谢活动和防御方面均有着重要作用[10]。
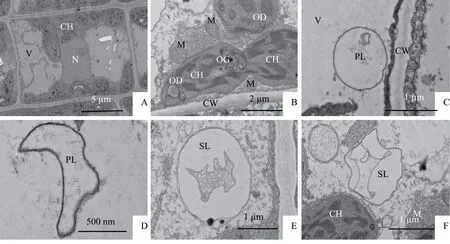
图4 -5 ℃处理下万点金叶肉细胞超微结构Fig.4 Mesophyll cells ultrastructure of O. fragrans‘Wandian Jin’at-5 ℃
当胁迫温度降低到-5 ℃时,发现有桂花万点金叶肉细胞有结冰现象。冰晶的形状各异,由于透射电镜照片看到的仅是一个二维剖面图像,不是三维立体结构,所以就观察视野看到的而言,有柱状冰晶、方形冰晶、针状冰晶、点状冰晶及不规则形冰晶。细胞内外均有结冰的现象:细胞内结冰主要在原生质或液泡内进行,细胞内结冰体积相对较小,形态不一,数量较多,排列无序,零星散落于液泡内(图5-A,图5-B);胞间结冰冰晶的体积相对较大,冰晶的形状多样且无序,冰晶随机分布于胞间(图5-C)。研究中发现桂花万点金在-5 ℃低温胁迫下有质膜内陷的现象(图5-C黑色箭头所示)。

图5 -5 ℃处理下万点金叶肉冰晶超微结构Fig.5 Mesophyll cells ultrastructure of ice crystals in O. fragrans‘Wandian Jin’at-5 ℃
3 讨论与小结
现有研究表明,细胞器及膜结构稳定性的提高是植物抵御外界低温胁迫的重要方面[11]。本试验研究发现,于-5 ℃低温胁迫下,桂花万点金叶肉细胞有质膜内陷的现象(图5-C黑色箭头所示)。质膜内陷的生理意义在于增加了细胞质膜的比表面积,扩增了细胞排水总面积,从而便于低温时细胞内水分快速排出,延缓了细胞内部的结冰速度,一定程度上减轻了植物的低温伤害。从本研究结果来看,细胞核在系列低温胁迫下的稳定性较强,没有发生明显的变化。叶绿体则是植物细胞中对低温胁迫十分敏感的细胞器[12-13]。本研究发现随着低温胁迫程度的加剧,叶肉细胞叶绿体肿胀的现象越来越剧烈,直至-5 ℃低温处理时,桂花万点金叶肉细胞部分叶绿体呈现椭球形、球形,甚至部分叶绿体脱离了细胞质膜内侧,向细胞中央游离(图4-A,图4-B)。逆境胁迫下叶绿体肿胀的现象在多种农林作物上均有报道[14-18]。尤扬等[8]研究人工低温胁迫桂花品种状元红时发现:在5 ℃低温处理时,叶绿体有轻微膨大现象,0 ℃处理时叶绿体肿胀加剧,-10 ℃处理时,叶绿体降解。有文献对大花丹桂[19]低温胁迫下叶肉细胞的超微结构研究发现:0℃和-5 ℃胁迫时叶绿体膨胀加剧,细胞内线粒体的数量有增加现象;-10 ℃和-15 ℃处理时,叶肉细胞发生严重的质壁分离,细胞器崩溃降解。潢川金桂叶肉细胞叶绿体肿胀的现象在自然降温条件下也有报道,在过低的温度下,有细胞质壁分离,甚至有细胞壁破损的现象[20]。就本文涉及的温度和桂花状元红、大花丹桂和潢川金桂在低温胁迫下同温度的超微结构相比较来看,叶绿体的反应基本一致。由于本研究并未涉及-10 ℃的低温胁迫,故此未见桂花万点金叶肉细胞叶绿体崩溃解体,也没有看到质壁分离和细胞壁破裂的现象。
本试验研究发现,相对于叶绿体而言,在一定低温范围内,线粒体于低温胁迫下是一种比较稳定的细胞器。这也和桂花状元红、大花丹桂和潢川金桂叶肉细胞线粒体在低温下的反应类似,也同时表明相同温度下,线粒体对低温的敏感性不及叶绿体。
就本试验来看,桂花万点金叶肉细胞的溶酶体在每个试验处理中均存在。常温处理时,溶酶体的数量较少,观察视野内以初级溶酶体居多,其形态多呈圆球形,结构简单,内容物均一。随着胁迫温度的降低(5 ℃、0 ℃、-5 ℃),观察视野中溶酶体的数量较之对照的常温处理有了一定程度增加,初级溶酶体、次级溶酶体和残质体均有发现。低温胁迫下溶酶体数量增加,不仅能及时清除一些无用的衰老的细胞器、生物大分子等物质,作为细胞内的消化“器官”,溶酶体还可为身处低温逆境下的细胞提供一定的营养物质,进而有利于桂花抵御低温带来的伤害。
低温结冰对植物造成的伤害有两种类型,一是细胞内结冰伤害,二是细胞间结冰伤害。就本试验研究来看,胞内结冰(图5-A,图5-B)和胞间结冰(图5-C)两种类型均有发现。细胞内结冰破坏了原生质的结构,致使细胞亚结构破坏、酶活动无序、组织分离、代谢紊乱;胞间结冰造成细胞间隙冰晶过多时会对原生质引发机械损伤,当温度回升时,冰晶融化较快,细胞壁容易恢复原貌,而原生质吸水膨胀要缓慢得多,结果可能会导致原生质被撕裂,继而对细胞造成伤害[21]。
总之,一定低温条件胁迫下桂花万点金叶肉细胞叶绿体肿胀变形;淀粉粒减少,部分淀粉粒肿胀变大;线粒体增多;次级溶酶体增多,结构复杂;-5 ℃的低温胁迫下,出现了胞内结冰和胞间结冰的现象;叶绿体的稳定性可以作为桂花抗寒的一个重要参考指标。
