TLR3活化对人脂肪间充质干细胞成骨分化的影响
2021-09-10金兵男江鑫铭李霄霞赵春华
金兵男,江鑫铭,李霄霞,赵春华
(青岛大学基础医学院遗传学与细胞生物学系,山东 青岛 266071)
间充质干细胞(MSCs)是目前国内外研究最多的一类成体干细胞[1-4],其来源广泛,在脂肪、骨髓、脐带、胎盘等多种成体组织中均广泛存在[5]。其中,人脂肪来源MSCs(hAMSCs)已成为再生医学领域中的理想种子细胞[6-10]。然而,在应用MSCs移植治疗骨质疏松等疾病的过程中常有炎症或细菌感染等情况发生,严重影响了MSCs移植的存活率和治疗效果。因此,寻找MSCs预处理方式,提高MSCs移植存活率,增强体内治疗效果,对MSCs的临床应用具有重要意义[11-13]。Toll样受体(TLRs)作为一类在固有免疫和适应性免疫中具有重要作用的模式识别受体,能够识别大量病原相关分子,介导机体免疫反应,维持机体的平衡状态,MSCs中也有部分表达TLRs[14]。已有研究显示,表达TLR3的MSCs在TLR3被Poly(I:C)活化后表现出抗炎作用,TLRs活化能够对MSCs的成骨分化产生影响[15]。使用Poly(I:C)活化MSCs的TLR3可以作为一种重要的MSCs预处理方法。本研究探讨TLR3活化对hAMSCs增殖及成骨分化的影响,为hAMSCs在骨质疏松等疾病治疗中应用提供理论依据。
1 材料与方法
1.1 细胞和试剂
实验所用hAMSCs为吸脂术病人废弃的脂肪组织原代分离扩增获得; DMEM高糖、DME/F12培养基购于美国Hyclone公司;胎牛血清购于Excell公司;青霉素和链霉素购于新赛美公司;胶原酶P购于美国Roche公司;碱性磷酸酶试剂盒、CCK8试剂盒、反转录试剂盒、SYBR Green Master Mix购于上海翊圣公司;Poly(I:C)、油红O、茜素红购于美国Sigma公司;SDS-PAGE凝胶试剂盒、磷酸酶抑制剂购于上海雅酶公司;D-hank’s液、PBS、组织裂解液购于北京索莱宝公司;小鼠抗人FITC-CD14、FITC-CD34、FITC-CD45、PE-CD73、FITC-CD90、PE-CD105、FITC-HLA-DR购于美国BD公司。
1.2 hAMSCs的分离培养
取成人吸脂术采集的脂肪组织,D-hank’s液清洗去除血细胞和麻醉药物。加入适量2 g/L胶原酶P,37 ℃恒温摇床消化30 min,100目筛网滤去未消化组织。加入足量D-hank’s液,1 500 r/min离心10 min,弃上清,重复2次。重悬细胞沉淀,接种于hAMSCs培养基中,于含CO2培养箱内37 ℃恒温培养,每3 d换液1次。当细胞生长达到80%融合时,进行传代培养。
1.3 流式细胞术检测免疫学表型
胰蛋白酶消化收集细胞,PBS清洗、重悬,加入相应直标抗体4 ℃孵育30 min,PBS清洗2次,重悬,流式细胞仪上检测MSCs免疫学表型。
1.4 实验分组及细胞增殖检测
取第6代hAMSCs以每孔1×104的密度接种于96孔板中,随机分为两组,对照组不作处理,TLR3组加入20 mg/L Poly(I:C)工作液处理6 h活化TLR3。分别在活化后的0、24和48 h时每孔加入 CCK8工作液10 μL,37 ℃孵育90 min,酶标仪检测450 nm波长处的吸光度(A)值,以其表示hAMSCs增殖能力。
1.5 hAMSCs体外成骨诱导分化及鉴定
取第6代hAMSCs以5×103/cm2的密度接种于24孔板中,待其生长至80%融合时加入成骨诱导培养基(含体积分数0.10 FBS、 2×10-4mol/L抗坏血酸和10 mmol/L β-甘油磷酸钠的DMEM高糖培养基)诱导成骨分化,3 d更换1次新鲜成骨诱导培养基。①碱性磷酸酶染色:成骨诱导3 d后,PBS冲洗2次,40 g/L多聚甲醛固定10 min,加入碱性磷酸酶染色工作液,37 ℃孵育20 min,PBS冲洗3次,光镜下观察对照组和TLR3组hAMSCs碱性磷酸酶活性变化情况。②茜素红染色:成骨诱导12 d后,PBS冲洗2次,用40 g/L多聚甲醛室温固定10 min,1 g/L茜素红染色工作液室温染色30 min;PBS冲洗3次后,在光镜下观察对照组和TLR3组hAMSCs钙质沉积情况。
1.6 hAMSCs体外成脂诱导分化及鉴定
取第6代hAMSCs,以5×103/cm2的密度接种于24孔板中,待其生长至90%融合时加入成脂诱导培养基(DMEM高糖培养基中含有体积分数0.10 FBS、1×10-6mol/L地塞米松、50 mg/L抗坏血酸和100 mg/L IBMX)诱导成脂分化,每3 d更换1次新鲜成脂诱导培养基。成脂诱导12 d后,PBS冲洗2次,40 g/L多聚甲醛室温固定10 min,油红O染色工作液室温染色30 min;PBS冲洗3次,光镜下观察hAMSCs脂滴形成情况。
1.7 Real-time PCR检测成骨标志基因runt相关转录因子2(RUNX2)和骨钙素(OCN)mRNA表达
取第6代hAMSCs以5×103/cm2的密度接种于6孔板中,随机分为TLR3组和对照组,对照组不做处理,TLR3组用含有20 mg/L Poly(I:C)的正常培养基处理6 h,按照总RNA提取试剂说明书提取两组样本的细胞总RNA,应用反转录试剂盒进行反转录,反应条件:25 ℃、5 min,42 ℃、30 min,85 ℃、5 min。按照荧光定量试剂盒配制反应体系,反应条件:预变性95 ℃、30 s,变性95 ℃、10 s,退火/延伸60 ℃、30 s,共40个循环。以GAPDH为内参基因,2-ΔΔCt法计算hAMSCs成骨标志基因RUNX2和OCNmRNA表达情况。所用基因引物序列见表1。每个样本设置3个复孔,实验重复3次。
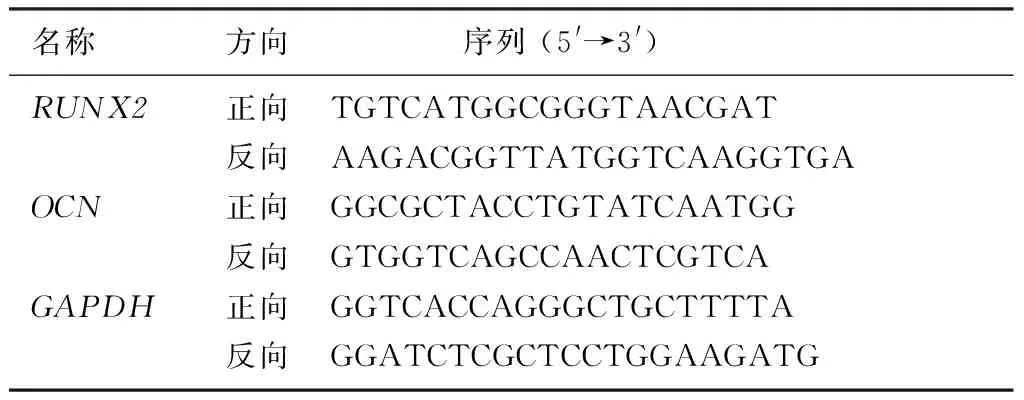
表1 PCR引物及其序列
1.8 Western Blot方法检测相关蛋白表达
细胞按1.7方法分组及处理后,加入RIPA裂解液提取细胞总蛋白,蛋白样品应用SDS-PAGE进行电泳分离,然后转蛋白至硝酸纤维素膜上;50 g/L BSA室温封闭90 min,添加一抗(β-actin、GAPDH、RUNX2、OCN、P65、p-P65,1∶1 000稀释)4 ℃孵育过夜,添加羊抗兔二抗(1∶5 000稀释)室温孵育60 min, 使用超敏ECL发光液显影,Image J软件分析条带灰度值,以GAPDH或β-actin作为对照,计算目的蛋白RUNX2、OCN、P65和p-P65相对表达量。实验重复3次。
1.9 统计学分析
2 结 果
2.1 hAMSCs形态、免疫学表型及成脂成骨分化能力鉴定
在光镜下观察,原代分离培养后的hAMSCs呈长梭形,旋涡状分布,贴壁生长(图1A);碱性磷酸酶染色后细胞可见蓝色沉淀,表明hAMSCs开始向成骨细胞分化(图1B);茜素红染色细胞可见染成红色的钙质沉淀,表明hAMSCs成骨诱导12 d后分化为成骨细胞,分泌了大量钙质沉积(图1C);油红O染色后细胞中可见红色脂滴,表明hAMSCs成脂诱导12 d后分化为脂肪细胞(图1D)。流式细胞术检测hAMSCs的免疫学表型结果显示,CD14阳性率为0.9%,CD34阳性率0.4%,CD45阳性率0.5%,HLA-DR阳性率0.8%,均<5%;CD73阳性率为98.7%,CD90阳性率98.5%,CD105阳性率95.4%,FLK-1阳性率96.0%,均>95%。符合国际细胞学会对于MSCs的定义(图1E)。证明从人脂肪组织中原代分离的细胞为hAMSCs。
2.2 各组hAMSCs增殖能力比较
CCK8法检测结果显示,对照组与TLR3组比较,hAMSCs活化后0、24和48 h时增殖能力差异无显著性(P>0.05)。见表2。

表2 两组hAMSCs增殖能力比较
2.3 各组RUNX2和OCN mRNA及蛋白表达的比较
Real-time PCR检测显示,TLR3组RUNX2和OCN的mRNA表达水平均较对照组显著增加(t=14.39、36.36,P<0.01)。Western Blot检测显示,TLR3组RUNX2和OCN蛋白表达均高于对照组(t=3.46、2.98,P<0.05)。见图2A、B和表3。茜素红染色结果显示,TLR3组红色钙质沉积明显多于对照组(图2C)。表明TLR3经Poly(I:C)活化后能够促进hAMSCs成骨分化,加快钙质沉积。

表3 两组RUNX2、OCN mRNA和蛋白表达水平的比较
2.4 各组hAMSCs中NF-κB通路相关蛋白P65及p-P65表达比较
Western Blot结果显示,NF-κB通路相关蛋白p-P65和P65表达较对照组明显增加,差异有统计学意义(t=3.52、13.85,P<0.05)。见图3、表4。

表4 两组P65、p-P65蛋白表达比较
3 讨 论
MSCs作为一类具有自我更新、多谱系分化、低免疫原性和免疫调节能力等多项优点的成体多能干细胞,目前在干细胞领域得到广泛的研究[15]。由于MSCs具有以上多项优点,目前MSCs移植已成为骨质疏松等疾病最佳治疗方法。但是在MSCs移植中经常有炎症或感染情况发生,降低了MSCs移植的成功率与治疗效果,而通过活化MSCs的TLR3介导hAMSCs免疫反应能够抑制炎症感染,提高MSCs移植的成功率和骨质疏松等疾病的治疗效果。但是活化的TLR3是否会影响hAMSCs成骨分化,目前没有定论。本实验结果表明,hAMSCs活化TLR3后,成骨标志基因RUNX2和OCN的mRNA和蛋白表达均明显增加,同时成骨诱导分化后钙质沉积程度更高,表明hAMSCs经Poly(I:C)处理活化TLR3后可能促进hAMSCs成骨分化。
MSCs在成骨分化过程中受到多种信号通路的调控,包括Wnt信号通路、Notch信号通路、BMP/TGF-β信号通路、MAPK信号通路、hedghog信号通路、FGF信号通路、PTH信号通路和IGF-1信号通路等[16-19],不同信号通路通过调控β-catenin、同源核蛋白MSX2和含有PDZ识别模体的转录辅助激活因子TAZ等因子的表达,上调成骨分化标志基因RUNX2和其下游基因OSX(osterix)的表达,提高碱性磷酸酶活性,调控成骨细胞特异性细胞外基质蛋白OCN表达和钙离子沉积,促进MSCs向成骨细胞分化[20-21]。大量的研究结果证明,许多因素都能够通过不同信号通路影响MSCs的成骨分化[22-28],其中TLRs活化对MSCs的成骨分化也有影响。例如使用LPS持续刺激骨髓来源MSCs活化TLR4后能够通过Wnt通路促进其增殖和成骨分化[29]。TLR2活化后也能够显著增强骨髓来源MSCs的成骨分化[30]。TLR9活化后能够促进脐带来源MSCs成骨分化而不影响其表型[31]。本实验结果显示,Poly(I:C)活化hAMSCs的TLR3后,NF-κB通路相关蛋白P65和p-P65表达明显增加,表明hAMSCs的TLR3活化后可能通过激活NF-κB通路来上调成骨标志基因RUNX2和OCN的表达,促进hAMSCs成骨分化。但是具体作用机制仍不明确,需要进一步探讨。
综上所述,Poly(I:C)活化hAMSCs的TLR3后,能够通过激活NF-κB通路上调hAMSCs成骨标志基因RUNX2和OCNmRNA和蛋白表达,加快钙质沉积,促进hAMSCs成骨分化。因此,活化hAMSCs的TLR3不仅能够抑制炎症,提高MSCs的移植存活率,还能够促进MSCs的成骨分化,加快钙质沉积,有利于增强骨质疏松病人的骨修复能力,为一种可行的MSC预处理方式。但是活化TLR3后促进MSCs成骨分化涉及的基因及信号通路需要进一步研究[32-33]。本文研究结果可为hAMSCs在骨质疏松等老年退行性疾病中的应用提供了一定的研究基础。
