青稞黑穗病菌LAMP检测体系的建立
2021-09-10胡章薇严浩浩刘耀霞张学飞闫佳会
杨 帆,胡章薇,严浩浩,刘耀霞,张学飞,闫佳会,侯 璐,姚 强
(青海大学 农林科学院 青海省农业有害生物综合治理重点实验室/农业农村部西宁作物有害生物科学观测实验站,青海 西宁 810016)
青稞(Hordeumvulgare)也叫裸大麦,是大麦的一种特殊类型,也是青藏高原最具特色的农作物之一。因适应性广、抗逆性强,青稞在高海拔藏区农牧民的食物结构中具有举足轻重、不可替代的地位。病害是影响青稞生产的重要因素,其中由大麦坚黑粉菌(Ustilagohordei)引起的坚黑穗病和裸黑粉菌(Ustilagonuda)引起的散黑穗病是青稞生产上的重要病害,这2种黑穗病均为种子传播的系统性病害。青稞发病后均产生黑粉状病穗,单株产量损失率高达100%,同时种子带菌亦加重了翌年的再侵染为害。研究表明,使用杀真菌的种子处理剂和种植抗性品种,可有效控制青稞黑穗病害[1],但青稞属于小宗作物,关于其抗黑穗病方面的育种资源和品种较少,生产上主要采用播前药剂拌种防治黑穗病。因农户无法掌握青稞种子的带菌量是否达到防治指标,盲目采取播前药剂拌种,造成青稞田间药剂残留严重、大面积环境污染。因此检测青稞种子的带菌量,依据带菌程度进行播前种子处理,严把健康良种关口,是青稞黑穗病绿色防治的重要技术手段。
种传病害的常规检测是将种子放置在培养基上培养,再进行病原体形态特征观察,由于病害不同,所需培养条件、培养方法和病菌的生长速度亦有所不同,以此方法确认种子是否携带病原菌耗时且费力。因此迫切需要建立一种简单、快速和有效的种子带菌量检测方法。环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是2000年由Notomi等[2]报道的一种新的核酸扩增技术,其能够识别靶序列上6个特异区域的4条正反向外引物和正反向内引物,在59~67 ℃恒温条件下利用高活性链置换DNA聚合酶(Bst DNA polymerase),特异、高效、快速的扩增靶基因。该检测体系的灵敏度是普通PCR的100倍。这种特异、高效、快速的分子检测技术已成功应用于真菌[3-7]、细菌、病毒[8]等的检测。研究发现,加入2条环引物可加快LAMP反应速度,使整个反应时间缩短1/3到1/2[9]。LAMP结果可通过电泳仪[10]、real-time PCR仪[10]及浊度仪[11]进行检测,还可通过SYBR Green I[12]、钙黄绿素[13]、羟基奈酚蓝[14]染色后用肉眼识别。鉴于LAMP检测过程操作简单,反应时间短,结果易于判断,本研究基于青稞黑穗病的ITS基因序列设计、筛选最佳引物组,利用最佳引物组对LAMP检测方法进行优化,建立以实时荧光扩增曲线和SYBR Green I染色为双重判定标准的青稞黑穗病菌LAMP检测技术,为青稞黑穗病的便捷检测和绿色防控提供参考。
1 材料与方法
1.1 材料、试剂与仪器
供试病原菌:青稞黑穗病病菌采自青海青稞主产区具有典型症状的坚黑穗病和散黑穗病的病穗,经实验室鉴定分别为大麦坚黑粉菌(Ustilagohordei)和裸黑粉菌(Ustilagonuda);对比菌种选用青稞上常见病害的病原菌(详见表1),供试病原菌均由青海省农业有害生物综合治理重点实验室提供。

表1 用于LAMP检测的青稞病原菌信息Table 1 Isolates of barely disease used to test species-specific of LAMP
试剂:真菌基因组DNA提取试剂盒,OMEGA Bio-Tek公司;Prime STAR Max Premix (2×)、dNTPs 10 mmol/L,TaKaRa公司;Bst 2.0 WarmStart DNA Polymerase(10×Isothermal Amplification Buffer、MgSO4、Bst DNA聚合酶),美国NEB公司;甜菜碱5 mol/L,美国Sigma-Aldrich公司;SYBR Green Ⅰ,北京索莱宝科技有限公司。
仪器:Monad MiniSpeed 3300离心机,北京必吉生物科技有限公司;PowerPac Universal电泳仪、BBx24B细胞组织破碎仪、PCR仪,美国BIO-RAD公司;ABI 7500 RT-PCR仪,美国Applied Biosystems公司;NanoDrop OneC微量核酸蛋白测定仪,美国Thermo Scientific公司。
1.2 试验方法
1.2.1 病原菌DNA提取及测序 黑粉菌的DNA提取:将大麦坚黑粉菌和裸黑粉菌冬孢子粉分别放入加有钢珠(直径0.2 mm)的1.5 mL离心管内,加入缓冲液后经细胞组织破碎仪破碎10 min;其他对照病原菌分别于PDA培养基上培养后刮取菌丝,放于装有直径2 mm钢珠的1.5 mL离心管内,液氮冷冻后进行组织破碎6 min。病原菌总DNA采用真菌基因组DNA提取试剂盒提取,具体操作参照试剂盒说明,获得的DNA稀释后于―20 ℃保存备用。
将提取的DNA进行ITS序列扩增,选用的引物为真菌通用引物(ITS4:5′-TCCTCCGCTTATTGATATGC-3′,ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′)。PCR扩增体系为:DNA 2 μL、Prime STAR Max Premix (2×) 12.5 μL、10 μmol/L上下游引物各1 μL,灭菌水补足至25 μL。PCR扩增程序:95 ℃预变性10 min;94 ℃变性30 s,58 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。扩增产物送生工生物工程(上海)股份有限公司进行测序。
1.2.2 引物设计 获得ITS序列后利用DNAMAN软件进行比对,筛选大麦坚黑粉菌(U.hordei)和裸黑粉菌(U.nuda)与其他病原菌同源性低的区段,并利用在线软件PrimerExploreV5(http:// primerexplorer.jp/lampv5e/index.html)设计青稞黑穗病菌的LAMP引物,共生成引物序列3组,详见表2,引物合成由生工生物工程(上海)股份有限公司完成。

表2 用于青稞黑穗病菌LAMP测试设计的引物组信息Table 2 Designed primer set for LAMP detection of barley smut
1.2.3 LAMP引物组的筛选 最佳引物组的确定采用Bst 2.0 WarmStart DNA Kit方法,反应体系为Mix 12.5 μL,引物(40 μmol/L内引物FIP/BIP、5 μmol/L外引物F3/B3、10 μmol/L环引物LF/LB)2.5 μL,荧光染料0.5 μL,病原菌DNA模板1 μL,无菌去离子水补足25 μL。
实时荧光LAMP反应条件为65 ℃ 70 min,间隔1 min读取荧光。反应结束后根据实时扩增曲线确定最适引物组。
1.2.4 实时荧光LAMP检测方法的建立及优化 LAMP检测体系的建立:10×Isothermal Amplification Buffer 2.5 μL、dNTPs(10 mmol/L)3.5 μL、MgSO4(100 mmol/L)1.5 μL、Bst DNA聚合酶(8 000 U/mL) 1 μL、引物(40 μmol/L内引物FIP/BIP、5 μmol/L外引物F3/B3、10 μmol/L环引物LF/LB各1 μL)6 μL、SYBR Green Ⅰ(1∶1 000)1.5 μL、20 ng/μL菌株DNA 2 μL,无菌去离子水补足25 μL。合盖后轻击底部使溶液充分混合并瞬时离心,最后加入20 μL石蜡油。扩增反应条件为65 ℃ 60 min,间隔1 min读取荧光。反应结束后根据扩增曲线和SYBR Green Ⅰ染色对检测结果进行双重判定,其中扩增曲线呈“S”型为阳性,呈直线为阴性;加入SYBR Green Ⅰ染料0.5 μL后,反应体系呈绿色为阳性,呈橙色为阴性。
LAMP检测体系的优化:在上述检测体系的基础上对dNTPs、甜菜碱、Mg2+、Bst DNA聚合酶的浓度及反应温度进行单因素试验,其中dNTPs设1.0,1.2,1.4,1.6,1.8 mmol/L 5个浓度;甜菜碱设0,0.2,0.4,0.6,0.8 mmol/L 5个浓度;Mg2+设4,6,8,10 mmol/L 4个浓度;Bst DNA聚合酶设80,160,240,320 U/mL 4个浓度;阴性对照均以ddH2O为模板。优化后,将反应混合物分别在61,63,65和67 ℃下进行扩增,以实时荧光扩增曲线及SYBR Green Ⅰ染色结果来确定最佳LAMP检测体系。
1.2.5 LAMP灵敏度检测 根据已优化的LAMP检测体系,将黑粉菌DNA分别稀释为2,2×10-1,2×10-2,2×10-3,2×10-4和2×10-5ng/μL,以不同质量浓度的黑粉菌DNA 2 μL作为模板进行灵敏度检测。通过实时荧光扩增曲线和SYBR Green Ⅰ染色来确定LAMP检测的灵敏度。
1.2.6 LAMP特异性检测 利用筛选的最适引物组和最优检测体系,分别对大麦坚黑粉菌、裸黑粉菌、禾生指葡孢霉、麦类核腔菌、大麦网斑菌、禾谷镰孢菌的总DNA在65 ℃条件下反应55 min进行扩增。通过实时荧光扩增曲线和SYBR Green Ⅰ染色结果来评估LAMP检测方法的特异性。
2 结果与分析
2.1 LAMP检测体系引物组筛选
采用设计的青稞黑穗病菌LAMP检测体系的3组引物,分别以大麦坚黑粉菌(Ustilagohordei)和裸黑粉菌(Ustilagonuda)基因组DNA为模板,65 ℃进行实时荧光LAMP反应。扩增结果显示,引物组① 2种黑穗病菌的实时荧光扩增曲线均呈“S”型,阴性对照的实时荧光扩增曲线呈直线型(图1);引物组② 2种黑穗病菌的实时荧光扩增曲线也均呈“S”型,但阴性对照的实时荧光扩增曲线发生非特异性扩增;引物组③ 2种黑穗病菌及阴性对照均未发生扩增。因此确定引物组①为青稞黑穗病菌LAMP检测体系的最佳引物组。

图1 青稞黑穗病菌的RT-LAMP扩增曲线(引物组①)Fig.1 RT-LAMP amplification of barleysmut (Primer set ①)
2.2 LAMP检测体系的优化
2.2.1 dNTPs浓度的优化 根据设定反应体系,在其他条件不变时,设置dNTPs浓度为1.0,1.2,1.4,1.6,1.8 mmol/L,分别以大麦坚黑粉菌和裸黑粉菌基因组DNA为模板进行RT-LAMP扩增,扩增结果(图2和图3)显示,dNTPs浓度越高扩增开始时间越早。SYBR Green Ⅰ染色结果(图4-A中的1―5和图4-B中的1―5)显示,dNTPs浓度为1.0 mmol/L时检测结果呈阴性,其他浓度的检测结果均为阳性。因此根据扩增时间确定dNTPs的最适浓度为1.8 mmol/L。
2.2.2 甜菜碱浓度的优化 当dNTPs浓度为1.8 mmol/L,其他条件不变时,设置甜菜碱浓度为0,0.2,0.4,0.6,0.8 mmol/L,分别以大麦坚黑粉菌和裸黑粉菌基因组DNA为模板进行RT-LAMP扩增,扩增结果(图2和图3)和SYBR Green Ⅰ显色法结果(图4-A中6―10和图4-B中的6―10)均显示,5种甜菜碱浓度下检测结果均为阳性,且甜菜碱浓度越高扩增所需时间越短,从而确定甜菜碱的最佳浓度为0.8 mmol/L。

图2 大麦坚黑粉菌RT-LAMP检测体系的优化结果Fig.2 Optimized results of RT-LAMP detection system for Ustilago hordei

图3 裸黑粉菌RT-LAMP检测体系的优化结果Fig.3 Optimized results of RT-LAMP detection system for Ustilago nuda
2.2.3 Mg2+浓度的优化 当dNTPs浓度为1.8 mmol/L,甜菜碱浓度为0.8 mmol/L,其他条件不变时,分别设置Mg2+浓度为4,6,8,10 mmol/L,分别以大麦坚黑粉菌和裸黑粉菌基因组DNA为模板进行RT-LAMP扩增,扩增结果(图2和图3)和SYBR Green Ⅰ显色法结果(图4-A中11―14和图4-B中11―14)均显示,Mg2+浓度为8和10 mmol/L时检测结果呈阳性,以扩增所需时间最短为前提,最终确定Mg2+最适浓度为10 mmol/L。
2.2.4 Bst DNA聚合酶浓度的优化 当dNTPs浓度为1.8 mmol/L,甜菜碱浓度为0.8 mmol/L,Mg2+浓度为10 mmol/L,其他条件不变时,设置Bst DNA聚合酶浓度分别为80,160,240,320 U/mL,分别以大麦坚黑粉菌和裸黑粉菌基因组DNA为模板进行RT-LAMP扩增,扩增结果(图2和图3)显示,Bst DNA聚合酶浓度分别为80,160,340,320 U/mL 时均可发生扩增,且随着Bst DNA聚合酶浓度的降低扩增所需时间延长。SYBR Green Ⅰ显色法结果(图4-A中15―18和图4-B中的15―18)显示,4种不同Bst DNA聚合酶浓度下反应体系均变绿,与实时荧光LAMP检测结果一致。故确定开始扩增时间最早的320 U/mL为Bst DNA聚合酶最适反应浓度。

A.以大麦坚黑粉菌为模板RT-LAMP检测体系的SYBR Green Ⅰ染色结果;B.以裸黑粉菌为模板RT-LAMP检测体系的SYBR Green Ⅰ染色结果。N.阴性对照;1~5.dNTPs浓度分别为1.8,1.6,1.4,1.2,1.0 mmol/L;6~10.甜菜碱浓度分别为0.8,0.6,0.4,0.2,0 mmol/L;11~14.Mg2+浓度分别为4,6,8,10 mmol/L;15~18.Bst DNA聚合酶浓度分别为320,240,160,80 U/mL A.System optimization using U.hordei as a template;B.System optimization using U.nuda as a template.N.Negative control;1-5.dNTPs with concentrations of 1.8,1.6,1.4,1.2 and 1.0 mmol/L,respectively;6-10.Betaine concentrations of 0.8,0.6,0.4,0.2 and 0 mmol/L,respectively;11-14.Mg2+ concentrations of 4,6,8 and 10 mmol/L,respectively;15-18.Concentrations of Bst DNA polymerase at 320,240,160 and 80 U/mL,respectively图4 大麦坚黑粉菌和裸黑粉菌RT-LAMP检测体系的SYBR Green Ⅰ染色结果Fig.4 Optimized results of LAMP detection system for Ustilago hordei and Ustilago nuda
2.2.5 反应温度的优化 当dNTPs浓度为1.8 mmol/L,甜菜碱浓度为0.8 mmol/L,Mg2+浓度为10 mmol/L,Bst DNA聚合酶浓度为320 U/mL,设置反应温度分别为61,63,65,67 ℃,其他条件不变时,分别以大麦坚黑粉菌和裸黑粉菌基因组DNA为模板进行RT-LAMP扩增,扩增曲线和SYBR Green Ⅰ颜色变化均显示,大麦坚黑粉菌和祼黑粉菌在61,63,65,67 ℃下均能发生扩增,其中65 ℃条件下开始扩增的时间最早,SYBR Green Ⅰ显色最亮(图5),从而确定最佳反应温度为65 ℃。
2.3 LAMP灵敏度检测
利用引物组①,对质量浓度为2 ng/μL~2×10-5ng/μL的大麦坚黑粉菌、裸黑粉菌DNA进行灵敏度检测,RT-LAMP扩增曲线和SYBR Green Ⅰ染色结果(图6和图7)均显示,RT-LAMP对大麦坚黑粉菌和裸黑粉菌的最低检出质量浓度为2×10-4ng/μL。根据病原菌DNA浓度的扩增时间,确定大麦坚黑粉菌扩增反应时间为60 min,裸黑粉菌扩增反应时间为45 min。
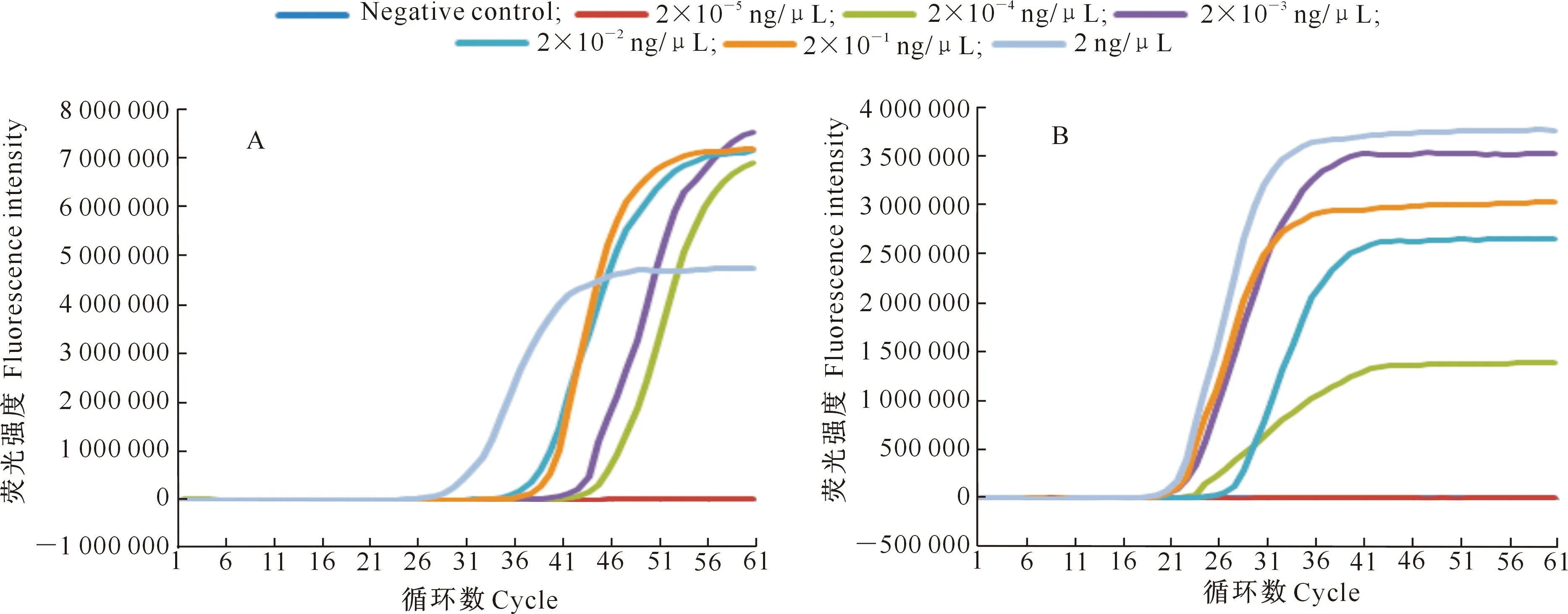
A.大麦坚黑粉菌实时荧光扩增曲线;B.裸黑粉菌实时荧光扩增曲线A.Real-time fluorescence amplification curve of U.hordei;B.Real-time fluorescence amplification curve of U.nuda图6 青稞黑穗病菌RT-LAMP灵敏度检测Fig.6 Sensitivity detection of RT-LAMP of barley smut

N.阴性对照;1~6.分别表示以祼黑粉菌DNA模板为2×10-5 ,2×10-4 ,2×10-3 ,2×10-2 ,2×10-1 ,2 ng/μL浓度下的显色结果;7~12.分别表示以大麦黑粉菌DNA模板为2×10-5 ,2×10-4 ,2×10-3 ,2×10-2 ,2×10-1,2 ng/μL浓度下的显色结果N.Negative control;1―6. Color change of U.nuda at DNA concentrations of 2×10-5,2×10-4,2×10-3,2×10-2,2×10-1 and 2 ng/μL,respectively;7―12.Color change of U.hordei at DNA concentrations of 2×10-5,2×10-4,2×10-3,2×10-2,2×10-1 and 2 ng/μL,respectively图7 青稞黑穗病菌可视化反应的灵敏度检测Fig.7 Sensitivity detection of visual reaction of barley smut
2.4 LAMP特异性检测
分别以大麦坚黑粉菌、裸黑粉菌、禾生指葡孢霉、麦类核腔菌、大麦网斑菌、禾谷镰孢菌的总DNA为模板进行特异性检测,结果显示大麦坚黑粉菌和裸黑粉菌的扩增曲线呈“S”型(图8-A);加入SYBR Green Ⅰ后,检测体系颜色变为绿色(图8-B),其他待测菌株RT-LAMP扩增结果和SYBR Green Ⅰ显色结果均为阴性,表明所建立的LAMP检测体系能够特异性检测出青稞的大麦坚黑粉菌和裸黑粉菌2种病原菌。

A.实时荧光扩增曲线;B.SYBR Green Ⅰ显色结果。N.阴性对照;1―6.分别表示以大麦坚黑粉菌、裸黑粉菌、禾生指葡孢霉、麦类核腔菌、大麦网斑菌、禾谷镰孢菌DNA为模板的扩增体系A.Real-time fluorescence amplification curve;B.Color change of SYBR Green Ⅰ.N.Negative control;1-6.Color change of barley 6common diseases of U.hordei,U.nuda,Dactylobotrys graminicola,Pyrenophora graminea,Pyrenophora teres and Fusarium graminearum,respectively图8 青稞黑穗病菌RT-LAMP和可视化反应特异性检测Fig.8 Specific detection in RT-LAMP and visual reaction of barley smut
3 讨 论
青稞是藏区农牧民不可替代的主粮,也是藏区主要饲料和酿酒等农产品加工业的重要原料。青稞产业已成为青藏高原的主导产业和特色优势产业。青稞黑穗病是影响青稞高产、稳产的主要系统性病害,由于青稞属于小宗粮食作物,关于其病害病原菌分子检测方面的研究报道甚少。因此通过开展种子带菌量检测,依据带菌程度进行播前种子处理是青稞黑穗病绿色防治的重要技术手段。
青稞黑穗病的病原菌侵染植株后,随着植株的生长而在其组织的细胞间和细胞内大量繁殖和延伸,尤其是在分生组织内,开花后在子房内大量繁殖,最终植株的花序被病原菌冬孢子所取代[15]。大麦坚黑粉菌与裸黑粉菌的区别在于,前者侵染后植株明显矮于健康植株,菌丝始终定殖在分生组织内,直到花器形成,病菌菌丝才侵入子房,形成被一层薄膜包裹的冬孢子,青稞收割脱粒过程中薄膜破裂释放出冬孢子,散落于田间或聚集于种皮,再与种子一同萌发,进而侵染种子的胚芽鞘进行再侵染。后者侵染后植株明显高于健康植株,病穗在露出苞叶后不久,黑粉团包膜破裂释放冬孢子,冬孢子随风飘落到附近植株正开口的花器中侵染子房,以休眠菌丝形态潜伏于种子内成为次年田间病害的初侵染源。基于二者带菌方式的不同,种子检测方式亦不同。大麦坚黑粉菌通过直接显微观察、洗涤离心种皮携带物进行显微观察以及冷冻吸水纸法等进行检测;祼黑粉菌主要通过种胚染色后显微观察。但这些方法均耗时耗力。在分子生物学方面,对青稞坚黑穗病的种子检测鲜见报道[16-17],青稞散黑穗的种子检测相对较多[18-21]。2005年Eibel等[22]开发、评估了ELISA法检测青稞黑穗病,但在检测种子带菌时需去除种皮、胚乳和盾片,时间和人力方面不占优势;2012年Wunderle等[23]用RT-PCR对不同生育时期小麦和青稞植物组织中的黑穗病菌进行定量检测,检测的灵敏度为40 ng/μL,远低于本研究的检测灵敏度,且LAMP检测在1 h内便可快速检测出目的基因,具有操作简单、灵敏度高、结果可视化等优点。
LAMP检测技术易受气溶胶污染而产生假阳性现象,为了避免开盖进行电泳检测后造成污染,本研究采用实时荧光LAMP和SYBR Green I显色法2种方法判定检测结果,并在体系中加入石蜡油进行密封处理。本试验对反应体系中dNTPs、甜菜碱、Mg2+、Bst DNA聚合酶及反应温度进行优化,结果显示在dNTPs浓度为1.8 mmol/L,甜菜碱浓度为0.8 mmol/L,Mg2+浓度为10 mmol/L,Bst DNA聚合酶浓度为320 U/mL的条件下,65 ℃下反应45~60 min,大麦坚黑粉菌和裸黑粉菌DNA模板最低检出限达到了2×10-4ng/μL。特异性检测结果表明该检测方法对大麦坚黑粉菌(U.hordei)和裸黑粉菌(U.nuda)具有特异性。这表明建立的LAMP检测体系可以快速、灵敏、特异地检测大麦坚黑粉菌(U.hordei)和裸黑粉菌(U.nuda)。
大麦坚黑粉菌和裸黑粉菌ITS基因序列同源性高达98%,加之目前可利用的其他分子信息较少,本试验采用的2种方法还不能直接区分大麦坚黑粉菌和裸黑粉菌,但大麦坚黑粉菌为种皮表面带菌,裸黑粉菌为种子内部带菌,因此,后续试验将从二者种子带菌方式不同为突破口,对青稞2种黑穗病菌开展进一步区分检测,并研发快速检测试剂盒,以期准确、快速检测青稞种子的带菌量,为青稞黑穗病的绿色防控提供参考。
4 结 论
本试验采用实时荧光LAMP和SYBR Green Ⅰ显色法对青稞黑穗病的LAMP检测体系及反应条件进行优化,优化后的LAMP反应体系为10×Isothermal Amplification Buffer 2.5 μL、dNTPs(10 mmol/L) 4.5 μL、甜菜碱(5 mol/L) 4 μL、MgSO4(100 mmol/L) 2.5 μL、Bst DNA聚合酶(8 000 U/ml)1 μL、引物(40 μmol/L内引物FIP/BIP、5 μmol/L外引物F3/B3、10 μmol/L环引物LF/LB各1 μL)6 μL、SYBR Green I(1∶1 000)1. 5 μL、20 ng/μL菌株DNA 2 μL,无菌去离子水补足25 μL,最后加入石蜡油20 μL密封。
本研究所建立的青稞黑穗病菌LAMP检测体系在65 ℃条件下,45 min即可特异性检出裸黑粉菌,60 min即可特异性检出大麦坚黑粉菌,检测灵敏度为2×10-4ng/μL。
DOI:10.13926/j.cnki.apps.00514.
DOI:10.13926/j.cnki.apps.00514.
