液相色谱-质谱法测定猪肉中五氯酚含量的不确定度评定
2021-09-09张婉梨
张婉梨


摘 要:目的:评定液相色谱-质谱法测定猪肉中五氯酚的不确定度。方法:分析液相色谱-质谱法测定猪肉中五氯酚的全过程,确定不确定度的来源和大小,合成不确定度,计算扩展不确定度并报出结果。结果:猪肉中五氯酚的含量为30.2 μg/kg,扩展不确定度为1.6 μg/kg(P=95%,k=2)。结论:通过分析对不确定度的来源和量化各分量评定,测量重复性对不确定度的影响较小。
关键词:液相色谱-质谱法;五氯酚;猪肉;不确定度
五氯酚(pentachlorophenol,PCP)及其钠盐(PCP-Na)是一种高效且廉价的抗菌剂、杀虫剂、除草剂、防腐剂,属于高毒有机氯农药[1-2]。五氯酚及其钠盐具有化学稳定的性质,不易被氧化,难被水解,是一种具有持久性和难降解的环境污染物。五氯酚及其钠盐会大量富集在生物体内[3-4],并通过食物链进入家禽畜、鱼等动物体内[5],残留在肉、蛋、鱼等动物源性食品中,通过食物链进入人体,对人体具有致畸、致癌和致突变作用,已被列为2B类致癌物和持久性有机污染物[6-7]。目前,五氯酚及其钠盐常用的检测方法有分光光度法[8]、气相色谱法[9-10]、气相色谱-质谱法[11-12]以及液相色谱-串联质谱法[13-14]等。《食品安全国家标准 动物源性食品中五氯酚残留量的测定 液相色谱-质谱法》(GB 23200.92—2016)[15]中规定了猪肝、猪肾、猪肉、牛奶、鱼肉、虾和蟹等动物源食品中五氯酚残留量的液相色谱-质谱测定方法。
不确定度评定是评定测量结果的可信程度,是提高样品检测结果可靠性的基础,标准不确定度越小則测量结果的可信度越高。《化学分析中不确定度的评估指南》(CNAS-GL 06:2006)[16]和《化学分析测量不确定度评定》
(JJF 1135—2005)[17]是评定测量水平的指标,也是判定测量结果可信度的依据[18]。在实际检测工作中,结果的不确定度存在不同的来源,如取样、基质效应和干扰、环境条件、质量和容量仪器的不确定度、测量方法和程序中的估计和假定以及随机变化等[19],使得测量过程与结果产生一定的误差,因此掌握并有效控制不确定度在检测工作中尤为重要[20]。目前,实验室通常利用不确定度的结果来判定检测结果符合性程度[21-22],同时不确定度的各分量也反映出测量过程中所有误差对测量结果的影响,分析检测中不确定度分量的主要来源[23],可提高检测过程测量结果的精
准度[24]。
本研究以猪肉为实验样品,对GB 23200.92—2016中液相色谱-质谱法检测五氯酚的方法进行了不确定度的评定,明确并分析实验过程中不确定的来源,量化各分量的不确定度,分析实验过程中各分量的不确定度对测定结果的影响,通过降低可控的不确定度从而提高检测结果的准确度,减少检测结果的误差,确保检测结果的准确性。
1 材料与方法
1.1 仪器与试剂
Waters超高效液相色谱-四级杆质谱联用仪UPLC I-CLASS/XEVOTQ-S;梅特勒电子天平PL602E;默克Mlili-Q Reference超纯水系统。
甲醇(HPLC,Honeywell)、乙腈(HPLC,Honeywell)、
氨水(AR,广州化学试剂厂)、乙酸铵(HPLC,上海麦克林生化科技有限公司)、甲酸(HPLC,Thermo)、去离子水、甲醇(LC-MS,Merck)、三乙胺(AR,广州化学试剂厂);甲醇中五氯酚钠溶液标准样品(100 μg/mL,扩展不确定度0.2 μg/mL,SB05-264-2012,农业部环境保护科研检测所);PAX固相萃取柱(60 mg/3 mL,CAT# AX0603,
Agela Technologies)。
1.2 试验方法
1.2.1 标准使用溶液配制
取五氯酚酸钠标准品10 μL,置于10 mL容量瓶中,用甲醇稀释到刻度,得到质量浓度为100 μg/L的标准储备溶液。
1.2.2 标准曲线绘制
取五氯酚的标准储备溶液100 μL于1 mL容量瓶中,用甲醇稀释到刻度线,可得到质量浓度为10 μg/L的标准物质中间液A。用50 μL移液器分别取5 μL、10 μL、20 μL标准储备溶液,5 μL、10 μL、20 μL中间液A于6个
1 mL容量瓶中,再分别加入适量的甲醇溶液使各个容量瓶中的溶液体积为1 mL,五氯酚酸钠(以五氯酚计)质量浓度分别为0.462 μg/L、0.924 μg/L、1.848 μg/L、4.62 μg/L、9.24 μg/L、18.48 μg/L的系列浓度标准溶液,上机测定,绘制标准曲线。
1.2.3 样品测定
提取:称取均质试样2 g(精确至0.01 g),置于离心管中,加入6 mL乙腈-水溶液(含5%三乙胺),均质提取涡旋混合,超声,离心,取上清液,重复提取1次,合并上清液,待净化。净化:PAX固相萃取柱先用5 mL甲醇、5 mL水活化,上样,依次用5 mL 5%氨水溶液、5 mL甲醇、5 mL 2%甲酸甲醇-水溶液淋洗,抽干后,用4 mL 4%甲酸甲醇溶液洗脱,收集洗脱液,40 ℃水浴下氮气浓缩至1 mL,用水定容至
10 mL,混匀,过0.22 μm滤膜,供测定。
1.2.4 仪器条件
色谱柱:Waters ACQUITY HSS T3 (2.1×100 mm,1.8 μm);
色谱柱流速:0.30 mL/min;色谱柱柱温:40 ℃;进样量:
1 μL;流动相:5 mmol/L乙酸铵溶液A,甲醇B;流动相梯度洗脱程序如表1所示。质谱条件:离子源:电喷雾离子源(ESI);检测方式:多反应监测(MRM);扫描方式:负离子模式;其他质谱参数如表2所示。
2 不确定度分量的来源分析
2.1 数学模型
采用标准曲线法计算测得值,本例依据GB 23200.92—2016将原公式试样中五氯酚的质量浓度的符号c改为ρ,见式(1)。
(1)
式中,X-样品中五氯酚含量,μg/kg;ρ试液-从标曲得到的样品试液中五氯酚的质量浓度,μg/L;v-定容体积,mL;m-样品称样量,g。
2.2 不确定度分量
根据分析数学模型和检测过程,检测结果的不确定度的分量包括了五氯标准溶液、样品制备、工作曲线拟合、样品测量重复性、样品加标回收率5个方面。不确定因果图见图1。
3 不确定度评定
3.1 标准溶液引入的不确定度
3.1.1 标准物质引入的不确定度
所使用的五氯酚标准物质溶液为农业部环境保护科研检测所的甲醇中五氯酚钠溶液标准样品,标准物质号为SB05-264-2012,查标准物质证书,标准物质浓度为100 μg/mL,不确定度为0.2%,按正态分布,取k=2,则标准物质引入的相对标准不确定为:
3.1.2 标准使用液引入的不确定度
用10 μL可调移液器移取10 μL五氯酚标准物质溶液,定容至10 mL容量瓶中,环境温度为(20±5)℃,甲醇的膨胀系数为1.19×10-3/℃。
(1)查《移液器检定规程》(JJG 646—2006)[25]得,0.1~10 μL可调移液器在10 μL点的容量允许误差的绝对值为10 μL×8.0 %=0.8 μL按矩形分布考虑,则标准不确定度为:
(2)查《常用玻璃量器检定规程》(JJG196—2006)[26]
得,10 mL容量瓶的允差為±0.020 mL,规程并未提供其他的信息,但生产过程中玻璃量器实际值靠近标定值的可能性远高于靠近极限值,因此按三角分布估算优于按矩形分布估算,则标准不确定度为:
(3)环境温度变化的相对标准不确定度为:
由以上3个不确定度分量可得,五氯酚标准使用液引入的相对标准不确定度为:
3.1.3 标准曲线配置引入的不确定度
使用100 μL、50 μL可调移液器取相应体积的标准使用液,使用1 mL容量瓶进行定容。
(1)查《移液器检定规程》(JJG 646—2006)[25]得,
100 μL可调移液器在100 μL点的容量允许误差的绝对值为
100 μL×2.0 %=2.0 μL按矩形分布考虑,则标准不确定度为:
(2)查《移液器检定规程》(JJG 646—2006)[25]得,
50 μL可调移液器的容量允许误差的绝对值为50 μL×5.0 %=1.5 μL
按矩形分布考虑,则标准不确定度为:
(3)查《常用玻璃量器检定规程》(JJG 196—2006)[26]得,1 mL容量瓶的允差为±0.010 mL,同理3.1.2中采用按矩形分布估算,则标准不确定度为:
由以上不确定度分量可得,五氯酚标准曲线配置引入的相对标准不确定度为:
3.1.4 标准溶液引入的相对不确定度
综合以上3个分量的不确定度,标准溶液引入的相对不确定度为:
3.2 样品制备引入的不确定度
3.2.1 样品称取引入的不确定度
样品的称量质量m的标准不确定度由天平允差导致的标准不确定u允差(m)和重复性限(含长期变动量)导致的标准不确定度u重复(m)两者方和根合成:
(1)评定天平允差导致的标准不确定度u允差(m)。查梅特勒电子天平PL602E的计量证书,电子天平的扩展不确定度U=0.02 g(包含因子k=2),则:
(2)重复性导致的标准不确定度u重复性(m)。查JJG 1036—2008,重复性限与允差数值相同,认为服从均匀分布,则:
g
m取表4中前两个平行样的平均值得:
3.2.2 样品制备引入的相对不确定度
样品制备过程使用了电子天平进行称取样品和10 mL容量瓶进行定容,由上文可知10 mL容量瓶的相对不确定度为0.008 2;综合以上两个分量的不确定度,样品制备引入的相对不确定度为:
3.3 工作曲线拟合引入的不确定度
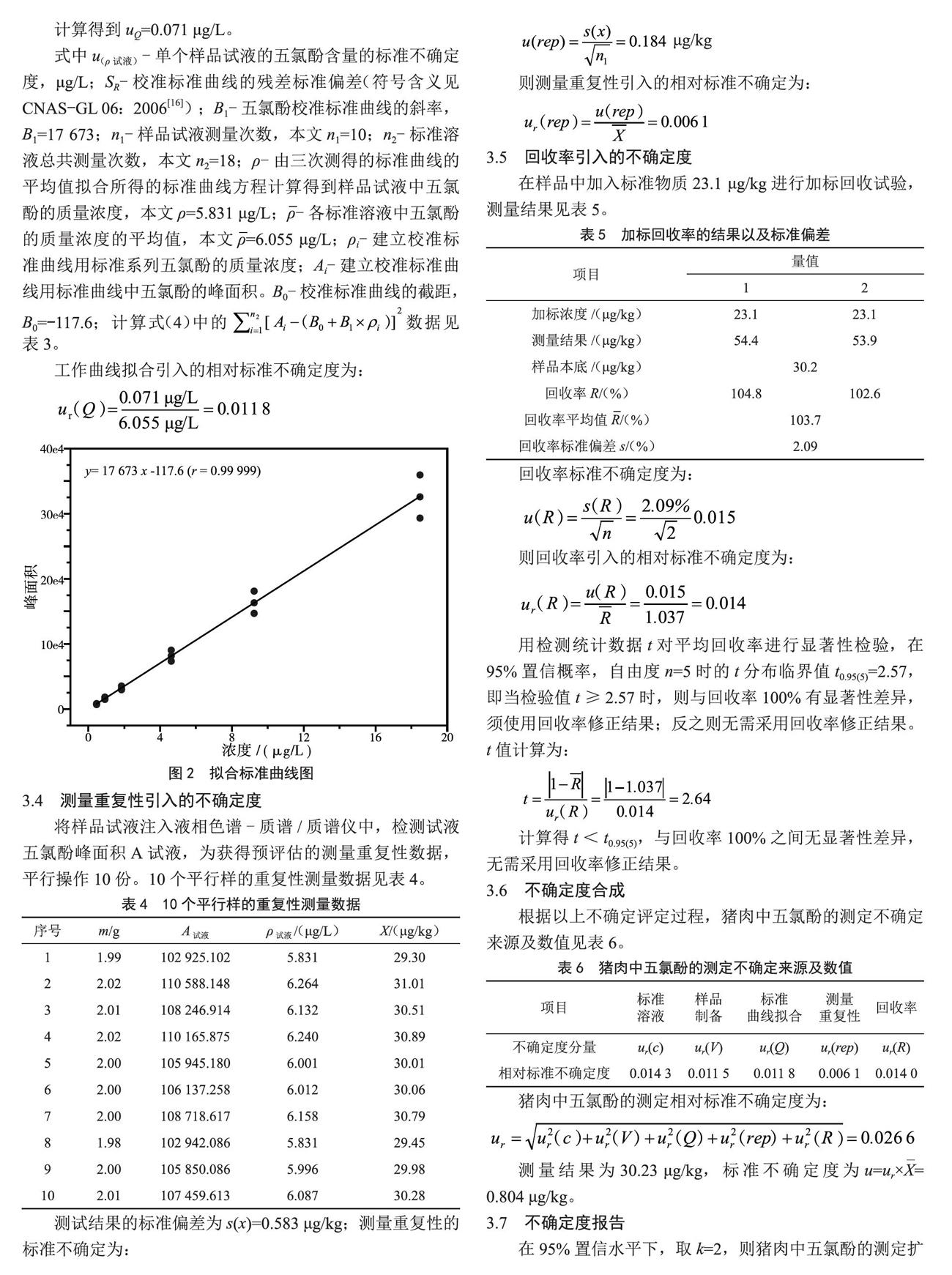
液相色谱-质谱/质谱法检测系列标液五氯酚的峰面积并拟合标准曲线方程,系列标准溶液检测数据见表3,以五氯酚的浓度为横坐标,峰面积为纵坐标,应用最小二乘法拟合标准曲线图,见图2。
拟合直线方程为:
A标=B1×ρ标+B0=17673×ρ标-117.6 (2)
式中,A标-建立校准标准曲线用标准曲线中五氯酚酸钠(以五氯酚计)的峰面积,无量纲;B1-标准曲线斜率,L/μg;ρ标-建立校准标准曲线用标准系列五氯酚的质量浓度,μg/L;B0-标准曲线截距,无量纲。
本例中校准标准曲线的建立见表3。参照《化学分析测量不确定度评定》(JJF1135—2005)[17],得:
(3)
(4)
计算得到uQ=0.071 μg/L。
式中u(ρ试液)-单个样品试液的五氯酚含量的标准不确定度,μg/L;SR-校准标准曲线的残差标准偏差(符号含义见CNAS-GL 06:2006[16]);B1-五氯酚校准标准曲线的斜率,B1=17 673;n1-样品试液测量次数,本文n1=10;n2-标准溶液总共测量次数,本文n2=18;ρ-由三次测得的标准曲线的平均值拟合所得的标准曲线方程计算得到样品试液中五氯酚的质量浓度,本文ρ=5.831 μg/L;ρ-各标准溶液中五氯酚的质量浓度的平均值,本文ρ=6.055 μg/L;ρi-建立校准标准曲线用标准系列五氯酚的质量浓度;Ai-建立校准标准曲线用标准曲线中五氯酚的峰面积。B0-校准标准曲线的截距,B0=-117.6;计算式(4)中的数据见表3。
工作曲线拟合引入的相对标准不确定度为:
3.4 测量重复性引入的不确定度
将样品试液注入液相色谱-质谱/质谱仪中,检测试液五氯酚峰面积A试液,为获得预评估的测量重复性数据,平行操作10份。10个平行样的重复性测量数据见表4。
测试结果的标准偏差为s(x)=0.583 μg/kg;测量重复性的标准不确定为:
μg/kg
则测量重复性引入的相对标准不确定为:
3.5 回收率引入的不确定度
在样品中加入标准物质23.1 μg/kg進行加标回收试验,测量结果见表5。
回收率标准不确定度为:
则回收率引入的相对标准不确定度为:
用检测统计数据t对平均回收率进行显著性检验,在95%置信概率,自由度n=5时的t分布临界值t0.95(5)=2.57,即当检验值t≥2.57时,则与回收率100%有显著性差异,须使用回收率修正结果;反之则无需采用回收率修正结果。t值计算为:
计算得t 3.6 不确定度合成 根据以上不确定评定过程,猪肉中五氯酚的测定不确定来源及数值见表6。 猪肉中五氯酚的测定相对标准不确定度为: 测量结果为30.23 μg/kg,标准不确定度为u=ur×X=0.804 μg/kg。 3.7 不确定度报告 在95%置信水平下,取k=2,则猪肉中五氯酚的测定扩展不确定度为: U=k×u=1.608 μg/kg 根据《测量不确定度评定与表示》(JJF 1059.1—2012)[27],取1位或2位有效数字为最终报出结果,猪肉中五氯酚的检测结果为:X=(30.2±1.6) μg/kg,k=2。 对比QuEChERS-UPLC-MS/MS法[28]测定结果(3.39±0.20) μg/kg,k=2(合成相对标准不确定为0.099 78)以及UPLC-MS/MS法[29]测定猪肝中五氯酚残留量为(14±3) μg/kg,k=2(合成相对标准不确定为0.030 1),本文检测结果的可信度较高。 4 结论 本文对液相色谱-质谱法测定猪肉中的五氯酚进行了不确定度评定,通过对不确定度的来源分析及各分量的量化评定,测量重复性的不确定度分量最小,标准溶液、样品制备、标准曲线拟合和回收率对不确定度的影响程度相当。在实际检验工作中,可通过增加样品的测量次数,或通过加标试验、质控样品、人员比对、仪器比对等其他质控方式以及选择合适浓度范围的标准溶液配置标准曲线等,减小测量的不确定度,保证检测结果的准确性。 参考文献 [1]闵剑青,陈梅兰,陈晓红,等.离子液体超声辅助萃取/LC–MS法测定环境水中痕量五氯酚[J].分析测试学报,2015,34(4):438-442. [2]Zheng WW,Yu H,Wang X,et al.Systematic review of pentachlorophenol occurrence in the environment and in humans in China: Not a negligible health risk due to the re-emergence of schistosomiasis [J].Environ Int,2012,42:105-116. [3]胡滨,陈一资,胡惠民.动物性食品中五氯酚钠残留及对人畜毒害的研究[J].肉品卫生,2005(2):27-29. [4]杨淑贞,韩晓冬,陈伟.五氯酚对生物体的毒性研究进展[J].环境与健康杂志,2005(5):396-398. [5]刘印平,云鹏,陆杨,等.河北省淡水鱼中五氯酚钠的残留调查[J].食品安全质量检测学报,2020,11(20):7642-7646. [6]夏勇,董晓岚,孟真,等.五氯酚钠的发育毒性和遗传毒性研究[J].预防医学,2016,28(11):1081-1086. [7]陈海刚,李兆利,徐韵,等.五氯酚钠对鲤鱼肾细胞DNA损伤的体内和体外研究[J].环境与健康杂志,2006(6):515. [8]肖振林,丛俏,曲蛟,等.紫外分光光度法测定土壤中五氯酚[J].理化检验(化学分册),2010,46(6):660-662. [9]费志良,葛家春,吴军,等.气相色谱测定青虾、草鱼肌肉中五氯苯酚及其钠盐残留总量的方法[J].南京师大学报(自然科学版),2004(3):70-73. [10]王姣,朱吉凯,张蕾,等.除草剂五氯酚钠对环境卫生污染中食品用纸制品的分析测试研究[J].中国卫生产业,2020,17(17):165-167. [11]王志强.硫酸磺化-气相色谱/质谱联用法测定土壤中五氯酚及其钠盐[J].环境卫生学杂志,2019,9(1):68-72. [12]Schmidt L,Guen T.Simultaneous determination of the full chlorophenol spectrum in human urine using gas chromatography with tandem mass spectrometry[J].Analytica Chimica Acta,2017,965:123-130. [13]赵浩军,杨青梅岭,张燕,等.QuEChERS-高效液相色谱-串联质谱法同时测定猪肉中氯霉素、氟苯尼考和五氯酚的残留量[J].食品安全质量检测学报,2020,11(12):4121-4126.
[14]王连珠,方恩华,王彩娟,等.QuEChERS-超高效液相色谱-串联质谱法测定动物源食品中痕量五氯酚及其钠盐[J].色谱,2018,36(6):518-522.
[15]国家卫生和计划生育委员会,农业部,国家食品药品监督管理总局.食品安全国家标准 动物源性食品中五氯酚残留量的测定 液相色谱-质谱法:GB 23200.92—2016[S].北京:中国标准出版社,2016.
[16]中国合格评定国家认可委员会.化学分析中不确定度的评估指南:CNAS-GL06:2006[S].2006-06-01.
[17]国家质量监督检验检疫总局.化学分析测量不确定度评定:JJF 1135—2005[S].北京:中国计量出版社,2005.
[18]陈晓敏,陈科,熊含鸿,等.电感耦合等离子体质谱法测定肉制品中总砷的不确定度评定[J].食品安全质量检测学报,2018,9(12):2986-2992.
[19]陈何娟,熊含鸿,何海茵,等.滴定法测定饼干中油脂过氧化值的不确定度评定[J].食品安全质量检测学报.2019,10(13):4174-4177.
[20]尚德军,王军.测量不确定度的与研究和应用进展[J].理化检验(化学分册),2004(10):623-627.
[21]安平,刘浩峰,华广胜.检测实验室测量不确定度评定与应用现状[J].中国检验检测,2018,26(6):60-63.
[22]向德磊.金属铟中锡的ICP-AES测定方法不确定评定及在产品符合性判定中的应用[J].矿产与地质,2016,30(3):
509-512.
[23]赵娜,孙轶,王奇峰,等.浅谈测量不确定度的评定在环境与可靠性实验室中的应用[J].数字通信世界,2018(12):169.
[24]熊含鸿,李南,何海茵,等.气相色谱法测定白酒中氰化物的不确定度评定[J].食品安全质量检测学报,2019,10(13):4062-4067.
[25]国家质量监督检验检疫总局.移液器检定规程:JJG 646—2006[S].北京:中国计量出版社,2006.
[26]国家质量监督检验检疫总局.常用玻璃量器检定规程:JJG 196—2006[S].北京:中国计量出版社,2006.
[27]国家质量监督檢验检疫总局.测量不确定度评定与表示:JJF 1059.1—2012[S].北京:中国标准出版社,2012.
[28]谭美龄,阎睿,谭顺中.UPLC-MS/MS法测定食品中五氯酚及其钠盐的不确定度分析[J].现代食品,2019(15):133-137.
[29]欧阳丽,汪辉,何翊,等.UPLC-MS/MS测定猪肝中五氯酚残留量的不确定度评定[J].食品与机械,2019,35(9):84-88.
