厚壳贻贝肠道细菌的生物被膜对其幼虫和稚贝附着的影响
2021-09-09徐嘉康王劲松方怡涵杨金龙梁箫
徐嘉康,王劲松,方怡涵,杨金龙,3,梁箫*
( 1.上海海洋大学 国家海洋生物科学国际联合研究中心,上海 201306;2.上海海洋大学 水产种质资源发掘与利用教育部重点实验室,上海 201306;3.南方海洋科学与工程广东省实验室(广州),广东 广州 511458)
1 引言
厚壳贻贝(Mytilus coruscus)和大多数海洋无脊椎动物一样,幼虫在发育到一定阶段后会经历“附着变态”而发育成稚贝、长成成贝[1-2]。同时,厚壳贻贝的稚贝或成贝在周围生活环境发生变化时会自动切断足丝,爬到其他生态位寻找到新的附着基质后,经过“二次附着”后在新的环境中生长[1-5]。厚壳贻贝作为我国重要的海水经济贝类之一,附着变态的成功与否直接影响育苗过程中的苗种产量和质量,稚贝的二次附着则影响贻贝的包苗和中间培育,因此在厚壳贻贝的养殖产业中,幼虫附着变态和稚贝二次附着是决定其经济效益与发展前景的重要技术环节。
海洋细菌所形成的生物被膜在海洋无脊椎动物的生长发育过程中扮演着重要的角色[6-8]。研究表明 ,Shewanella[9]、Vibrio[10-11]、Pseudoalteromona[12-13]、Bacillus[13]等属的海洋细菌都能调控厚壳贻贝幼虫的附着变态和稚贝的二次附着。海洋细菌种类多种多样且分布广泛,在海水、海洋沉积物和海洋生物体内均能发现并分离[13-15]。然而,并非所有海洋细菌都适合于实际生产应用,例如弧菌在一定条件下会具有一定的致病性[16-19],这一特性使得在养殖过程中对贻贝健康和产品的品质管控存在一定的风险[20-22],所以在实际的贻贝生产应用中,选取一种有效且安全的细菌至关重要。
肠道细菌在脊椎动物和无脊椎动物中均能发现其踪迹,并在一定的相互作用下形成较稳定的微生态系统[23]。肠道细菌种类丰富而且数量庞大,具有提高宿主的免疫力、调节生长发育、提高肠的屏障功能等[24-25]特殊的生理功能。研究表明[13],一些肠道细菌可以促进厚壳贻贝稚贝进行二次附着,但肠道细菌能否诱导其幼虫的附着变态以及肠道细菌、生物被膜、贝类的附着行为三者之间的关系等问题报道较少。
本研究从厚壳贻贝的肠道中分离出10株细菌分别形成生物被膜,检测其对厚壳贻贝幼虫附着变态和稚贝二次附着的影响,筛选出在诱导厚壳贻贝附着过程中有高、低诱导活性的肠道细菌,对其所形成生物被膜的胞外产物的分布和量进行分析,旨在通过本研究阐明厚壳贻贝的附着与不同种类的肠道细菌之间的关系,为肠道细菌在贝类人工育苗和海区养殖过程中的应用提供理论依据。
2 材料和方法
2.1 实验材料
从浙江省嵊泗县枸杞岛附近海域(30.72°N,122.76°E)取回实验所需的成体厚壳贻贝。取回时壳长为(9.5±0.5)cm,壳高为(4.7±0.5)cm。
本实验所使用的厚壳贻贝眼点幼虫和稚贝源于东海贻贝科技创新服务有限公司。眼点幼虫壳长为(279.5±21.5)μm,壳高为(247.0±17.5)μm,稚贝壳长为(0.85±0.15)mm,壳高为(0.56±0.11)mm。
2.2 肠道细菌的相关分析
2.2.1 肠道细菌的分离
将肠道细菌从成体厚壳贻贝肠道中分离的方法参照Li等[26]的方法,使用灭菌的解剖剪将肠道从成体厚壳贻贝中分离并置于离心管中,刮取肠道内壁物质于灭菌过滤海水(Autoclaved Filtered Sea Water, AFSW)中,将所得到的细菌悬浮液进行梯度稀释10 000倍后用于分离细菌,所分离的菌株都储存在含有30%甘油的0.9%NaCl的溶液中,并置于实验室-80℃冰箱中低温保存。
2.2.2 肠道细菌16S rRNA基因测序
细菌16S rRNA基因序列PCR扩增及序列比对参照Li等[26]的实验方法,使用细菌基因组DNA试剂盒(上海博彩生物科技有限公司)提取细菌DNA,将提取的DNA序列PCR扩增后送到上海生工生物工程有限公司进行基因测序,将所得到的基因序列上传至NCBI数据库获得 Accession No.等信息。
2.2.3 系统发育分析
系统发育分析参照杨金龙等[2]的方法,使用MEGA 6.06程序进行测序,序列与其近源物种的16S rRNA基因序列比对。系统发育分析使用最大简约法、最小进化法和邻接法3种方法进行构建,物种间遗传距离使用Jukes-Cantor法。选取大肠杆菌(Escherichia coli)(序列号为 AONF01000005.1)作为外群序列来进行构建系统发育树。
2.3 生物被膜的相关分析
2.3.1 生物被膜的制备
参照杨金龙等[2]的方法来制备实验所需的单一细菌生物被膜,分离纯化得到的单株肠道细菌使用ZoBell 2216E培养基在25℃的黑暗条件下进行扩大培养,培养24 h后在3 500 r/min 的条件下离心15 min,倒掉培养液用AFSW清洗3次,用50 mL AFSW悬浮所得到的细菌,按照实验所需的 1×106cells/mL、1×107cells/mL、 1×108cells/mL、 3×108cells/mL、 5×108cells/mL和1×109cells/mL这6个初始细菌密度计算加入灭菌培养皿中的细菌悬浮液体积,在18℃的黑暗条件下培养48 h得到实验所需的生物被膜。
2.3.2 生物被膜的细菌密度计数
参考Yang等[27]的方法来对生物被膜上的细菌进行计数,使用5%甲醛溶液将生物被膜固定24 h,固定后使用0.1%吖啶橙染液避光染色5 min,染色后去除多余染液,避光晾干后置于荧光显微镜(奥林巴斯BX51)×1 000放大倍率下进行观察,每株细菌的每个初始细菌密度设置3个平行组,每个平行组随机取10个视野计算细菌密度。其计算公式为
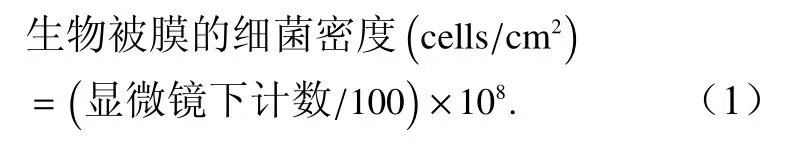
2.3.3 生物被膜形态及厚度分析
生物被膜形态及厚度分析按照Yang等[27]的方法,选取在 5×108cells/mL浓度下对Bacillussp.4和Phaeobactersp.1的生物被膜进行分析。使用5%甲醛溶液将生物被膜固定24 h,用5 mg/L的碘化丙啶(PI)溶液避光染色15 min,避光晾干后在徕卡激光共聚焦扫描显微镜(Leica TCS SP8)×630放大倍率下拍摄,使用FV10-ASW 3.0软件获取激光扫描聚焦显微镜(Confocal Laser Scanning Microscope, CLSM)图像,分析生物被膜细菌胞外产物含量。
2.4 厚壳贻贝附着实验
2.4.1 厚壳贻贝幼虫附着变态实验
厚壳贻贝幼虫附着变态实验参考Yang等[27]的方法,在高温灭菌的玻璃培养皿中放入附有生物被膜的载玻片,加入20 mL AFSW和20个幼虫,在18℃黑暗条件下培养24 h、48 h、72 h和96 h后记录幼虫的附着变态率,每株实验细菌的各个初始细菌密度均设9个平行组,以高温灭菌的没有生物被膜黏附的洁净载玻片作为对照组。
2.4.2 厚壳贻贝稚贝附着实验
厚壳贻贝稚贝附着实验参考杨金龙等[2]的方法,在高温灭菌的玻璃培养皿中放入附有生物被膜的载玻片,加入20 mL AFSW和10个稚贝,在18℃黑暗条件下培养6 h、12 h、24 h和48 h 后记录稚贝的附着率,每株实验细菌的各个初始细菌密度均设9个平行组,以高温灭菌的没有生物被膜黏附的洁净载玻片作为对照组。
2.5 胞外产物分析
2.5.1 生物被膜的荧光染色
参考Peng等[12]的方法对生物被膜进行染色,在5×108cells/mL浓度下对Bacillussp.4和Phaeobactersp.1的生物被膜进行分析。生物被膜分别使用DiD’oil、FITC、ConA-TMR和CFW染液对胞外脂类、蛋白质、α-多糖和β-多糖进行避光染色25 min,其中进行胞外蛋白质染色的生物被膜需提前使用5%甲醛溶液固定24 h,染色后去除多余染液,避光晾干后在徕卡激光共聚焦扫描显微镜(Leica TCS SP8)×630放大倍率下拍摄,使用FV10-ASW 3.0 软件获取CLSM图像,分析生物被膜细菌胞外产物含量。
2.5.2 CLSM 图像分析
CLSM 图像分析方法按照Peng等[12]的分析方法。使用Image J软件(美国国家卫生研究院)计算生物被膜的生物体积,生物体积表示生物被膜胞外产物的单个成分的量。其计算公式为

2.6 数据处理
数据处理按照杨金龙等[2]的方法,使用JMP软件进行数据分析和相关性检验。相关性分析方法使用Spearman'多元分析方法分析,其中p为检验值,p小于0.05时说明具有显著性的差异。
3 结果
3.1 肠道细菌的测序与表型
本实验所分离纯化的10株肠道细菌的信息见表1。本实验所分离的细菌均为不同的菌属,其中Bacillussp.4属于厚壁菌门,Flavobacteriumsp.1、Arenibactersp.1、Mesoflavibactersp.1和Tenacibaculumsp.3属于拟杆菌门,而另外5株细菌Paracoccussp.2、Pseudoalteromonassp.30、Ruegeriasp.2、Ahrensiasp.1和Phaeobactersp.1 属于变形菌门。不同肠道细菌的表型如图1所示。

图1 实验所用贻贝肠道细菌的表型Fig.1 Phenotypes of the different bacterial strains from mussel intestinal in tested

表1 肠道细菌16S rRNA基因序列分析Table 1 16S rRNA gene sequence analysis of the intestinal bacterial strains
3.2 肠道细菌的生物被膜诱导活性
本实验中的10株肠道细菌在测试时间内对厚壳贻贝附着的诱导活性趋势基本相同,因此幼虫仅展示48 h、稚贝仅展示24 h的诱导活性结果。如图2A所示,所用肠道细菌均具有诱导活性,幼虫的稚贝率为10%~50%。Bacillussp.4具有最高的诱导活性(p<0.05),诱导活性为(42.78±1.21)%,Phaeobactersp.1具有最低的诱导活性,诱导活性为(10.50±1.30)%。
如图2B所示,所用肠道细菌均具有诱导活性,稚贝的附着率为20%~95%。Phaeobactersp.1具有最高的诱导活性(p<0.05),诱导活性为(92.22±2.35)%,Flavobacteriumsp.1具有最低的诱导活性,诱导活性为(20.00±1.75)%。

图2 不同肠道细菌对厚壳贻贝的诱导作用Fig.2 Induction of settlement of Mytilus coruscus on the different intestinal bacterial biofilms
3.3 生物被膜细菌密度
在本实验中,所测试的10株肠道细菌的最终细菌密度会因为初始细菌密度的变化呈现出不同的趋势,实验所用肠道细菌大部分在5×108cells/mL时成膜效果最好,因此这里选取在5×108cells/mL时形成生物被膜的细菌密度进行展示。10株肠道细菌中Flavobacteriumsp.1的细菌密度最高,和除Phaeobactersp.1以外的 8株细菌均有显著性差异(p<0.05),Arenibactersp.1的细菌密度最低(图3)。
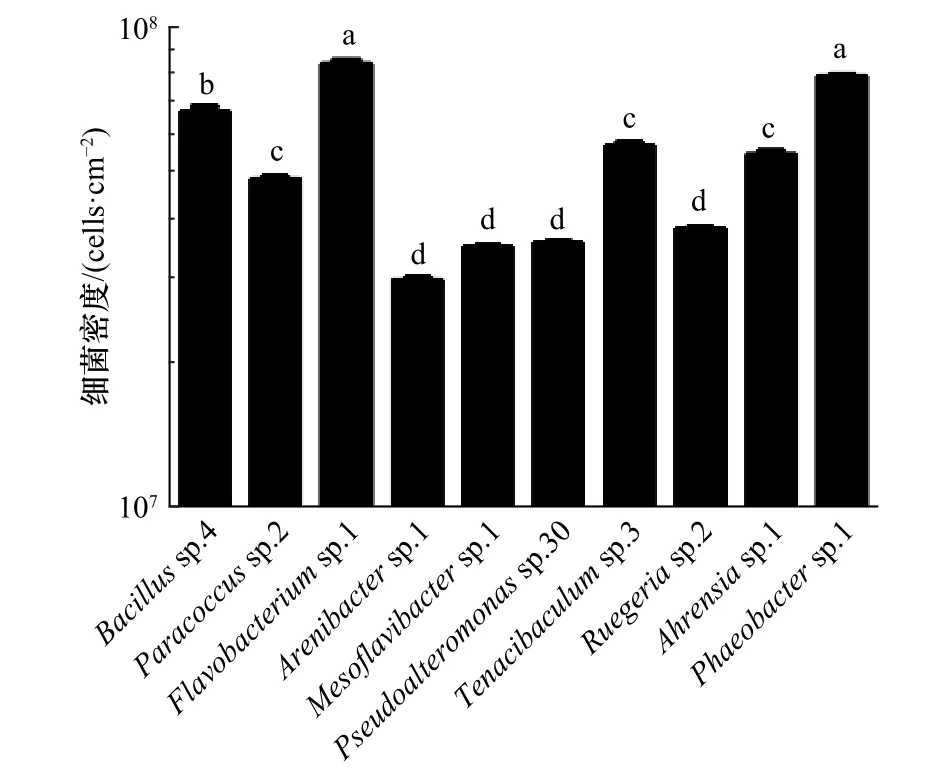
图3 不同肠道细菌生物被膜的细菌密度Fig.3 The bacterial density of different intestinal bacterial biofilms
3.4 生物被膜细菌密度与其诱导活性之间的相关性
10株细菌生物被膜的细菌密度与其对厚壳贻贝幼虫和稚贝诱导活性的相关性关系见表2。10株肠道细菌中Paracoccussp.2、Pseudoalteromonassp.30和Ruegeriasp.2对幼虫和稚贝诱导活性均显著相关(p<0.05)。Bacillussp.4 和Ahrensiasp.1 对幼虫的诱导性显著相关(p<0.05)。Flavobacteriumsp.1、Arenibactersp.1和Phaeobactersp.1对稚贝的诱导活性显著相关 (p<0.05)。Mesoflavibactersp.1和Tenacibaculumsp.3对幼虫和稚贝的诱导活性均不相关(p>0.05)。

表2 细菌密度与诱导活性的相关性分析Table 2 Correlation analyses between the bacterial density and inducing activity
3.5 肠道细菌的系统发育分析
通过3种分析进行肠道细菌的系统发育发现,所得到的结果一致,因此本研究以邻接法的分析结果进行展示(图4),表3为本研究所用细菌的遗传距离。结果显示,Paracoccussp.2与Flavobacteriumsp.1的遗传距离为0.011,是测试肠道细菌中遗传距离最近的。上述2株细菌聚为一支后与Ruegeriasp.2及Phaeobactersp.1聚为一支。这一分支再与同属于变形菌门的Bacillussp.4、Ahrensiasp.1和属于厚壁菌门的Pseudoalteromonassp.30这3株细菌聚为另一分支,最后再和Arenibactersp.1、Mesoflavibactersp.1和Tenacibaculumsp.3这3株细菌聚类。

表3 本实验中肠道细菌的遗传距离Table 3 Genetic distances of intestinal bacterial in tested
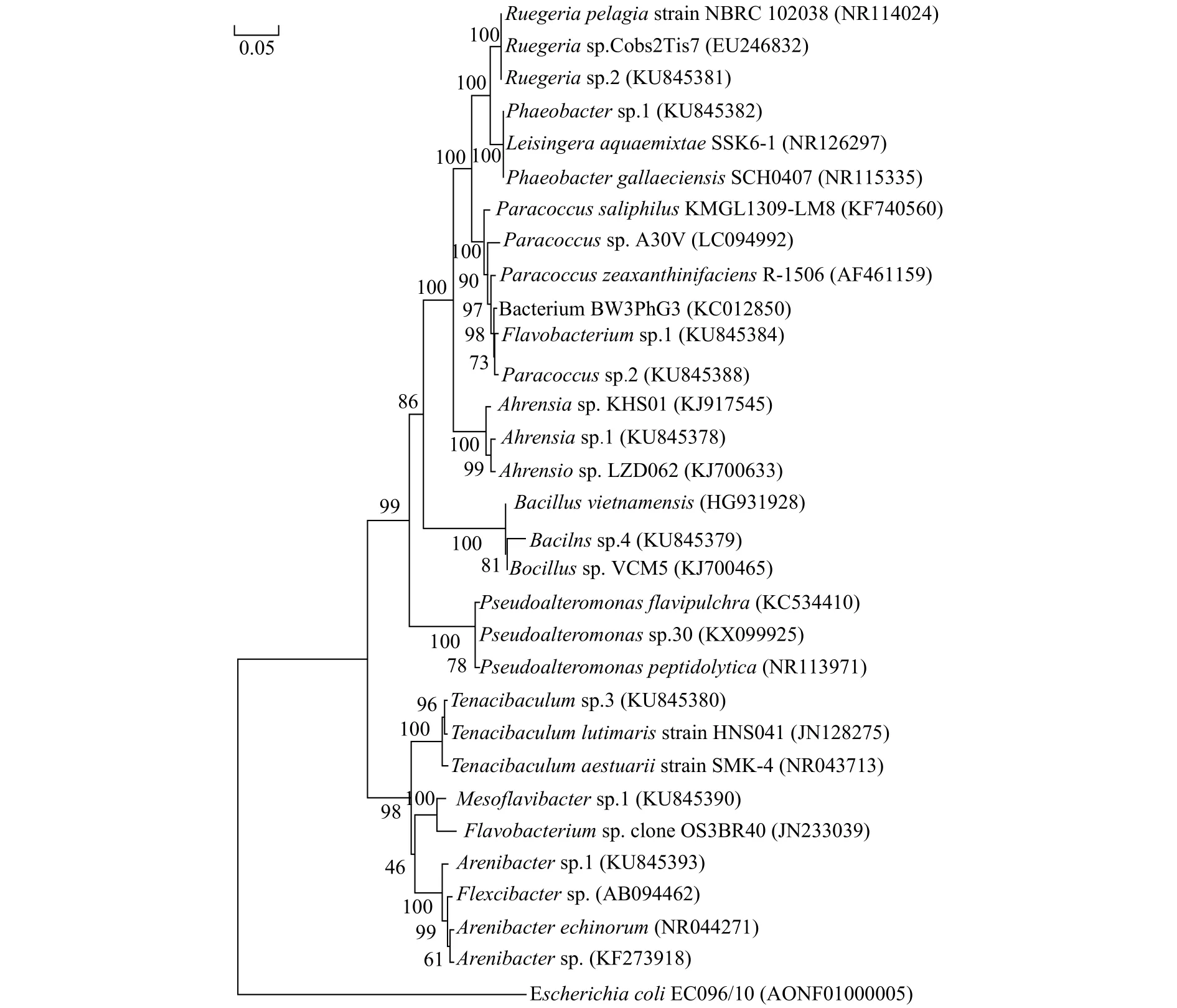
图4 本实验中肠道细菌的系统进化树Fig.4 Phylogenetic tree of intestinal bacterial in tested
3.6 肠道细菌的生物被膜形态和厚度
通过CLSM图片明显发现,Bacillussp.4和Phaeobactersp.1生物被膜的状态明显不同(图5A)。Phaeobactersp.1的膜厚为(8.86±0.25)μm,且Phaeobactersp.1比Bacillussp.4的细菌分布更加的聚集。
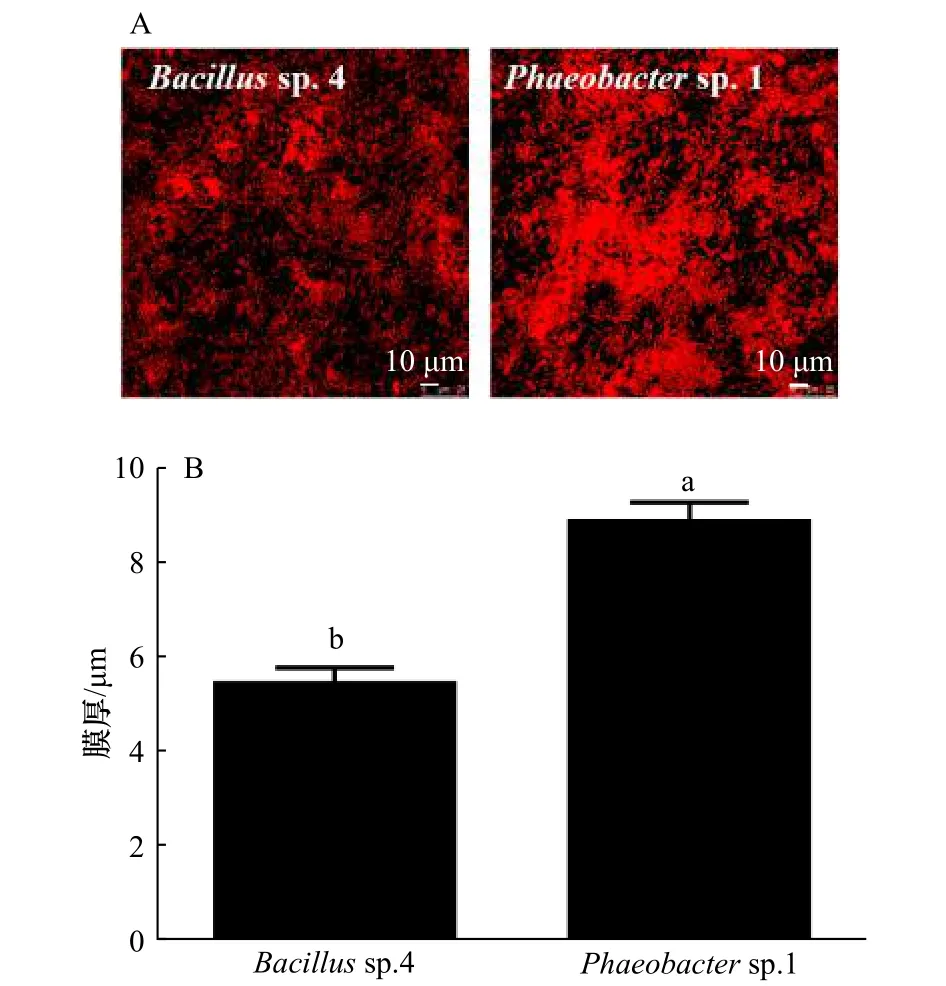
图5 Bacillus sp.4和Phaeobacter sp.1的生物被膜图像(A)及膜厚(B)Fig.5 Biofilm images (A) and biofilm thickness (B) of Bacillus sp.4 and Phaeobacter sp.1
通过分析膜厚和诱导活性的相关性发现(表4),Bacillussp.4的膜厚与幼虫和稚贝的诱导活性均不相关(p>0.05);Phaeobactersp.1 的膜厚与稚贝的诱导活性显著相关(p<0.05)而对幼虫的诱导活性不相关(p>0.05)。

表4 膜厚与诱导活性的相关性分析Table 4 Correlation analyses between the biofilm thickness and inducing activity
3.7 CLSM图像和胞外产物含量
如图6所示,2株细菌胞外产物中蛋白质、α-多糖和β-多糖的分布和含量具有显著性差异(p<0.05)。Bacillussp.4的胞外蛋白质、α-多糖和β-多糖含量显著高于Phaeobactersp.1(p<0.05),Bacillussp.4 分泌胞外产物的能力高于Phaeobactersp.1。

图6 生物被膜的CLSM图像分析Fig.6 The analysis of CLSM images of biofilms
通过分析胞外产物与其诱导活性的相关性发现(表5,表6),Bacillussp.4 的胞外产物中,胞外蛋白、α-多糖和β-多糖与幼虫的诱导活性显著相关(p<0.05),而胞外脂类与幼虫的诱导活性不相关(p>0.05)。α-多糖与稚贝的诱导活性显著相关且呈负相关性(p<0.05),而脂类、蛋白质和β-多糖与对稚贝的诱导活性不相关(p>0.05)。

表5 胞外产物与幼虫诱导活性的相关性分析Table 5 Correlation analyses between extracellular product and inducing activity of larvae

表6 胞外产物与稚贝诱导活性的相关性分析Table 6 Correlation analyses between the extracellular product and inducing activity of plantigrade
Phaeobactersp.1形成的生物被膜胞外产物中,蛋白质与幼虫的诱导活性显著相关且呈负相关性(p<0.05),而脂类、α-多糖和 β-多糖与幼虫的诱导活性不相关(p>0.05)。α-多糖与稚贝的诱导活性显著相关(p<0.05),而脂类、蛋白质和 β-多糖与稚贝的诱导活性不相关(p>0.05)。
4 讨论
本研究所测试的10株厚壳贻贝肠道细菌均为不同的菌属,经培养都能够形成生物被膜,并且最终形成生物被膜的细菌密度会根据初始细菌密度变化而变化,具体变化趋势根据菌种的不同具有不同的趋势。10株肠道细菌形成的生物被膜对厚壳贻贝幼虫和稚贝均具有诱导活性,并且因菌种不同表现出不同的诱导活性,这表明,细菌菌种与诱导活性之间没有必然联系,这与以往的研究结果一致[2,4,13,26-27]。
以往研究表明,在厚壳贻贝肠道及东海近海海区的自然生物被膜中均分离出相同的菌属。与本研究相比较,在2017年研究中[13],从厚壳贻贝肠道分离出与本研究相同的Tenacibaculum、Bacillus、Ruegeria和Paracoccus菌属;从自然生物被膜中也曾分离出Tenacibaculum[4,26-27]、Bacillus[4,28]和Pseudoalteromonas[4,26-28]3个与本研究相同菌属的细菌。以往研究已证明了宿主生存的环境会影响肠道细菌的群落[29-30],肠道作为厚壳贻贝主要的消化器官,可能会因滤食作用将环境中的细菌摄入到肠道内,因此推测,本研究的10株细菌可能来源于厚壳贻贝生存的外界环境。
4.1 肠道细菌的生物被膜对厚壳贻贝幼虫附着变态的诱导活性
在以往的研究中,单一菌株形成生物被膜后的细菌密度、膜厚、胞外产物等生物学特性与海洋无脊椎动物幼虫附着变态具有一定的相关性。Peng等[12]的研究发现,7株Pseudoalteromonas中有3株的生物被膜细菌密度与M.coruscus幼虫诱导活性呈显著相关性,与另外4株细菌无相关性。Bao等[31]的实验结果发现,5株细菌中仅有Alteromonassp.1这1株的细菌密度与Mytilus galloprovincialis幼虫的诱导活性呈显著相关性。Tran和Hadfield[32]的研究中,仅有Pseudoalteromonas luteoviolacea细菌生物被膜的细菌密度与Pocillopora damicornis幼虫的诱导活性呈显著相关性,其余细菌与诱导活性均没有相关性。在本研究所测试的10株肠道细菌被膜的细菌密度与诱导活性中,有5株细菌呈相关性,另外5株无相关性,表明细菌呈现出相关性不具有普遍性,因而生物被膜的细菌密度并不是影响厚壳贻贝幼虫附着变态的主要因素。
根据Yang等[27]的研究发现,诱导活性无显著差异的Tenacibaculumsp.1和Pseudoalteromonassp.1的膜厚和其他测试的细菌相比有显著差异。本研究中,Phaeobactersp.1形成的生物被膜的膜厚显著高于Bacillussp.4,但Bacillussp.4的诱导活性显著高于Phaeobactersp.1,因此生物被膜的膜厚不是影响厚壳贻贝幼虫附着变态的主要因素。本研究针对细菌的遗传进化对厚壳贻贝幼虫的附着变态诱导活性相关性分析,结果表明具有较远遗传距离的Bacillussp.4和Arenibactersp.1的诱导活性无差异,遗传距离较近的Ruegeriasp.2和Flavobacteriumsp.1有显著性差异。这一结果证明了细菌遗传距离与诱导活性之间没有必然联系,与以往研究结果一致[27]。
Peng等[12]的研究表明,胞外产物中的表面活性物质可以促进厚壳贻贝幼虫的附着行为和附着变态率。Liang等[33]的研究表明,ΔfilP菌株分泌的鞭毛蛋白可以促进厚壳贻贝幼虫的附着变态,Peng等[34]的研究表明,Δ01912菌株的胞外产物可拉酸过量分泌同样可以促进厚壳贻贝幼虫的附着变态。本研究发现,具有高诱导活性的Bacillussp.4生物被膜胞外产物中胞外蛋白、α-多糖和β-多糖的含量显著高于Phaeobactersp.1。通过对胞外产物和诱导活性相关性分析发现,2株肠道细菌的胞外蛋白与厚壳贻贝幼虫的诱导活性均具有显著相关性,但与Phaeobactersp.1呈现为负相关。因而,α-多糖和β-多糖在诱导厚壳贻贝幼虫中起重要作用,胞外蛋白会因菌属的不同而影响厚壳贻贝幼虫的附着。
4.2 肠道细菌的生物被膜对厚壳贻贝稚贝附着的诱导活性
在以往单一菌株形成生物被膜对厚壳贻贝稚贝的研究中发现,实验所用细菌中,大部分细菌生物被膜的细菌密度与诱导活性呈显著相关性。本研究中,10株细菌中有6株的细菌密度与诱导活性呈相关性。梁箫等[9]的研究结果发现,厚壳贻贝稚贝的附着率会根据弧菌形成生物被膜的膜厚变化而变化,且变化趋势相同。本研究中,同一初始细菌密度下形成的生物被膜,高诱导活性的Phaeobactersp.1的膜厚显著高于Bacillussp.4。相关性分析表明,Phaeobactersp.1的膜厚和诱导活性之间是显著相关的。由此可见,生物被膜的细菌密度、膜厚可以影响厚壳贻贝稚贝的附着。而细菌的遗传进化与厚壳贻贝稚贝的附着没有相关性[2,4,13]。本研究中,遗传距离最近的Paracoccussp.2和Flavobacteriumsp.1的诱导活性具有显著性差异,遗传距离最远的Bacillussp.4和Tenacibaculumsp.3的诱导活性没有显著性差异。这一结果和细菌遗传进化与诱导活性之间无必然联系的结论相一致。
生物被膜胞外产物对厚壳贻贝稚贝的附着起重要作用。梁箫等[10]的实验结果发现,3株弧菌生物被膜胞外多糖含量与形成时间有关,随时间增加,胞外多糖含量先增多再减少,胞外多糖含量变化与3株弧菌生物被膜对厚壳贻贝稚贝的诱导活性结果相似。本研究中,2株肠道细菌的生物被膜胞外产物中,α-多糖与诱导活性均呈显著相关,但Bacillussp.4呈现为负相关。因而,α-多糖可能在诱导厚壳贻贝稚贝中发挥了重要作用,存在会因菌属的不同而影响厚壳贻贝稚贝的附着。
4.3 同株肠道细菌的生物被膜对厚壳贻贝幼虫和稚贝附着的影响
以往研究中,单一细菌生物被膜对厚壳贻贝幼虫和稚贝呈现出相同或相似的诱导活性。高伟等[35]和梁箫等[9]的研究中,Shewanella loihica对厚壳贻贝幼虫和稚贝均具有中等诱导活性;周轩等[28]和 Peng 等[12]的研究中,Pseudoalteromonas marina对厚壳贻贝幼虫和稚贝均具有中等诱导活性。在本研究中同样发现Paracoccussp.2和Pseudoalteromonassp.30对幼虫和稚贝均具有中等诱导活性;同时也发现了比较有趣的现象,Phaeobactersp.1和Bacillussp.4的诱导活性结果呈现出截然相反的结果,Bacillussp.4对幼虫具有高诱导活性而对稚贝具有低诱导活性,而Phaeobactersp.1对幼虫具有低诱导活性,对稚贝具有高诱导活性,推测可能由于肠道细菌对厚壳贻贝幼虫和稚贝的诱导机制不同。以往研究中,当细菌对海洋无脊椎动物具有较高诱导活性时,其生物被膜分泌胞外产物的能力也相对较强[33-34]。然而Phaeobactersp.1的胞外产物显著低于Bacillussp.4,但对稚贝的诱导活性反而显著高于后者,推测可能是Phaeobactersp.1中具有特殊的成膜机制,使其对稚贝具有高诱导活性,这一推测有待后续进一步研究。
综上所述,本研究中的肠道细菌都能够诱导厚壳贻贝幼虫和稚贝的附着,但诱导能力根据菌种的不同有所差异。通过对Bacillussp.4和Phaeobactersp.1这2株肠道细菌的生物被膜生物量和胞外产物的分析发现,肠道细菌被膜的细胞密度、膜厚和胞外产物中的脂类对厚壳贻贝幼虫的附着变态无影响,而胞外蛋白和胞外多糖可以影响幼虫的附着变态;对于厚壳贻贝稚贝的附着,肠道细菌被膜的细胞密度、膜厚和胞外α-多糖均能影响其诱导活性,而胞外脂类和胞外蛋白无影响。本研究成果为今后深入探讨肠道细菌与厚壳贻贝之间的相互作用提供了理论基础,对肠道细菌在贝类人工育苗和海区生态健康养殖具有潜在应用价值。
