CDDO-Me对三阴性乳腺癌细胞泛素特异性蛋白酶2a活性及细胞增殖的抑制作用
2021-09-09季艳杰蔡海燕刘欣宇金诗佳粟深月徐含章吴英理
季艳杰,罗 浩,蔡海燕,刘欣宇,金诗佳,粟深月,徐含章,雷 虎,吴英理
1.上海交通大学医学院病理生理学教研室,细胞分化与凋亡教育部重点实验室,上海 200025;2.潍坊医学院基础医学院临床病理系,潍坊 261053
泛素特异性蛋白酶2a(ubiquitin-specific protease 2a,USP2a)属于去泛素蛋白酶家族。该家族约有100个成员,通过调节蛋白质的泛素化修饰,影响蛋白质的稳定性、细胞内定位和蛋白质-蛋白质相互作用,从而在细胞增殖、DNA损伤修复、细胞代谢、干细胞自我更新、免疫调节等多个方面发挥作用。在多种肿瘤中均发现USP2a及其底物的过表达,如侵袭性淋巴瘤、前列腺癌、卵巢癌、肺癌、结肠癌和预后不良的乳腺癌[1]。USP2a可以调节一些重要的肿瘤相关蛋白,如脂肪酸合成酶(fatty acid synthase,FASN)、β连环素(β-catenin)、鼠双微体蛋白2(murine double minute 2,MDM2)、细胞周期蛋白D1(cyclin D1)、肿瘤坏死因子受体相关因子6(tumor necrosisfactor receptor-associated factor 6,TRAF6)等[2-6]。因此,USP2a是良好的抗肿瘤靶点。但是,现有USP2抑制剂的效能相对较低,尚无可用于临床的特异性USP2抑制剂,USP2抑制剂的筛选和研究仍处于起步阶段。
天然药物用于疾病治疗历史悠久,是抗肿瘤药物的重要来源。齐墩果酸是从龙胆科植物獐牙菜属的青叶胆全草或女贞子的果实中分离提取而得到的一种五环三萜类化合物。甲基巴多索隆(bardoxolone methyl,CDDOMe)是以齐墩果酸为先导物和前体发展起来的,其通过与Kelch样ECH相关蛋白(Kelch-like ECH-associated protein 1,KEAP1)结合并激活核转录因子E2相关因子2(nuclear factor erythroid-2-related factor 2,NRF2),促进NRF2向细胞核转运,并与靶基因启动子中的抗氧化反应元件结合,进而诱导表达抗氧化相关蛋白及细胞保护酶。CDDO-Me也可以通过抑制核因子κB(nuclear factor-κB,NF-κB)炎症途径,减少促炎信号的产生。因此,CDDO-Me在抗氧化、抗炎和抗癌等方面展现出了巨大潜力[7]。过去的研究[8]表明,五环三萜类化合物可能具有泛素特异性蛋白酶(ubiquitin-specific protease,USP)的抑制活性。本研究通过筛选天然化合物发现CDDO-Me在体外能够抑制USP2a活性,并以三阴性乳腺癌(triple negative breast cancer,TNBC)细胞作为疾病细胞模型,探究CDDO-Me对TNBC细胞中USP2a蛋白的作用,以及对细胞增殖的影响。
1 材料与方法
1.1 细胞与质粒
人TNBC细胞株MDA-MB-231和MDA-MB-231-LN2由上海交通大学医学院赵倩课题组馈赠,人TNBC细胞株MDA-MB-468由上海交通大学医学院钟清课题组馈赠。
原核表达质粒pET28a-His-USP2a core和pGEX-6P-1-GST-UbA52,以及USP2a过表达质粒pLVX-USP2a由本实验室构建和保存。空载pLVX质粒购自美国Addgene公司。
1.2 主要试剂与仪器
CDDO-Me、安罗替尼(anlotinib)(Sigma,美国),科罗索酸(corosolic acid)、齐墩果酸(oleanolic acid)、熊果酸(ursolic acid)、地肤子皂苷(momordin lc)、补骨脂酚(bakuchiol)、丹酚酸a(salvianolic acid A)(普利斯,中国),Japonicone A(由上海交通大学药学院金惠子课题组馈赠),抗USP2多克隆抗体(Abcam,英国),抗β-catenin抗体、抗TRAF6抗体、抗胱天蛋白酶3(caspase3)抗体、抗cleaved-caspase3抗体(CST,美国),抗聚腺苷二磷酸核糖聚合酶1[poly(ADPribose)polymerase1,PARP1]抗体(Abclonal,中国),抗β肌动蛋白(β-actin)抗体、抗黏着斑蛋白(vinculin)抗体(Abways,中国),辣根过氧化物酶(HRP)标记的鼠源或兔源二抗(雅酶,中国),快速考马斯亮蓝染色液(中晖赫彩,中国),胎牛血清(fetal bovine serum,FBS)、高糖DMEM培养基(Gibco,美国),聚乙烯亚胺(polyethylenimine,PEI)、Opti-MEM培养基(ThermoFisher,美国),细胞活性检测试剂盒8(cell counting kit-8,CCK8)(诺唯赞,中国),碘化丙啶(propidium iodide,PI)(BD,美国)。
细胞计数仪(Beckman,美国),Western blotting设备(Bio-Rad,美国),多功能酶标仪(BioTek,美国),流式细胞仪(BD,美国)。
1.3 实验方法
1.3.1 泛素特异性蛋白酶抑制剂筛选 筛选系统的原理是去泛素化蛋白酶能够使底物去泛素化。在体外测试体系中,去泛素化蛋白酶USP2a可以使GST-UbA52(UbA52是常用的去泛素化蛋白酶的底物,由Ub和A52两个结构域构成;GST为谷胱甘肽巯基转移酶,属标签蛋白)发生剪切。GST-UbA52(相对分子质量45 000)被剪切后,会产生2个片段,其中较大的片段为GST-Ub(相对分子质量36 000)。电泳后,用考马斯亮蓝染色法可以清楚地看到GST-UbA52被剪切的条带。当反应体系中的化合物具有抑制去泛素化蛋白酶活性的时候,剪切的产物减少。
USP2a和GST-UbA52蛋白纯化按照本实验室报道的方法[9]。USP2a抑制剂筛选系统缓冲液含1 mmol/L EDTA-Na2、0.5 mmol/L DTT、50 mmol/L Tris-HCl。设置空白组(缓冲液)、DMSO组(USP2a蛋白、DMSO、缓冲液)、药物组(USP2a蛋白、小分子药物、缓冲液)。各组加样后混匀离心,37℃孵育15 min,使小分子药物和USP2a蛋白结合。然后各组分别加入GST-UbA52蛋白(体系中USP2a蛋白浓度为125 nmol/L,GST-UbA52蛋白浓度为1μmol/L),混匀离心后37℃孵育25 min,使GST-UbA52被剪切。加入5×SDS裂解液,95℃加热5 min。最后取15μL进行蛋白电泳,考马斯亮蓝染色。利用ImageJ软件对各组的GST-UbA52条带进行灰度扫描,GraphPad Prism 8.0软件分析得到CDDO-Me抑制USP2a活性的50%抑制浓度(half maximal inhibitory concentration,IC50)。抑制率计算公式:抑制率=(药物组灰度值-DMSO组灰度值)/(空白组灰度值-DMSO组灰度值)×100%。
1.3.2 分子对接分析 使用软件AutoDock4.2进行分子对接分析[10]。从蛋白质数据库(http://www.rcsb.org/pdb)中检索了USP2催化域(PDB ID:2HD5)的X射线衍射晶体结构,用于分子对接计算[11]。为了准备蛋白质和小分子的结构,首先添加所有氢原子,计算Gasteiger电荷,并合并非极性氢。使用AutoGrid4准备格点文件,格点中心定义为USP2晶体结构中Tyr514残基的坐标中心,围绕中心定义一个70×70×70(格点数)的盒子,格点间距为0.375Å(1Å=0.1 nm)。在对接分析中,USP2蛋白质被认为是刚性的,对接参数的设置与之前的研究[12]相同;使用Lamarckian遗传算法解释蛋白质-蛋白质的相互作用;最后,根据预测的结合自由能选择构象。
1.3.3 细胞培养 细胞均使用高糖DMEM培养基在含有5%CO2的37℃细胞培养箱中培养。培养基中添加10%FBS以及100 U/mL青霉素和100μg/mL链霉素,根据细胞生长状态及时更换培养液,取对数生长期的细胞用于后续实验。
1.3.4 细胞热迁移实验 收取至少1×107个目的细胞进行细胞热迁移实验(cellular thermal shift assay,CETSA)。用PBS(按1∶100加入蛋白酶抑制剂Cocktail)重悬细胞。将细胞悬液放入液氮中2~3 min,然后室温融化,重复3次;4℃下,20 000×g离心20 min。取上清液,分成2份,分别加入50μmol/L CDDO-Me和等体积DMSO,充分混匀后在37℃孵育30 min。然后分到八连管中,在PCR仪上加热3 min(设置不同的温度梯度:52.0~64.1℃),室温冷却3 min。处理完成的样品于4℃20 000×g离心20 min,吸取上清液(尽量不吸到沉淀)至新的EP管中,加入等体积2×SDS裂解液,95℃加热5 min使蛋白变性,离心取上清液进行Western blotting检测。
1.3.5 Western blotting分析 细胞经PBS清洗后加入2×SDS裂解液;95℃加热5 min,置于冰上5 min,重复3次。蛋白样品经SDS-PAGE电泳后,转移至硝酸纤维素膜上。封闭1 h后加入一抗,4℃孵育过夜。次日用1×TBST缓冲液洗涤后加入HRP标记的二抗,室温孵育1 h,洗膜后进行化学发光显影。
1.3.6 质粒转染 采用瞬时转染的方法,分别将质粒pLVX(pLVX组)和pLVX-USP2a(pLVX-USP2a组)转染到MDA-MB-468细胞中。首先,将MDA-MB-468细胞接种在10 cm培养皿中,待细胞生长至密度达60%~70%时开始转染。将10μg质粒和25μg PEI分别加入500μL Opti-MEM中,混匀静置5 min;然后将质粒混合液加到PEI混合液中,混匀静置20 min后滴加到细胞中,4~6 h换液1次,持续48 h或72 h。
1.3.7 CCK8检测 将MDA-MB-231、MDA-MB-468、MDA-MB-231-LN2细胞接种于96孔板中,设置空白组、阴性组(加入DMSO)和CDDO-Me处理组(2.5、5、10μmol/L),并在加样孔周围的边孔中加入等体积的培养液。细胞处理后在培养箱中培养24 h,每个孔中滴加CCK8试剂,混匀后放置于细胞培养箱内孵育,每隔0.5 h用酶标仪检测一次吸光度值(D),检测波长为450 nm。控制阴性组的D(450 nm)值介于0.8~1.2,以1.0左右为最佳;根据检测结果,计算CDDO-Me对细胞的增殖抑制率:增 殖 抑 制 率=[(D阴性组-D空白组)-(D处理组-D空白组)]/(D阴性组-D空白组)×100%。
1.3.8 台盼蓝拒染法 将MDA-MB-468细胞以3×105个/mL的密度接种于6孔板中,每孔加2 mL细胞培养液培养,每个处理组设3个复孔。待细胞贴壁后,以不同浓度的CDDO-Me(0、0.5、1、2μmol/L)处理细胞24 h,取细胞悬液与台盼蓝溶液以1∶1的比例均匀混合,然后在细胞计数仪下计数蓝染(死亡)及不染色(存活)的细胞数。
1.3.9 细胞周期检测 收集至少1×106个MDA-MB-468细胞,预冷PBS洗3次,离心弃上清液,轻弹残留的PBS使细胞团块散开,滴加预冷的75%乙醇,-20℃固定过夜。离心收集细胞沉淀并用PBS重悬细胞,加入RNA酶,37℃孵育30 min。离心弃上清液,加入PI染液,室温避光孵育15 min。上机前用孔径300μm尼龙网膜过滤细胞,用流式细胞仪检测,结果数据用Flowjo10软件分析。
1.4 统计学分析
使用GraphPad Prism 8.0软件进行统计分析,定量资料用±s表示,2组间比较采用t检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 CDDO-Me在体外对USP2a活性的抑制作用
首先,利用USP抑制剂筛选系统对多种天然化合物进行筛选,发现CDDO-Me可以抑制USP2a对GSTUbA52的切割,由此推测CDDO-Me可能是USP2a的抑制剂(图1A)。然后我们对CDDO-Me进行倍比稀释,测试不同浓度CDDO-Me在体外对USP2a活性的抑制作用(图1B)。利用ImageJ软件对各组的GST-UbA52条带进行灰度扫描,GraphPad Prism 8.0软件分析得到CDDO-Me体外抑制USP2a活性的IC50是3.84μmol/L(图1C)。
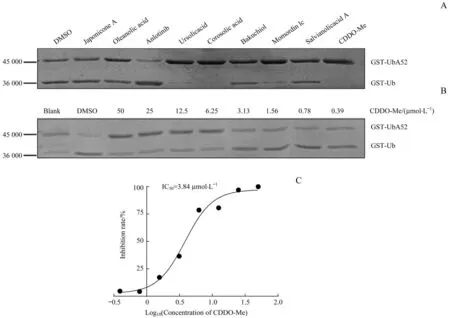
图1 CDDO-Me在体外对USP2a活性的抑制作用Fig 1 Inhibition of CDDO-Meon theactivity of USP2a in vitro
2.2 CDDO-Me与USP2分子对接分析结果
为了进一步明确CDDO-Me与USP2之间的作用关系,我们通过分子对接分析软件在蛋白质结构水平探索它们的结合方式。分析结果显示,CDDO-Me与USP2的H456残基之间形成氢键,与F409和Y514残基之间具有疏水相互作用。CDDO-Me分子键合到USP2催化裂隙附近的狭窄口袋中(图2)。
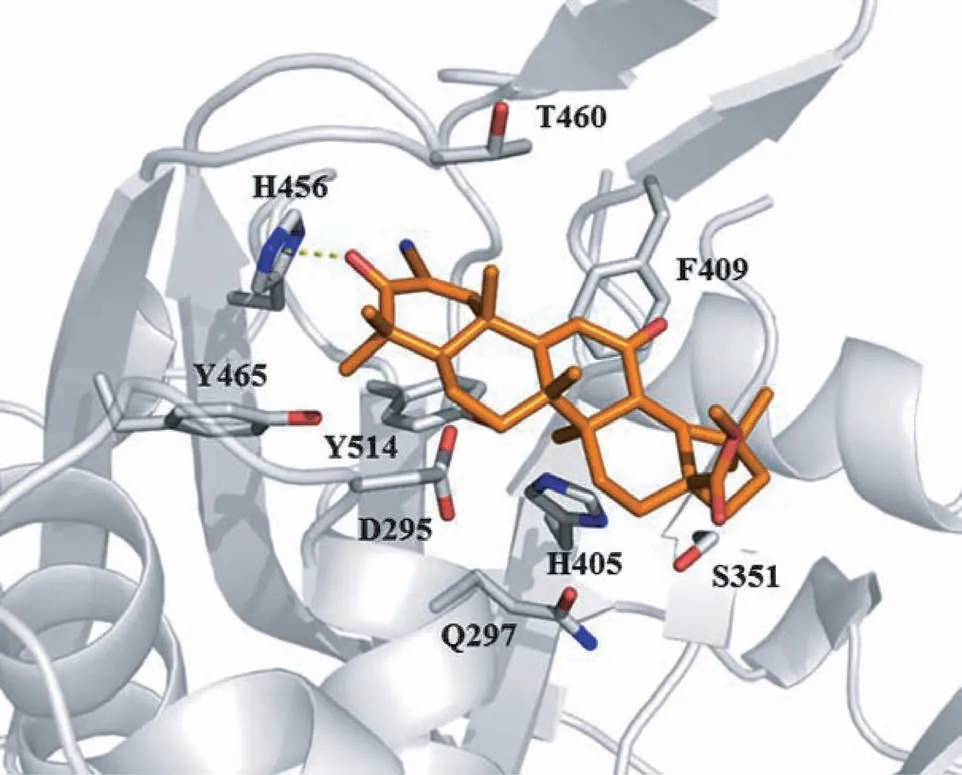
图2 USP2a与CDDO-Me结合的分子对接分析Fig 2 Predicted interaction between CDDO-Me and USP2aby molecular docking
2.3 CDDO-Me与TNBC细胞中USP2a的相互作用
为明确CDDO-Me是否能与TNBC细胞中的USP2结合,我们分别收取至少1×107个MDA-MB-231、MDAMB-468、MDA-MB-231-LN2细胞,液氮反复冻融获取细胞裂解液后,将CDDO-Me与细胞裂解液孵育后进行CETSA实验。Western blotting结果显示,与对照组(DMSO)相比,在不同的温度(60℃以下)环境下检测到CDDO-Me处理组的USP2a蛋白水平更高;提示CDDO-Me能靶向结合TNBC细胞中的USP2a,从而使其更加稳定(图3)。

图3 CETSA实验检测CDDO-Me与USP2a在TNBC细胞内的结合情况Fig 3 Interaction between CDDO-Me and USP2ain the TNBCcellsdetected by CETSAassay
2.4 CDDO-Me对USP2a底物水平的影响
鉴于CDDO-Me在体外对USP2a具有抑制作用,本研究在细胞水平进一步检测USP2a底物蛋白水平是否受CDDO-Me的影响。取MDA-MB-468细胞以3×105个/mL的密度接种在6孔板中,细胞贴壁后用2μmol/L CDDOMe处理不同时间(0、6、12、24 h)。Western blotting实验发现,处理12 h后USP2a底物β-catenin和TRAF6蛋白水平即明显降低(图4A)。把质粒pLVX和pLVX-USP2a瞬时转染到MDA-MB-468细胞中,48 h后用2μmol/L CDDO-Me分别处理pLVX组和pLVX-USP2a组细胞,12 h后进行Western blotting实验。结果显示,与pLVX组相比,pLVX-USP2a组细胞中β-catenin和TRAF6的蛋白水平未出现明显减少(图4B)。
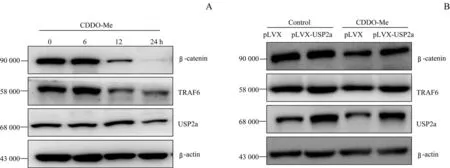
图4 CDDO-Me对MDA-MB-468细胞中USP2a底物蛋白水平的影响Fig 4 Effectsof CDDO-Me on thelevelsof USP2asubstrateproteinsin the MDA-MB-468 cells
2.5 CDDO-Me对TNBC细胞增殖以及凋亡的影响
利用CCK8试剂盒检测不同浓度(2.5、5、10μmol/L)CDDO-Me对MDA-MB-231、MDA-MB-468和MDA-MB-231-LN2细胞增殖的影响;结果显示,随着CDDO-Me浓度的升高,其对3种TNBC细胞的抑制率均逐渐升高(图5A)。
为了检测CDDO-Me对TNBC细胞凋亡的影响,取经不同浓度CDDO-Me处理的MDA-MB-231、MDA-MB-468和MDA-MB-231-LN2细胞,Western blotting检测后发现,2μmol/L CDDO-Me处理24 h可导致3种TNBC细胞发生caspase3蛋白活化以及PARP1蛋白的剪切(图5B~D)。
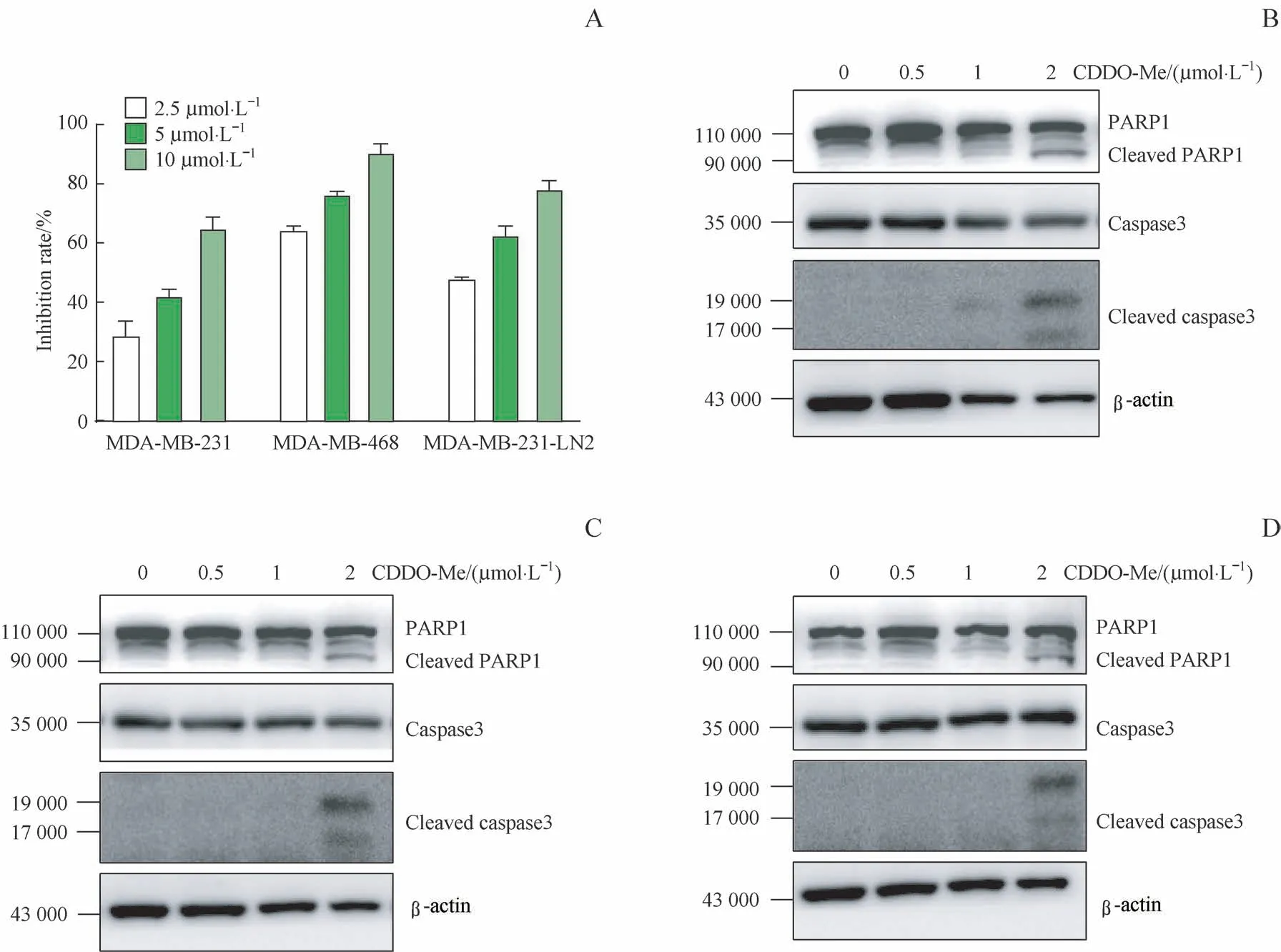
图5 CDDO-Me对TNBC细胞增殖和凋亡的影响Fig 5 Effectsof CDDO-Me on theproliferation and apoptosis of TNBCcells
2.6 MDA-MB-468细胞中过表达USP2a对CDDO-Me增殖抑制作用的影响
为探讨USP2a在CDDO-Me生物学效应中的重要性,在MDA-MB-468细胞中瞬时转染了pLVX或pLVX-USP2a质粒,转染后48 h和72 h pLVX-USP2a组较pLVX组USP2a蛋白水平显著升高(图6A)。台盼蓝拒染法结果显示,MDA-MB-468细胞转染质粒后48 h再以不同浓度CDDO-Me处理24 h,PLVX-USP2a组的活细胞数目显著多于pLVX组(图6B)。流式细胞术检测细胞周期结果显示,经1μmol/L CDDO-Me处理24 h后,pLVX组细胞出现明显的S期和G2/M期阻滞(图6C),而PLVX-USP2a组细胞则没有明显的细胞周期阻滞(图6D)。
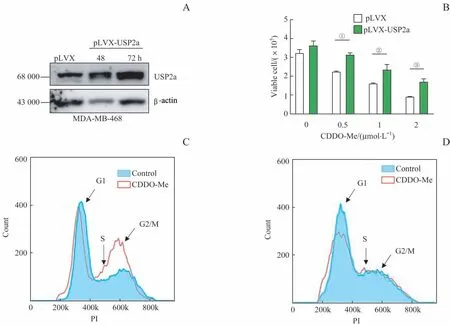
图6 MDA-MB-468细胞中过表达USP2a对CDDO-Me增殖抑制作用的影响Fig 6 Effects of overexpression of USP2a in the MDA-MB-468 cells on CDDO-Me proliferation inhibition
3 讨论
USP2a在TNBC干细胞群中表达上调,抑制USP2a可显著抑制干细胞群的自我更新、增殖和耐药性,因此USP2a被认为是一个新的TNBC治疗靶标[13]。本研究证实,CDDO-Me可通过直接抑制USP2a的活性抑制TNBC细胞的增殖和存活。
本研究发现CDDO-Me是USP2a的抑制剂,证据如下:①利用USP抑制剂筛选系统进行体外筛选,发现CDDO-Me能够在体外抑制USP2a活性。②CDDO-Me与USP2a的分子对接结果显示,CDDO-Me可键合到USP2催化裂隙附近的狭窄口袋中,并与His456残基之间形成氢键,与Phe409和Tyr514残基之间具有疏水相互作用。③CETSA实验证明CDDO-Me可以与TNBC细胞内的USP2a相互结合,增加其蛋白稳定性。④Western blotting和CCK8实验结果表明在MDA-MB-468细胞内过表达USP2a可以减弱CDDO-Me导致的USP2a底物水平下调、细胞周期阻滞和增殖抑制效应。
CDDO-Me是一个多靶标分子,能够影响肿瘤细胞分化、增殖、凋亡和自噬相关的诸多信号通路[14]。CDDO-Me在乳腺癌中的作用也有报道。Wnt/β-catenin过表达是导致转录因子激活的最常见途径,其负责刺激干细胞中的上皮细胞向间充质细胞转变。此外,β-catenin蛋白的过度表达和累积会刺激细胞迁移,从而导致肿瘤转移[15]。有报道[16]称,CDDO-Me可以抑制乳腺癌细胞的细胞活力、增殖、集落形成、干性和鼠乳腺肿瘤病毒(mouse mammary tumor virus,MMVT)-Wnt1转基因小鼠的肿瘤生长,这些抑制作用是通过抑制Wnt/β-catenin信号通路来实现的。也有研究[17]发现,CDDO-Me可以作为免疫调节剂,减轻乳腺肿瘤微环境的免疫抑制作用,增强CD8+T细胞肿瘤浸润,可作为乳腺癌、黑色素瘤和其他癌症潜在的免疫疗法。另外,用CDDOMe处理乳腺癌易感基因1(breastcancer susceptibility gene1,Brca1)缺陷的小鼠的乳腺,可以抑制小鼠肿瘤组织中受体酪氨酸激酶ErbB2(属表皮生长因子受体家族)的组成型磷酸化;在BRCA1缺陷细胞系中发现,CDDO-Me直接与ErbB2相互作用,降低ErbB2的组成型磷酸化,抑制增殖,并诱导G0/G1期阻滞[18]。目前,有关CDDO-Me在TNBC中直接靶标的报道比较少见。本研究表明,USP2a是CDDO-Me的直接作用靶标。在MDA-MB-468细胞中,CDDO-Me能够通过抑制USP2a的活性下调β-catenin和TRAF6的蛋白水平;这在一定程度上解释了此前报道的CDDO-Me对Wnt/β-catenin信号通路的抑制作用。此外,有报道[19-20]称TRAF6在乳腺癌中高表达,促进乳腺癌的增殖与转移;CDDO-Me可能通过促进TRAF6降解而抑制乳腺癌的增殖与转移。本课题组曾报道过CDDO-Me可以抑制泛素特异性蛋白酶7(ubiquitinspecific protease7,USP7)的活性[12]。USP7在乳腺癌中被认为是一个癌基因,通过介导组蛋白甲基化酶锌指蛋白8(plant homeodomain finger protein 8,PHF8)的稳定性促进乳腺癌的发生[21]。因此,尚不能排除有USP7参与了CDDO-Me在TNBC细胞中发挥的效应。在TNBC细胞中,CDDO-Me可能同时抑制了USP2a和USP7的活性,进而抑制细胞增殖和存活。
体外实验显示,CDDO-Me对正常细胞的毒性不大,包括人成纤维细胞[22]、外周血单核细胞[23]和乳腺正常上皮细胞[24],因此其作用具有一定的特异性。CDDOMe目前已被美国食品药品监督管理局批准用于奥尔波特综合征和肺动脉高压治疗的Ⅱ期临床试验。然而,CDDO-Me在治疗Ⅱ型糖尿病慢性肾病的Ⅲ期临床试验中的结果显示,给药组心血管事件发生率更高。因此,CDDO-Me还有待进一步完善。就USP2a抑制剂而言,CDDO-Me与现有USP2a抑制剂的结构不同,可为发展USP2a抑制剂提供新的骨架。
综上所述,本研究发现CDDO-Me可抑制USP2a活性,进而抑制TNBC细胞增殖以及诱导细胞凋亡;本研究也为开发新的USP2a抑制剂提供了先导化合物。
参·考·文·献
[1] Priolo C,Tang D,Brahamandan M,et al.The isopeptidase USP2a protects human prostate cancer from apoptosis[J].Cancer Res,2006,66(17):8625-8632.
[2] Tao BB,He H,Shi XH,et al.Up-regulation of USP2a and FASN in gliomas correlates strongly with glioma grade[J].J Clin Neurosci,2013,20(5):717-720.
[3] Kim J,Alavi Naini F,Sun Y,et al.Ubiquitin-specific peptidase 2a(USP2a)deubiquitinates and stabilizesβ-catenin[J].Am J Cancer Res,2018,8(9):1823-1836.
[4] Shi Y,Solomon LR,Pereda-Lopez A,et al.Ubiquitin-specific cysteine protease 2a(USP2a)regulates the stability of aurora-A[J].J Biol Chem,2011,286(45):38960-38968.
[5] Wei T,Biskup E,Gjerdrum LM,et al.Ubiquitin-specific protease 2 decreases p53-dependent apoptosis in cutaneous T-cell lymphoma[J].Oncotarget,2016,7(30):48391-48400.
[6] He X,Li Y,Li C,et al.USP2a negatively regulates IL-1β-and virusinduced NF-κB activation by deubiquitinating TRAF6[J].J Mol Cell Biol,2013,5(1):39-47.
[7]Wang YY,Yang YX,Zhe H,et al.Bardoxolone methyl(CDDO-Me)as a therapeutic agent:an update on its pharmacokinetic and pharmacodynamic properties[J].Drug Des Devel Ther,2014,8:2075-2088.
[8] Jing B,Liu M,Yang L,et al.Characterization of naturally occurring pentacyclic triterpenes as novel inhibitors of deubiquitinating protease USP7 with anticancer activityin vitro[J].Acta Pharmacol Sin,2018,39(3):492-498.
[9] Wang Z,Xie W,Zhu M,et al.Development of a highly reliable assay for ubiquitin-specific protease 2 inhibitors[J].Bioorg Med Chem Lett,2017,27(17):4015-4018.
[10] Morris GM,Goodsell DS,Halliday RS,et al.Automated docking using a Lamarckian genetic algorithm and an empirical binding free energy function[J].JComput Chem,1998,19(14):1639-1662.
[11] Renatus M,Parrado SG,D'Arcy A,et al.Structural basis of ubiquitin recognition by thedeubiquitinating protease USP2[J].Structure,2006,14(8):1293-1302.
[12] Qin D,Wang W,Lei H,et al.CDDO-Me reveals USP7 as a novel target in ovarian cancer cells[J].Oncotarget,2016,7(47):77096-77109.
[13] He J,Lee HJ,Saha S,et al.Inhibition of USP2 eliminates cancer stem cells and enhances TNBC responsiveness to chemotherapy[J].Cell Death Dis,2019,10(4):285.
[14] Borella R,Forti L,Gibellini L,et al.Synthesis and anticancer activity of CDDO and CDDO-Me,two derivatives of natural triterpenoids[J].Molecules,2019,24(22):4097.
[15] Medina MA,Oza G,Sharma A,et al.Triple-negative breast cancer:a review of conventional and advanced therapeutic strategies[J].Int JEnviron Res Public Health,2020,17(6):2078.
[16] Zhou L,Wang ZY,Yu SB,et al.CDDO-Me elicits anti-breast cancer activity by targeting LRP6 and FZD7 receptor complex[J].JPharmacol Exp Ther,2020,373(1):149-159.
[17] Shen H,Li L,Yang S,et al.Regulatory role of tumor necrosis factor receptor-associated factor 6 in breast cancer by activating the protein kinase B/glycogen synthase kinase 3βsignaling pathway[J].Mol Med Rep,2017,16(2):2269-2273.
[18] Kim EH,Deng C,Sporn MB,et al.CDDO-methyl ester delays breast cancer development in BRCA1-mutated mice[J].Cancer Prev Res(Phila),2012,5(1):89-97.
[19] Yu J,Qin B,Moyer AM,et al.DNA methyltransferase expression in triplenegative breast cancer predicts sensitivity to decitabine[J].J Clin Invest,2018,128(6):2376-2388.
[20] Bishop RT,Marino S,Carrasco G,et al.Combined administration of a small-molecule inhibitor of TRAF6 and docetaxel reduces breast cancer skeletal metastasisand osteolysis[J].Cancer Lett,2020,488:27-39.
[21] Wang Q,Ma S,Song N,et al.Stabilization of histone demethylase PHF8 by USP7 promotes breast carcinogenesis[J].JClin Invest,2016,126(6):2205-2220.
[22] Gibellini L,Pinti M,Bartolomeo R,et al.Inhibition of Lon protease by triterpenoids alters mitochondria and is associated to cell death in human cancer cells[J].Oncotarget,2015,6(28):25466-25483.
[23] Beinke C,Scherthan H,Port M,et al.Triterpenoid CDDO-Me induces ROS generation and up-regulates cellular levels of antioxidative enzymes without induction of DSBs in human peripheral blood mononuclear cells[J].Radiat Environ Biophys,2020,59(3):461-472.
[24] El-Ashmawy M,Delgado O,Cardentey A,et al.CDDO-Me protects normal lung and breast epithelial cells but not cancer cells from radiation[J].PLoS One,2014,9(12):e115600.
