蛋白精氨酸甲基转移酶5在肺癌中的表达及其促进肺癌的作用机制
2021-09-09周冰倩陈哲逸陈诗宇郑英霞
周冰倩,韩 丽,陈哲逸,陈诗宇,郑英霞
上海交通大学医学院附属新华医院检验科,上海 200082
肺癌是全球发病率和死亡率最高的恶性肿瘤[1]。在我国,肺癌的发病率和死亡率均位居各类癌症之首,且呈逐年上升趋势[2]。近年来,随着手术治疗、化学治疗、靶向和个体化治疗的全面开展,肺癌患者短期生存率有了明显改善,但其5年生存率仍不容乐观,即从早期的73%降至晚期的13%[3];且相关研究[4]显示,局部侵袭和远处转移仍然是晚期肺癌患者最主要的致死原因。因此,深入探究参与肺癌细胞生长、转移的相关分子及其信号转导通路已成为了当前的研究热点。
蛋白精氨酸甲基转移酶5(protein arginine methyltransferase 5,PRMT5)是一种Ⅱ型甲基化转移酶,能够催化组蛋白3和组蛋白4的不同精氨酸发生对称性二甲基化修饰,如组蛋白4精氨酸3的对称性二甲基化(symmetric di-methylation of histone4 arginine3,H4R3me2s)、组蛋白3精氨酸8的对称性二甲基化(symmetric di-methylation of histone3 arginine8,H3R8me2s),以调控基因的转录激活/抑制[5-7]。已有研究表明PRMT5在肺癌[8-9]、肝癌[10]、乳腺癌[11]、黑色素瘤[12]等多种癌症中有较高的表达,提示PRMT5可能在肿瘤的发生、发展中发挥关键作用。动物肺癌转移模型的相关研究[8]显示,PRMT5表达增加时肿瘤细胞生长速度较快。上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)在肿瘤生长、侵袭和转移等过程中发挥着重要作用[13]。有研究[14]发现PRMT5是肿瘤EMT过程中的重要调控因子,如其可诱导胰腺癌细胞发生EMT进而增强细胞的迁移和侵袭能力。基于此,本研究结合生物信息学分析,检测PRMT5在肺癌组织中的表达,并通过体外功能实验验证PRMT5对肺癌细胞增殖、迁移、侵袭能力的影响,分析其与患者生存预后的关联,为PRMT5作为肺癌的治疗靶标提供理论依据。
1 资料与方法
1.1 组织芯片获取及患者信息
73对经石蜡包埋的肺癌及癌旁组织制成的芯片购于上海芯超生物科技有限公司。在上述患者中,男性39例、女性34例,年龄为20~84岁。
1.2 数据收集和分析
从基因表达综合(Gene Expression Omnibus,GEO)数据库(https://www.ncbi.nlm.nih.gov/gds/)中下载癌细胞系百科全书(Cancer Cell Line Encyclopedia,CCLE)数据集GSE36139。该数据集包含917种癌细胞系的DNA突变、基因表达和染色体拷贝数等遗传信息。从UCSC Xena数据平台(https://xenabrowser.net/datapages/)下载肺腺癌(lung adenocarcinoma,LUAD)和肺鳞癌(lung squamous cell carcinoma,LUSC)的癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库,并获得RNA测序(RNA-seq)数据;其中,LUAD数据中包含了517例LUAD组织和59例正常组织的测序数据,LUSC数据中包含了502例LUSC组织和51例正常组织的测序数据。采用R4.0.3分析PRMT5mRNA在上述2种肺癌及正常肺组织中的表达。同时,获取Kaplan-Meier plotter数据库(http://kmplot.com/)中的肺癌数据,对PRMT5的表达与患者预后进行相关性分析。
1.3 细胞和主要试剂
肺癌细胞NCI-H1299、NCI-H460、HCC827、PC-9和人胚肺成纤维细胞MRC-5均购于中国科学院典型培养物保藏委员会细胞库。293T细胞为本实验室保存。
柠檬酸(pH6.0)抗原修复液、牛血清白蛋白(bovine serum albumin,BSA)、苏木精染液、苏木精返蓝液、中性树胶、免疫组织化学试剂盒及DAB显色剂均购于武汉赛维尔生物科技有限公司,RPMI-1640培养基、DMEM培养基、胎牛血清(fetal bovine serum,FBS)均购于美国Gibco公司,限制性内切酶EcoRⅠ和BamHⅠ、RNA反转录试剂盒购于日本Takara公司,实时荧光定量PCR试剂盒购于上海翊圣生物科技有限公司,PCR引物由生工生物工程(上海)股份有限公司合成,PRMT5单克隆抗体、EMT抗体盒购于美国CST公司,肌动蛋白(β-actin)购于武汉爱博泰克生物科技有限公司,CCK8试剂盒购于日本同仁化学研究所,Transwell和Invasion小室购于美国Corning公司。PBST缓冲液[磷酸盐缓冲液(phosphate buffer saline,PBS)∶Tween-20=1 000∶1]为实验室自行配制。
1.4 方法
1.4.1 石蜡包埋组织芯片中PRMT5表达量检测 采用免疫组织化学法检测73对石蜡包埋组织芯片中PRMT5的表达,经脱水、封片后置于光学显微镜下观察,胞浆或胞核出现棕黄颗粒则视为PRMT5阳性细胞。PRMT5表达评分标准见表1,最终评分=强弱评分×比例评分。后续,将根据其获得的最终评分与患者的临床特征行相关性分析。
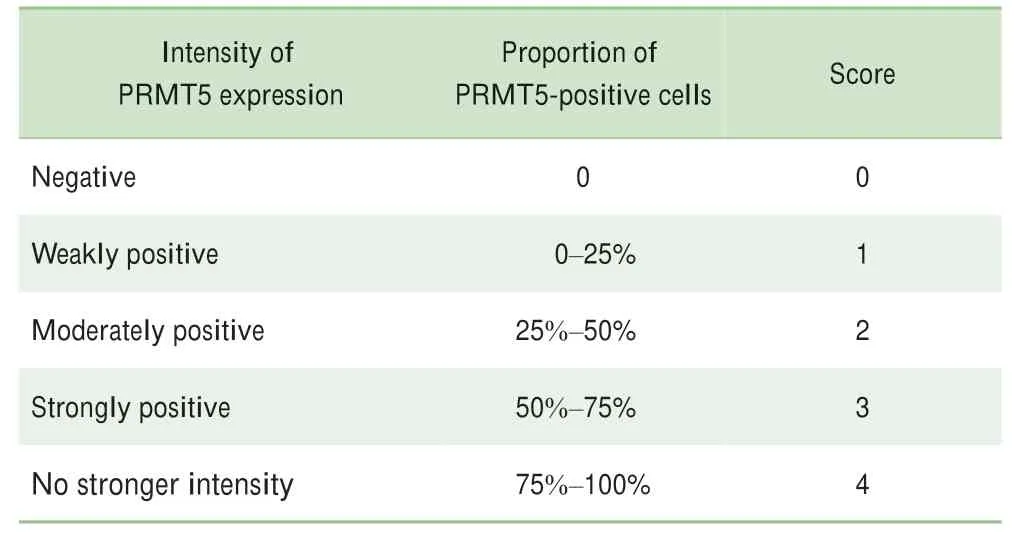
表1 PRMT5表达评分标准Tab 1 PRMT5 expression scoring criteria
1.4.2 细胞培养 MRC-5、PC-9、293T细胞均采用含10%FBS、100 U/mL青霉素和100μg/mL链霉素的DMEM培养基进行培养,NCI-H1299、NCI-H460、HCC827细胞均采用含10%FBS、100 U/mL青霉素和100μg/mL链霉素的RPMI-1640培养基进行培养。所有细胞的培养条件均为37℃、5%CO2。
1.4.3 细胞中PRMT5表达量检测 采用蛋白质印迹法(Western blotting)检测MRC-5、NCI-H1299、NCI-H460、HCC827、PC-9细胞中PRMT5的表达。制备上述5种细胞的蛋白,按照说明书进行电泳、转膜、封闭、一抗和二抗孵育,最后用Odyssey红外成像系统进行检测。使用的一抗为β-actin、PRMT5抗体(稀释比例均为1∶1 000),荧光二抗稀释比例为1∶5 000。
1.4.4PRMT5-shRNA寡核苷酸合成 目的基因为PRMT5,物种来源为人。靶向PRMT5的短发夹RNA(short hairpin RNA,shRNA)寡核苷酸序列见表2。

表2 sh RNA寡核苷酸序列Tab 2 Oligonucleotide sequence of shRNA
1.4.5PRMT5-shRNA慢病毒重组质粒构建 选用PLenR-GPH载体[吉满生物科技(上海)有限公司]作为慢病毒载体,其自带绿色荧光蛋白(green fluorescent protein,GFP)标记,便于后续观察转染效率。利用EcoRⅠ和BamHⅠ限制性内切酶使载体线性化,而后分别将表2中的寡聚核苷酸序列插入PLenR-GPH载体的EcoRⅠ和BamHⅠ位点之间,构建PRMT5-shRNA慢病毒重组质粒。
1.4.6 慢病毒包装 使用促转染试剂将构建好的重组质粒及辅助包装质粒[吉满生物科技(上海)有限公司]与293T细胞共转染10~12 h,而后加入转染增强试剂促进转染8 h,更换新鲜培养基继续培养48 h,收集富含慢病毒颗粒的细胞上清液并进行浓缩,获得慢病毒原液。
1.4.7 慢病毒感染、稳定敲除PRMT5细胞株建立及其敲除效果分析 将处于对数生长期的H1299细胞以105个/mL接种于6孔板,按照慢病毒感染复数(multiplicity of infection,MOI)=20加入病毒并添加2.5μg/mL聚凝胺进行感染,以获取稳定敲除PRMT5的H1299细胞株。培养48 h后,于荧光显微镜下观察慢病毒感染效率。更换培养液继续培养24 h后,提取细胞总RNA并制备细胞裂解蛋白,采用反转录及实时荧光定量PCR(quantitative real-time PCR,qPCR)、Western blotting检测PRMT5的敲除效果,具体步骤参照说明书进行。引物序列见表3。

表3 q PCR引物序列Tab 3 Primer sequences for qPCR
1.4.8 细胞增殖能力检测 将分别转染PRMT5-shRNA和NC-shRNA的H1299细胞以5×104个/mL接种至96孔板中,37℃、5%CO2条件下分别培养12、24、48、72 h,而后向每孔加入10μL CCK8试剂,继续培养2 h后用酶标仪测定细胞在450 nm处的吸光度。
1.4.9 细胞迁移和侵袭能力检测 将分别转染PRMT5-shRNA和NC-shRNA的H1299细胞按5×104个/孔分别加入Transwell和Invasion小室中,各设置3个复孔。将小室放入下层添加了700μL含10%FBS的RPMI-1640的24孔板中培养48 h,而后经4%多聚甲醛固定10 min,PBS洗涤3次,采用结晶紫染料染色30 min,再用PBS洗涤3次,最终用平底的湿棉签轻轻擦去小室内部未迁移至下层的细胞,于显微镜下拍照并统计穿过Transwell和Invasion小室的细胞总数,取3个复孔的平均值分别代表细胞的迁移、侵袭能力。
1.4.10 EMT相关蛋白及其基因检测 选取生长状态良好的已分别转染PRMT5-shRNA和NC-shRNA的NCIH1299细胞,抽提总RNA并制备细胞裂解蛋白,采用Western blotting、qPCR检测敲除PRMT5后的EMT相关蛋白[E钙黏蛋白(E-cadherin)、波形蛋白(vimentin)和转录因子SNAI1]及其基因的表达。qPCR引物序列见表3,其中VIM和SNAI1是转移激活基因,CDH1是转移抑制基因。使用的抗体包括β-actin、PRMT5、E-cadherin、vimentin和SNAI1抗体(稀释比例均为1∶1 000)。
1.5 统计学分析
应用GraphPad Prism 8.0软件对研究数据进行统计分析。定量资料以±s表示,采用Student′st检验进行分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 PRMT5在肺癌及癌旁组织中的表达
对73例患者的肺癌及癌旁组织芯片进行免疫组织化学分析,结果(图1)显示PRMT5在肺癌组织中的表达显著高于癌旁组织(P=0.000);随后,对PRMT5表达与患者的不同临床特征间的相关性进行分析,结果(表4)显示PRMT5在肿瘤Ⅲ~Ⅳ期的表达高于Ⅰ~Ⅱ期(P=0.033)。
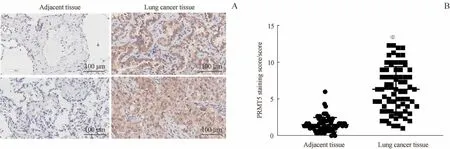
图1 免疫组织化学检测PRMT5在肺癌及癌旁组织中的表达Fig 1 Expression of PRMT5 in lung cancer tissuesand adjacent tissuesby immunohistochemistry
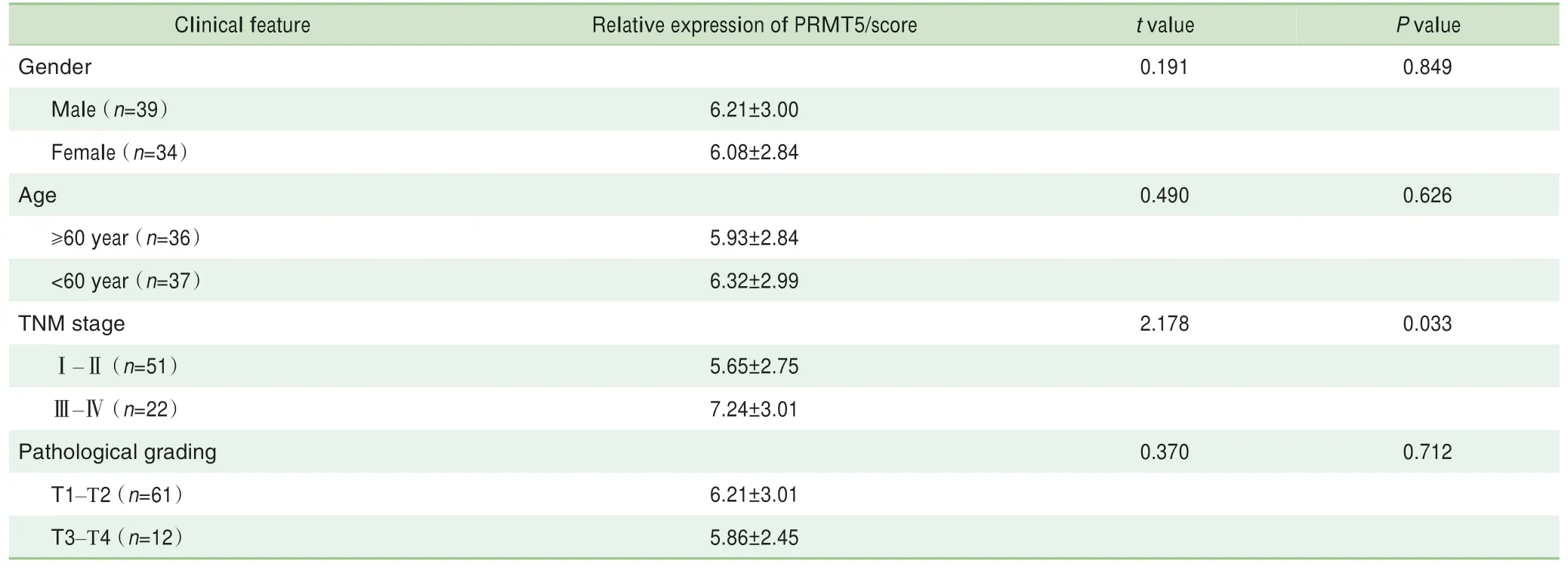
表4 PRMT5的表达水平与肺癌患者临床特征间的关系Tab 4 Relationship between the expression of PRMT5 and the clinical features of lung cancer patients
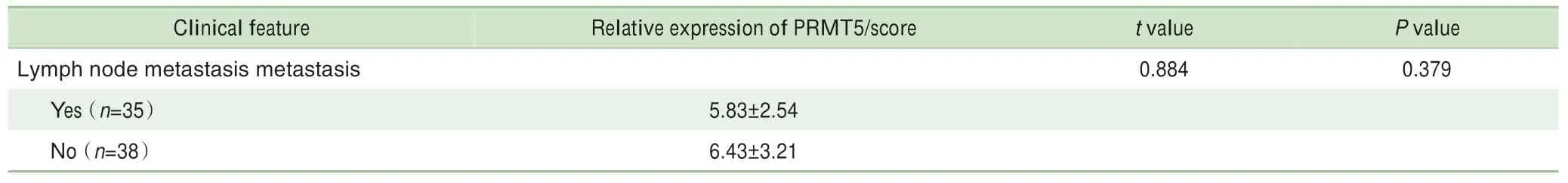
Continued Tab
2.2 PRMT5在肺癌细胞系中的表达
CCLE数据集GSE36139中共有来自24个原发部位的肿瘤,共917株不同的癌细胞系。对这917种癌细胞系进行分析,结果(图2A、B)显示PRMT5mRNA在肺癌等多个原发部位肿瘤中表达,且在LUAD和大细胞肺癌中的表达水平均高于LUSC(P=0.034,P=0.028)。随后,采用Western blotting检 测MRC-5、NCI-H1299、NCI-H460、HCC827、PC-9细胞中PRMT5的表达,结果(图2C)显示与MRC-5细胞相比,PRMT5在肺癌细胞系中高表达。

图2 PRMT5在多种癌细胞中的表达Fig 2 Expression of PRMT5 in various cancer cells
2.3 稳定敲除PRMT5细胞株的构建及PRMT5对细胞增殖、迁移和侵袭能力的影响
本研究通过转染PRMT5-shRNA1、PRMT5-shRNA2、PRMT5-shRNA3筛选稳定敲除PRMT5的细胞株,于荧光显微镜下观察转染效率,并采用反转录及qPCR、Western blotting检测PRMT5的mRNA和蛋白表达,结果(3A、B)显示,与转染NC-shRNA相比,转染PRMT5-shRNA3后的NCIH1299细胞中PRMT5表达明显降低,因此该细胞株即为稳定敲除PRMT5的NCI-H1299细胞株(在后续实验中,提及PRMT5-shRNA即为PRMT5-shRNA3)。
采用CCK8法检测转染PRMT5-shRNA细胞和转染NC-shRNA细胞的增殖能力,结果(图3C)显示,在培养48、72 h后,PRMT5-shRNA组细胞的增殖能力显著低于NC-shRNA组(均P=0.000)。采用Transwell小室和Invasion小室检测转染PRMT5-shRNA组和NC-shRNA组细胞的迁移和侵袭能力,结果(图3D、E)显示,PRMT5-shRNA组细胞的迁移、侵袭能力均低于NCshRNA组(均P=0.000)。
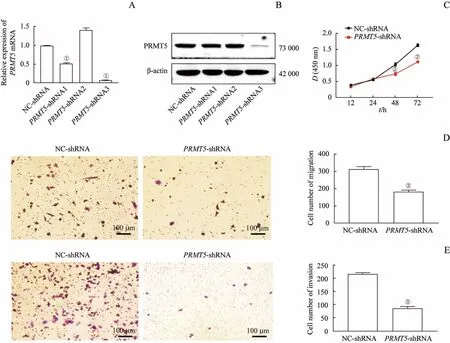
图3 沉默PRMT5对肺癌细胞NCI-H1299的增殖、迁移和侵袭能力的影响Fig 3 Effectsof silencing PRMT5 on proliferation,migration and invasion abilities of lung cancer cell NCI-H1299
2.4 干扰肺癌细胞系PRMT5对EMT相关蛋白及其基因的影响
采用Western blotting检测稳定敲除PRMT5的细胞NCI-H1299中EMT相关蛋白的表达,结果(图4A)显示敲除PRMT5后E-cadherin的表达水平增加、vimentin和SNAI1的表达水平下降;同时,采用反转录及qPCR检测上述蛋白的基因(CDH1、SNAI1、VIM)表达情况,结果(图4B)显示转移激活基因VIM和SNAI1的表达水平下降,转移抑制基因CDH1的表达水平增加。
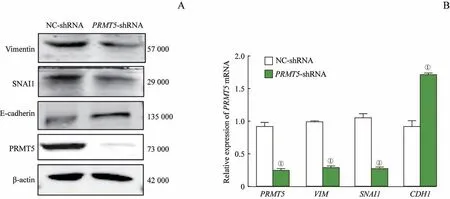
图4 敲除PRMT5后EMT相关蛋白及其基因的表达Fig 4 Expression of EMT-associated proteinsand the genesafter PRMT5 knockout
2.5 PRMT5 mRNA在肺癌及正常肺组织中的表达及其表达与患者预后的相关性
从UCSC Xena数据平台下载TCGA数据库,获得LUAD和LUSC的RNA-seq数据,并通过R语言分析PRMT5mRNA在该2种肺癌及正常肺组织中的表达。结果(图5A、B)显示,PRMT5mRNA在肺癌组织中的表达显著高于正常肺组织(均P=0.000)。随后,通过Kaplan-Meier plotter数据库对肺癌组织中PRMT5mRNA的表达与肺癌患者总生存(overall survival,OS)率、无复发生存(relapse-free survival,RFS)率的相关性进行分析,结果(图5C、D)显示PRMT5mRNA高表达的LUAD患者的OS率低于PRMT5mRNA低表达患者(P=0.005),而PRMT5mRNA的表达水平与LUSC患者的OS率无相关性;同时,与PRMT5mRNA低表达的LUSC患者相比,PRMT5mRNA高表达患者的RFS率较低(P=0.028)。继而提示,PRMT5表达的增加与肺癌的不良预后有关。
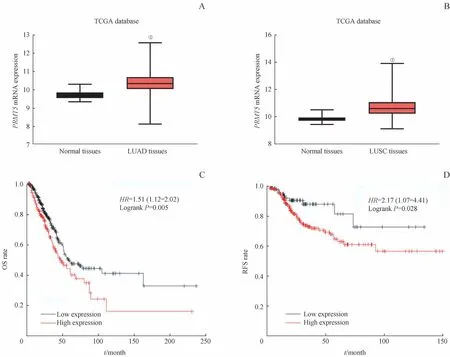
图5 TCGA数据库中PRMT5 mRNA在肺癌及正常肺组织中的表达及其表达与患者预后的关系Fig 5 Expression of PRMT5 mRNAin lung cancer tissues and normal lung tissuesfrom TCGA database and thecorrelation with prognosis
3 讨论
在全球范围内,肺癌已成为癌症致死的首要原因,平均每年致死人数高达170多万[15]。多项研究[9,11,16]表明,PRMT5在肿瘤的发生与发展中发挥着重要作用,即其可通过对H4R3me2s、H3R8me2s行甲基化修饰来调控肿瘤相关基因的转录抑制或激活,进而调控肿瘤的发生、发展。
本研究通过免疫组织化学染色发现PRMT5在肺癌组织中高表达,其表达水平与临床病理分级相关。随后,我们通过慢病毒干扰体外实验发现PRMT5能促进肺癌细胞的增殖、迁移和侵袭,且EMT相关上皮标记蛋白E-cadherin表达增加、间质性标记蛋白vimentin和SNAI1表达减少;继而提示,PRMT5可能通过调控EMT相关蛋白的表达来促进肺癌细胞的迁移和侵袭。但PRMT5究竟是对EMT相关蛋白直接作用,还是通过组蛋白甲基化来影响该蛋白的表达,尚需进一步探讨。本研究进一步结合大数据对PRMT5mRNA在LUAD和LUSC中的表达进行分析,结果显示其在2种肺癌组织中均表达增加,且随着PRMT5mRNA表达的增加,LUAD患者OS、LUSC患者RFS缩短,表明PRMT5发挥着促进肺癌发展的作用。
相关文献[9]报道,高浓度的特异性PRMT5抑制剂GSK591可阻断细胞中PRMT5的活性,对人胚肺成纤维细胞IMR-90和肺癌细胞A549有选择性杀伤活性。目前,已有多项针对PRMT5的临床试验处于安全性和有效性的测试阶段[17]。综上所述,PRMT5在肺癌中高表达,可发挥促肿瘤的作用,并且其可能通过参与调节肺癌EMT信号通路促进肺癌细胞的侵袭转移。PRMT5表达与肺癌的不良预后有关,该结果或将为筛选肺癌的潜在治疗靶标提供参考。
参·考·文·献
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2020[J].CA Cancer JClin,2020,70(1):7-30.
[2] Feng RM,Zong YN,Cao SM,et al.Current cancer situation in China:good or bad news from the 2018 Global Cancer Statistics?[J].Cancer Commun,2019,39(1):22.
[3] Woodard GA,Jones KD,Jablons DM.Lung cancer staging and prognosis[J].Cancer Treat Res,2016,170:47-75.
[4] Mehlen P,Puisieux A.Metastasis:a question of life or death[J].Nat Rev Cancer,2006,6(6):449-458.
[5] Stopa N,Krebs JE,Shechter D.The PRMT5 arginine methyltransferase:many roles in development,cancer and beyond[J].Cell Mol Life Sci,2015,72(11):2041-2059.
[6] Pal S,Baiocchi RA,Byrd JC,et al.Low levels of miR-92b/96 induce PRMT5 translation and H3R8/H4R3 methylation in mantle cell lymphoma[J].EMBO J,2007,26(15):3558-3569.
[7] Migliori V,Müller J,Phalke S,et al.Symmetric dimethylation of H3R2 is a newly identified histone mark that supports euchromatin maintenance[J].Nat Struct Mol Biol,2012,19(2):136-144.
[8] Jing PY,Zhao N,Ye MX,et al.Protein arginine methyltransferase 5 promotes lung cancer metastasisviathe epigenetic regulation of miR-99 family/FGFR3 signaling[J].Cancer Lett,2018,427:38-48.
[9]Chen H,Lorton B,Gupta V,et al.ATGFβ-PRMT5-MEP50 axisregulatescancer cell invasion through histone H3 and H4 arginine methylation coupled transcriptional activation and repression[J].Oncogene,2017,36(3):373-386.
[10] Jiang H,Zhu Y,Zhou ZY,et al.PRMT5 promotes cell proliferation by inhibiting BTG2 expressionviathe ERK signaling pathway in hepatocellular carcinoma[J].Cancer Med,2018,7(3):869-882.
[11] Chiang K,Zielinska AE,Shaaban AM,et al.PRMT5 is a critical regulator of breast cancer stem cell functionviahistone methylation and FOXP1 expression[J].Cell Rep,2017,21(12):3498-3513.
[12] Nicholas C,Yang J,Peters SB,et al.PRMT5 is upregulated in malignant and metastatic melanoma and regulates expression of MITF and p27(Kip1.)[J].PLoSOne,2013,8(9):e74710.
[13] Brabletz T,Kalluri R,Nieto MA,et al.EMT in cancer[J].Nat Rev Cancer,2018,18(2):128-134.
[14] Ge L,Wang H,Xu X,et al.PRMT5 promotes epithelial-mesenchymal transitionviaEGFR-β-catenin axis in pancreatic cancer cells[J].JCell Mol Med,2020,24(2):1969-1979.
[15] Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer JClin,2018,68(6):394-424.
[16] Shailesh H, Zakaria ZZ, Baiocchi R, et al. Protein arginine methyltransferase 5(PRMT5)dysregulation in cancer[J].Oncotarget,2018,9(94):36705-36718.
[17] Yuan YY,Nie H.Protein arginine methyltransferase 5:a potential cancer therapeutic target[J].Cell Oncol(Dordr),2021,44(1):33-44.
