一株中华鳖源嗜水气单胞菌的分离鉴定及毒力基因分析
2021-09-08薛明洋梁宏伟范玉顶曾令兵曲春娟
薛明洋,周 勇,梁宏伟,李 翔,范玉顶,曾令兵,曲春娟,孟 彦
(1中国水产科学研究院长江水产研究所,武汉 430223;2安徽省喜佳农业技术有限公司,安徽蚌埠 233000;3安徽省蚌埠市水产技术推广中心,安徽蚌埠 233000)
0 引言
中华鳖(Pelodiscus Sinensis),俗称甲鱼,团鱼等,隶属于爬行纲(Reptilia)、龟鳖目(Testudinata)、鳖科(Tironychidae)、鳖属(Pelodiscus),是中国重要的水产经济养殖品种,具有重要的营养、药用和观赏价值[1]。近年来,国内鳖养殖产量稳步增长,养殖区域主要集中在浙江、安徽、广东、湖北、江苏、江西等地,养殖呈现出工厂化、规模化和集约化的发展趋势[2]。随着养殖规模和养殖密度不断提高,而且加之长期的人工控温养殖,致使中华鳖自身免疫力、抗病力都有所下降,因而养殖过程中发病频率和不同病原感染导致的疾病均有所增加,病害问题日益突出,因此应加强对中华鳖疾病的研究。
嗜水气单胞菌(Aeromonas hydrophila)于弧菌科、气单胞菌属,是一种广泛分布于自然界中的革兰氏阴性杆菌,通常被认为是条件致病菌,是多种水生动物的致病菌,为典型的“人-畜-鱼”共患病病原[3-4]。嗜水气单胞菌是中华鳖的主要致病菌,目前已从多种症状的病鳖中都分离出嗜水气单胞菌,如红脖子病、红底板病、白底板病、腐皮病、疥疮病、出血性肠炎等多种不同症状的疾病[5]。嗜水气单胞菌还能引发多种并发症,如“红脖子、红底板”并发症,“腐皮、疥疮”并发症等[6]。所以在中华鳖养殖过程中疾病诊断、病原的确定尤为重要。目前抗生素是防治鳖嗜水气单胞菌感染的主要药物。研究表明,不同区域和来源的嗜水气单胞菌对药物的敏感性不同[7]。林峰[8]从中华鳖中分离出1 株嗜水气单胞菌对庆大霉素、头孢他啶、头孢西丁、链霉素、呋喃妥因敏感。赵小平等[9]分离的嗜水气单胞菌对恩诺沙星、氧氟沙星、丁胺卡那霉素高度敏感。此外,研究发现嗜水气单胞菌的耐药性呈现上升趋势[10]。因此,要做好药敏检测,要有针对性用药。
嗜水气单胞菌的致病性与毒力因子密切相关,对于毒力因子的作用,一般认为都是多功能和多因子协同致病的结果[11]。嗜水气单胞菌所分泌的气溶素、溶血素、丝氨酸蛋白酶、弹性蛋白酶、金属蛋白酶及细胞毒性肠毒素等是重要的毒力因子,与嗜水气单胞菌有无毒力或者毒力强弱有很高的相关性[12]。
2019年,安徽某中华鳖养殖场中华鳖出现反应迟钝、脖颈红肿、伸缩困难、腹甲及四肢有红色出血斑点(块)为主要症状的传染性疾病,主要感染对象为1 龄以上温室养殖和室外池塘养殖的成鳖,发病周期持续2周,死亡率达30%,经济损失严重。为了探究此次导致安徽省中华鳖养殖场发病的致病原,本研究无菌条件下从患病中华鳖体内分离病原,通过形态学、生理生化特征和16S rDNA 序列分析对病原菌进行鉴定;利用回归感染试验对病原菌致病性进行确定,采用琼脂扩散法进行药敏试验;成功地分离并鉴定了一株高致病性的嗜水气单胞菌AM-1,并对其毒力基因进行检测,为此次中华鳖疾病的防治提供了重要的指导意义。
1 材料与方法
1.1 试验材料
2019年5月从安徽省某中华鳖养殖场采集患典型症状的濒死中华鳖(350 g±30 g),冷藏带回实验室进行病原分离和鉴定。健康1龄中华鳖(350 g±30 g)购自安徽蚌埠某中华鳖养殖场。试验在中国水产科学研究院长江水产研究所鱼类病害实验室,于2019 年5—10 月进行。
1.2 主要试剂和仪器
所需生化试剂和药品均购自国药集团;脑心浸液培养基(BHI)购于美国BD公司;LB培养基购自上海博微生物科技有限公司;酵母提取物、胰蛋白胨、DPBS缓冲液、琼脂糖等试剂购自Sigma公司;细菌总基因组提取试剂盒Bacterial DNA Kit 购自OMEGA 公司,病毒基因组DNA 提取Viral DNAkit 购自OMEGA 公司;PCR 扩增试剂盒2×Hieff™PCR Master Mix 购自上海翊圣生物科技有限公司,PCR 产物纯化试剂盒Gel Extraction Kit 购自OMEGA公司。药敏纸片购自杭州微生物试剂有限公司。全自动微生物鉴定系统来自于美国BIOLOG 公司的Biolog GEN Ⅲ。引物由武汉天一辉远生物技术有限公司合成。
1.3 中华鳖虹彩病毒检测
取濒死中华鳖的肝脏、脾脏和肾脏组织,加入含双抗的PBS,在混匀振荡器中充分研磨,反复冻融3 次后,4℃条件下3000 rpm离心30 min后取上清液,利用病毒DNA提取试剂盒,按试剂盒说明书进行病毒基因组DNA 提取。参考中华鳖虹彩病毒(STIV)引物[13]对提取的DNA 进行PCR 扩增,具体引物信息见表1。PCR 扩增反应体系25 μL,包括12.5 μL PCR Mix,10 μmol/L 上、下游引物各1 μL,1 μL 模板DNA 以及9.5 μL双蒸水。反应条件为:94℃预变性5 min,94℃变性30 s,57℃退火30 s,72℃复性30 s,72℃延伸10 min,共35 个循环。以中华鳖虹彩病毒DNA 为阳性对照,并设置阴性对照。扩增产物用1%琼脂糖凝胶电泳检测。
1.4 细菌病原的分离和纯化
用70%酒精对患病中华鳖的体表消毒后,置于生物安全柜中进行解剖,挑取部分肝脏,涂布于BHI琼脂平板上,于30℃恒温培养48 h。挑取平板中菌落,重新划线培养于BHI琼脂平板上,于相同的条件下培养,得到纯化的单菌落。挑取单菌落接种到5 mL BHI 液体培养基中,于30℃、200 rpm 条件下培养48 h。菌液加入甘油后分装到1.5 mL EP 管中,置于-80℃超低温冰箱保存备用。分离的菌株命名为AM-1。
1.5 病原的鉴定
1.5.1 细菌形态鉴定28℃条件下将分离的菌株在LB固体培养基纯培养18 h后观察菌落形态。用生理盐水制备菌悬液做革兰氏染色。
1.5.2 细菌生理生化鉴定 取经LB 固体培养基纯培养的菌株,单菌落划线接种于BUG(Biolog通用培养基)鉴定平板上,28℃培养16~24 h,待菌落大小适宜时取Biolog细菌鉴定试剂盒IF-A接种液,将管外壁擦拭干净,置入Biolog 浊度仪中调整其读数为100%T;用无菌棉签蘸取适量的单菌落至接种液中,使浊度仪读数在92%T~98%T之间,用移液器将混合液以每孔100 μL体积转移至GEN Ⅲ鉴定板中,然后将鉴定板装载于Biolog系统中培养,系统自动读数并输出鉴定结果。
1.5.3 分子生物学鉴定 将纯培养的菌悬液以10000 rpm离心2 min 后收集菌体,然后按照Bacterial DNA Kit(OMEGA)试剂盒说明书上的方法提取细菌基因组DNA。采用16S rDNA 基因通用引物[14](表1)对分离到的菌株16S rDNA进行PCR扩增。PCR反应体系为50 μL,包括25 μL PCR Mix,10 μmol/L上、下游引物各2 μL,2 μL 模板DNA 以及19 μL 双蒸水。反应条件为94℃预变性3 min,94℃变性30 s,55℃退火30 s,72℃复性45 s,35个循环,最后72℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测,回收后测序。将测序结果置于 NCBI(National Center for Biotechnology Information) 的Blast(Basic Local Alignment Search Tool)进行序列同源性比对,然后取不同来源的嗜水气单胞菌16S rDNA 基因序列用MEGA7.0(http://www.megasoftware.net/previousVersions.ph) 中的邻接法(Neighbor-Joining, NJ)构建系统发育树,以1000 次自举分析(Bootstrap)进行置信度检测。

表1 本实验中所用的引物序列
1.6 人工感染实验
分离菌株培养后通过平板计数法测定菌液浓度,并分别制备1×106、1×107、1×108、1×109CFU/mL 和1×1010CFU/mL 共5 个浓度梯度的菌悬液。将室内暂养1周的48只健康1龄中华鳖(体重350 g±30 g)以8只/组随机均分为6组。5个实验组分别从腹甲基部以腹腔感染1 mL/只剂量接种5种不同浓度的菌悬液,另外一组对照组注射同样体积的PBS。感染后在23℃±2℃的室内连续观察8 天,期间定期饲喂饵料,记录死亡数量及症状,并剖检以确定死亡的中华鳖体内能分离得到攻毒的菌株。
1.7 药物敏感性测定
培养试验菌株并用无菌PBS 调整菌液浓度为1× 108CFU/mL,吸取100 μL菌液涂布于MH(Mueller-Hinton)培养基表面,静置10 min待培养基表面的菌液被完全吸收,将抗生素药敏片分别贴在培养基表面,然后放入28℃恒温培养箱中倒置培养24 h。测量并记录抑菌圈大小(mm),按照药敏试剂盒使用说明判定敏感性。
1.8 毒力基因检测
参照Nawaz 等的方法,分别合成6 种毒力因子的特异性引物,气溶素(Aerolysin,aero)、热不稳定性肠毒素(Heat-labile enterotoxin,alt)、细胞毒性肠毒素基因(Cytotoxic enterotoxin,act)、热稳定性肠毒素(Heatstable enterotoxin,ast)、溶血素(Hemolysin A,hly)、弹性蛋白酶(Elastase,ahy),引物序列信息见表1。以分离菌株AM-1基因组DNA为模板进行PCR检测,PCR产物进行1.5%琼脂糖凝胶电泳并观察判定结果。
2 结果与分析
2.1 患病中华鳖症状
患病中华鳖最典型的症状为反应迟钝,颈部有出血点,肿大,伸缩困难,腹甲和四肢有红色出血点或斑块。剖检后发现腮腺部位粘膜出血,肝脏和脾脏肿大,部分个体肝脏有出血现象(见图1)。
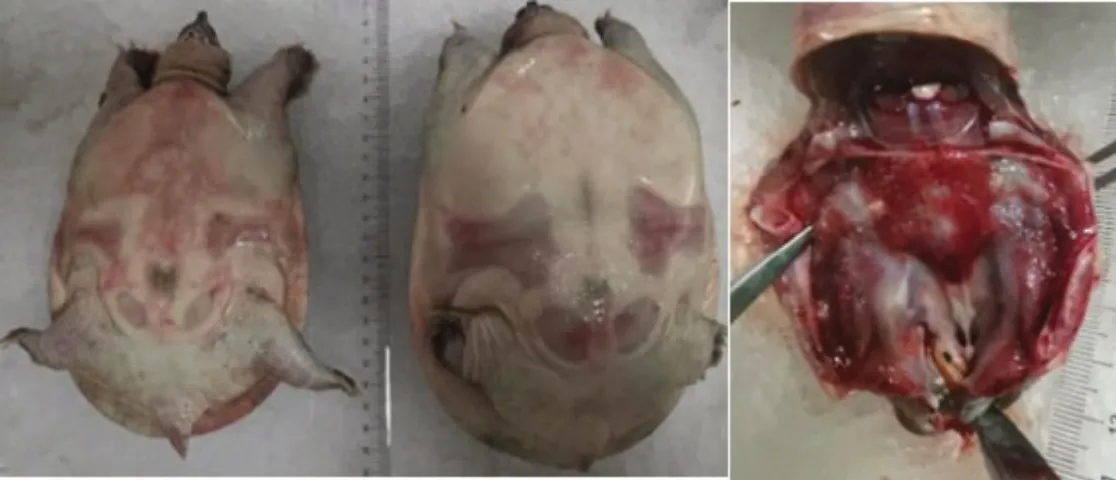
图1 患病中华鳖主要症状
2.2 病毒病原检测
对患病中华鳖组织提取物全基因组DNA 进行中华鳖虹彩病毒进行检测,结果显示,从上述组织液中未检出任何扩增条带。
2.3 分离细菌的菌落形态及菌体特征
从患病中华鳖肝脏中分离的菌株AM-1在普通琼脂营养平板上经28℃培养18~24 h 后,长出直径0.7~1.2 mm,圆形、中央隆起,湿润,半透明,露滴状,灰白色或灰黄色带有特殊气味的菌落,染色后显示为革兰氏阴性(图2A和2B)。
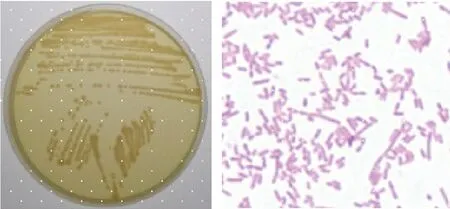
图2 菌株AM-1的形态特征。营养琼脂(A)和革兰氏染色(B)
利用BIOLOG 微生物自动鉴定系统对分离菌株AM-1 进行鉴定。结果表明AM-1 菌属于嗜水气单胞菌。鉴定的部分生理生化指标如表2所示。

表2 利用BIOLOG自动微生物分析系统对分离菌株AM-1的生化鉴定结果
2.4 分离菌株16S rDNA序列分析
通过PCR 扩增和序列测定获得分离菌株AM-1 16S rDNA基因1407 bp长度的序列片段,将其在NCBI数据库中进行BLAST比对,结果发现其与嗜水气单胞菌的标准菌株ATCC7966(CP000462)的相似度达98%,而且与菌株AM184306 等嗜水气单胞菌分离株的相似度也高达98%,确定该菌株为嗜水气单胞菌。基于16S rDNA基因序列,从NBCI数据库选择不同来源的嗜水气单胞菌14株,与中华鳖嗜水气单胞菌分离株AM-1 构建NJ 系统发育树(图3),结果表明:AM-1首先与来源于鲫鱼肾脏分离的嗜水气单胞菌(KC812106.1)和患“白底板”病的中华鳖体内分离的嗜水气单胞菌(GU563992.1)聚为在一起。

图3 构建不同来源嗜水气单胞菌16S rDNA序列NJ进化树;AM-1为本研究分离株
2.5 分离菌株的致病性
利用分离纯化的分离菌株AM-1制备5个浓度梯度1×106、1×107、1×108、1×109CFU/mL和1×1010CFU/mL的菌液,分别腹腔注射健康中华鳖,然后连续对其观察8天。结果发现,对比实验组而言,注射第2天,除了1×106CFU/mL浓度注射组未出现中华鳖死亡现象,其余4 个组中华鳖都有不同程度的死亡,其中以1×1010CFU/mL浓度组的死亡率最高。观察死亡中华鳖的症状主要表现为脖颈发红。在注射第4天,1×1010CFU/mL菌液浓度组中华鳖全部死亡,死亡率为100%,1×106CFU/mL 浓度组从注射第2 天后出现持续死亡,到实验结束时死亡率为75%,1×107CFU/mL 和1×108CFU/mL 浓度组的死亡率均为87.5%,1×109CFU/mL浓度组的死亡率为100%。在第4天和第5天感染后死亡的中华鳖个体中观察到有一定程度的脖颈红肿和腹甲出血现象,与自然发病类似。对照组在试验期间累积死亡中华鳖1 只,无任何脖颈红肿等症状。统计中华鳖攻毒后的死亡率和生存曲线如表3 和图4 所示。此外,对人工感染死亡的中华鳖进行细菌分离鉴定,结果与嗜水气单胞菌AM-1 一致。综合上述结果表明,嗜水气单胞菌AM-1是导致此次中华鳖脖颈红肿病的致病菌。

表3 分离菌株AM-1对中华鳖致病性的实验结果

图4 中华鳖攻毒后的生存曲线
2.6 药物敏感试验
分离菌株AM-1 常见的药物敏感性检验如表4 所示。按照药敏试剂盒使用说明判定,分离菌株嗜水气单胞菌AM-1 对恩诺沙星、氧氟沙星、左氟沙星、庆大霉素、头孢他啶和氨曲南敏感,对氟苯尼考和多粘菌素中度敏感,而对诺氟沙星、环丙沙星、氯霉素等药物具有耐药性。
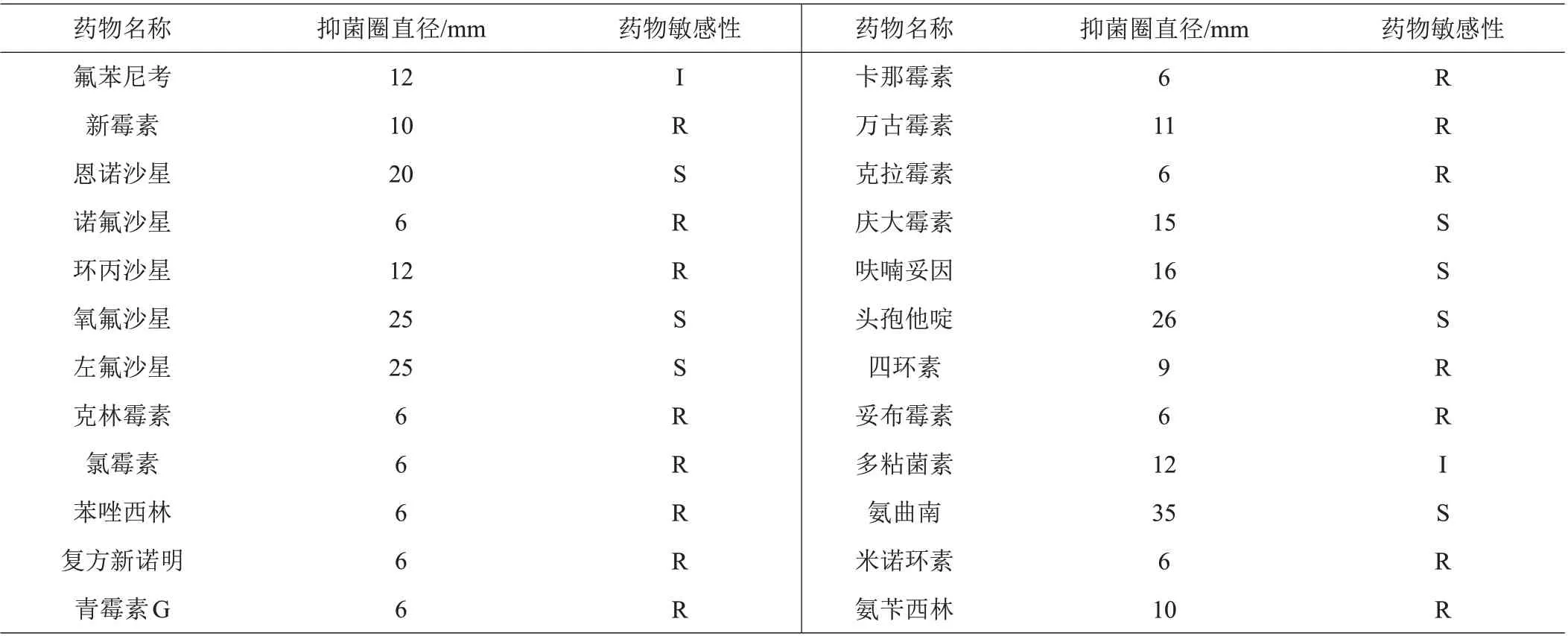
表4 分离菌株AM-1的药物敏感性
2.7 毒力基因检测
用嗜水气单胞菌6 种毒力基因特异性引物进行PCR扩增,经1.5%琼脂糖凝胶电泳显示,发现气溶素、热不稳定性肠毒素、热稳定性肠毒素、溶血素、弹性蛋白酶5种毒力基因都能扩增到单一且与预期片段相符合的条带(图5),而细胞毒性肠毒素基因未见扩增产物。

图5 分离菌株毒力基因扩增电泳图
3 讨论
3.1 病原的分离与鉴定
嗜水气单胞菌是一种条件致病菌,在自然界中广泛存在,一定条件下对水产动物、畜禽和人类均有致病性[15-17]。其可以引起草鱼、大菱鲆、罗非鱼、大鲵和中华绒螯蟹等多种水产养殖鱼类、甲壳类和两栖类动物患病[17-19]。嗜水气单胞菌可以引起中华鳖出血性肠道坏死症、红脖子病、红底板病、疖疮病、白斑病和腐皮病等病症[20]。“红脖子病”是中华鳖发现比较早的疾病,也是危害相对最严重的疾病之一。前期,不同学者对其病原的研究得到不同结论:其中包括虹彩病毒[21],嗜水气单胞菌[22],维氏气单胞菌[23],嗜水气单胞菌和蜡样芽胞杆菌混合感染等[24]等,但仅邱德全等[22]鉴定病原之后在中华鳌上开展了详细的回归感染实验。本研究中,我们对患病中华鳖分别开展了细菌和中华鳖虹彩病毒检测,其中通过分子生物学方法未检出有中华鳖虹彩病毒存在;另外,在细菌检测过程中,从患病中华鳖的肝脏组织中分离到单一的、数量众多的嗜水气单胞菌,回归感染实验复制出与自然发病类似的病症。确定引起中华鳖脖颈红肿、呼吸困难、腹甲出血点/斑的致病原为嗜水气单胞菌。
3.2 人工感染
本研究采用5个浓度的菌液对中华鳖进行腹腔注射感染以验证其致病性。结果发现高浓度菌液可以导致中华鳖出现急性死亡,例如在注射4 天内,1×1010CFU/mL 注射浓度组中华鳖全部死亡,死亡症状为脖颈发红。而低浓度注射组,从注射第2 天开始出现死亡,在第4天和第5天死亡的个体中观察到与自然发病有一定程度相似的脖颈红肿和腹甲出血现象。邱德全等[22]从患红脖子的中华鳖体内分离到一株嗜水气单胞菌,然后分别利用腹腔注射感染、灌胃感染、伤口感染和水体浸泡感染检测其致病性。结果发现腹腔注射会导致多数中华鳖急性死亡,灌胃和伤口感染不会产生颈部红肿的现象,而浸泡感染的个体会在感染20天左右出现脖子变粗,颈部充血,底板和四肢有出血点的症状。这与本研究嗜水气单胞菌导致中华鳖脖颈肿胀,底板和四肢有出血点/斑的结果相似,这充分证明嗜水气单胞菌是导致中华鳖脖颈红肿症状的致病菌,但是症状是否典型则与嗜水气单胞菌感染的方式和感染时间有关。
3.3 发病原因分析
本次发病中华鳖主要出现在温室养殖过程中,养殖水温普遍在30℃左右。目前中华鳖养殖多为工厂化集约养殖,养殖密度大。水体中常见的嗜水气单胞菌在高密度养殖和加温(28~30℃)饲养条件下,生长条件最佳,繁殖能力最快,致病性也会增强,是导致鳖病的主要致病菌[11]。在中华鳖温室养殖中,与嗜水气单胞菌病发生相关的主要环境因子有温度、溶解氧、pH、氨氮、生物因子和亚硝酸氮等[24],所以高密度养殖情况下,投饵饲喂导致水体中容易富集饵料残渣和粪便等物质,养殖水体循环缓慢会造成水体污染,而且高温还会使中华鳖自身的抵抗力下降[25],所以嗜水气单胞菌这一条件性致病菌就会“趁虚而入”导致机体感染。
3.4 嗜水气单胞菌药敏性质
药敏试验结果表明中华鳖脖颈红肿的病原菌嗜水气单胞菌AM-1 对菌对恩诺沙星、氧氟沙星、左氟沙星、头孢他啶和氨曲南敏感,对氟苯尼考和多粘菌素中度敏感,而对诺氟沙星、环丙沙星、氯霉素等药物具有耐药性,该药敏结果与康绍珠[26]和王帅兵等[27]报道有一定差异,这可能与用药习惯及菌株差异有关。目前越来越多的研究发现嗜水气单胞菌的耐药性呈上升趋势,甚至出现多重耐药性。因此,在养殖过程中,要做好药敏试验,有针对性用药,应做好用药记录,尽量使用窄谱抗生素,联合用药和轮换用药相结合。
3.5 嗜水气单胞菌毒力基因分析
细菌所携带毒力因子与其致病性紧密相关,气溶素、溶血素、丝氨酸蛋白酶、弹性蛋白酶、金属蛋白酶及细胞毒性肠毒素是嗜水气单胞菌重要的毒力因子[28],其中气溶素、溶血素和细胞毒性肠毒素基因是典型的3种外毒素[29],与动物出血病、败血症密切相关。经毒力基因检测,本次分离株AM-1携带气溶素、热不稳定性肠毒素、热稳定性肠毒素、溶血素、弹性蛋白酶5 种毒力基因,这可能与其具有较强致病性有关。
4 结论
本研究从患病中华鳖体内分离纯化得到一株细菌,通过形态学、生理生化特征和16SrDNA 序列分析鉴定分离菌株为嗜水气单胞菌(Aeromonas hydrophila)。人工感染试验显示该菌对中华鳖具有较强致病性,且发病症状与自然发病中华鳖症状一致,表明该菌是此次中华鳖疾病的病原菌。药敏试验显示该菌对恩诺沙星和左氧氟沙星等药物敏感,对复方新诺明、氨苄西林和四环素等不敏感。毒力基因检测显示,该嗜水气单胞菌分离株携带气溶素、热不稳定性肠毒素、热稳定性肠毒素、溶血素、弹性蛋白酶5 种毒力基因。
