CRISPR/Cas9系统及其在粮油作物遗传改良中的研究进展
2021-09-08高忠奎韩柱强黄志鹏熊发前唐秀梅吴海宁钟瑞春唐荣华贺梁琼
高忠奎,蒋 菁,韩柱强,黄志鹏,熊发前,唐秀梅,吴海宁,钟瑞春,刘 菁,唐荣华,贺梁琼
(1广西农业科学院科研基地管理处,南宁 530007;2广西农业科学院经济作物研究所,南宁 530007)
0 引言
随着测序技术迅猛发展,越来越多作物物种完成了基因组测序,单个基因功能研究以及多个基因协同调控作用研究成为新的研究热点,作物育种学已经进入基因组辅助育种阶段。基于CRISPR/Cas9系统的基因组编辑技术是近年分子生物学界的热点,利用此技术进行遗传改良是当前作物遗传育种研究的最前沿,了解相关研究动态和进展,对遗传育种工作者如何利用该技术进行精准遗传改良和品种选育具有重要意义。自1987 年石野良纯在大肠杆菌中发现“重复-居间序列(spacer)-重复”序列[1],到2007 年在实验上首次证实CRISPR-Cas是一种细菌获得性免疫系统[2],再到2012 年CRISPR/Cas9 基因编辑技术基本成型[3],短短几十年,这一领域的研究发展日新月异、不断取得新突破,使其以高效的敲除效率、简单的操作、位点选择的宽泛性、广泛的物种适应性及实验周期短等优势,成为目前基因组编辑领域最受欢迎的新方法[4],为作物真正实现基因组辅助育种提供了确实有效的手段。2020年,高彩霞研究团队用一种优化过的引导编辑系统(prime editing system,PPE),在原生质体中的9 个水稻位点和7个小麦位点上产生了所有12种类型的单碱基替换,以及多种点突变和小DNA 片段插入,编辑效率最高可达19.2%,成功获得了单碱基突变、多碱基突变及精准删除的水稻突变体植株,突变效率最高可达21.8%,这些突变均难以通过现有的基因编辑系统实现,这一新突破极大地扩展了植物基因组编辑范畴,为植物基因组功能解析及实现作物精准育种提供了重要技术支撑[5]。相比传统的转基因技术,基于CRISPR/Cas9系统的基因组编辑技术,其表达载体插入的位点与基因编辑的位点不同,外源插入质粒待基因编辑完成后,可在后代配子形成过程中染色体分离时被去除,不需要引入外源基因,无转基因争议,成为近年分子生物学界的热点研究领域[6],应用前景十分广阔。此外,利用CRISPR/Cas9技术已培育出具有优良性状的粮油作物新品系,这些性状包括产量(水稻千粒重、单粒重)、品质(水稻香型、糯性,大豆多根瘤)、抗病性(水稻稻瘟病、小麦白粉病)等重要性状[7-11]。因此,为了充分认识CRISPR/Cas9基因组编辑技术及其在粮油作物中的研究进展,本文对CRISPR/Cas 系统的基本原理、作用机制以及在粮油作物遗传改良研究中取得的成绩进行了梳理,助力CRISPR/Cas9 基因组编辑技术在粮油作物遗传改良和品种优化升级中得到更好、更快的应用。
1 CRISPR/Cas系统发展历程及分类
1987年,日本科学家石野良纯在对大肠杆菌的碱性磷酸酶同工酶(alkaline phosphatase isozyme, iap)进行测序时,意外发现终止密码子后的非编码区存在一些异常重复序列,这些序列在原核生物如细菌的DNA利用率较高,且具有“重复-居间序列(spacer)-重复”这一排列特征[1]。同时期西班牙莫伊察在一种嗜盐古菌(Haloferax mediterranei)中也发现了具有“重复-居间序列-重复”特征的序列,莫伊察在后续研究中发现这种序列在微生物中非常普遍,将其命名为短规律间隔重复(short regularly spaced repeat, SRSR)[12-13]。2002 年,荷兰科学家詹森进一步发现这种短规律间隔重复特殊结构存在于多个微生物(原核生物)中,不同物种的重复序列碱基数存在差异,并将这种结构重新定义为成簇规律性间隔短回文重复(clustered regularly interspaced short palindromicrepeat, CRISPR),他还发现CRISPR 序列附近还存在多个编码序列,将其定名为CRISPR 相关基因(CRISPR- associated gene,Cas)[14]。法国微生物学家巴兰古、霍瓦特利用P1、P2 2株噬菌体侵染链球菌(细菌),在实验上首次证实CRISPR-Cas 是一种细菌获得性免疫系统[2]。2012 年Jinek 等研究发现,CRISPR-CasⅡ系统中的Cas9 是个核酸酶,这个核酸酶结合2 个RNA(crRNA,tracrRNA)便能切割双链DNA[15],并进一步弄清了RNA 和靶DNA 配对的原则,阐明了CRISPR-CasⅡ系统的作用机制,至此,CRISPR/Cas9这个新型基因组定向编辑系统基本成型[3](见图1)。

图1 CRISPR/Cas9系统发展时间线
根据CRISPR-Cas 系统的结构和分子机制将该系统分为3 类,即Ⅰ系统、Ⅱ系统和Ⅲ系统,其中Ⅰ系统和Ⅲ系统具有一定的共性:都是pre-crRNA 被特定的Cas 核酸内切酶加工成为成熟的crRNA,crRNA 与多个Cas蛋白构成复合体后,再对靶基因进行剪切,实现基因组的定点编辑;在基因编辑过程中,由于需要多个Cas 蛋白参与,使得CRISPR-CasⅠ系统和Ⅲ系统极难被 应 用。CRISPR-Cas Ⅱ系 统 中,pre-crRNA 在tracrRNA(trans-activating crRNA,反式激活crRNA)、Cas9 蛋白和RNA 酶III 共同参与下产生成熟的crRNA,tracrRNA 与crRNA 形成特殊二级结构并与1个Cas蛋白构成复合体后,对靶基因实施剪切;相对于Ⅰ系统和Ⅲ系统,Ⅱ系统在基因编辑过程中,只需要2种RNA(crRNA和tracrRNA)和1个Cas蛋白参与,系统更为简单好利用[16]。
2 CRISPR/Cas9 系统的作用机制及优化
CRISPR/Cas9 系统基于Ⅱ系统,是目前用于基因组定向编辑的最主要类型。经典的CRISPR/Cas9系统由tracrRNA、crRNA、Cas9蛋白和RNA酶III构成的复合体以及相应的靶基因组成,靶基因中包含1 个由几个碱基构成的前间区序列邻近基序(protospacer adjacent motif, PAM),用于标记外源基因并指示系统的剪切位点。CRISPR/Cas9系统的作用机制是crRNA通过碱基配对与tracrRNA 结合形成特殊的tracrRNA/crRNA 发卡结构即单一向导RNA(small guide RNA),sgRNA 引导内切酶Cas9 蛋白形成sgRNA-Cas9 复合体,识别靶基因的PAM 序列后完成与靶基因结合,并对靶位点DNA实施剪切、产生DNA双链断裂[17-18]。在修复过程中,利用细胞的非同源性末端连接(Nonhomologous end joining, NHEJ) 或 同 源 重 组(Homologous recombination, HR)修复机制对断裂的DNA 进行插入缺失(Indel)、修复(Repair)或替换(Replacement),从而实现对动、植物基因组中的靶位点进行定点敲除、插入、替换、点突变等操作[19-20]。
但由于CRISPR/Cas9系统依赖间隔区序列与目标基因序列的碱基互补配对识别外源入侵DNA,对目标DNA的匹配程度具有一定的容忍度,允许个别碱基错配。在基因编辑过程中,CRISPR/Cas9 系统的这一特点,导致基因组中与目标DNA只有较少碱基差别的其他DNA 也可能会被切割,称为脱靶现象,脱靶现象的存在很大程度上阻碍了该技术在生产实践中的应用。为了降低编辑过程中的脱靶效应,更好的实现基因组编辑,科学家们对CRISPR/Cas9 系统进行了优化和改进:(1)将sgRNA 和Cas9 蛋白构建到同一个表达载体上,简化并提高系统的转化效率[17-18]。(2)开发使用脱靶效应评估方法和更优的sgRNA设计软件,使用精确匹配度高的sgRNA(20 个核苷酸长度)和PAM 序列,降低脱靶率[21-23]。(3)通过筛选和改造Cas9 蛋白,比如对Cas9 蛋白的HNH 和RuvC 2 个切割元件进行优化、使用增强型化脓链球菌Cas9蛋白突变体(eSpCas9)等,以减弱脱靶效应、提高CRISPR/Cas9 系统剪切效率和精准性[24-26];比如金黄色葡萄球菌(Staphylococcus aureus)的Cas9 核酸酶(SaCas9)基因改造后获得的新变体SaCas9-HF,与野生型Cas9 相比,SaCas9-HF 平均在靶编辑效率为80%,对于通常具有较少编辑失误的基因序列,SaCas9-HF具有几乎无法检测到的脱靶活性[27];Benjamin P.Kleinstiver研究团队对SpCas9蛋白进行改造升级获得的新突变体SpRY,识别的PAM 序列涵盖NRN和NYN(Y为C/T)(NRN>NYN),几乎完全放松了Cas9 对识别PAM 的要求,从而实现不需要特定PAM 就可结合和切割DNA 的目标,解决了CRISPR/Cas9 系统不能靶向不位于PAM 附近的基因位点这一困扰[28]。
3 CRISPR/Cas9 基因编辑技术在粮油作物遗传改良中的研究进展
作物品种改良的关键是对农艺性状进行改良以达到高产、高品质、抗逆等育种目标,通过传统育种途径改良作物品种,存在遗传背景复杂、不良性状连锁、性状稳定速度缓慢、费时耗力等劣势,育种效率低;分子标记能够对许多控制重要农艺性状的基因进行定位,相对快速的实现作物品种改良,但很难实现对目标性状进行定向改造,CRISPR/Cas9 系统却能解决这一技术难题。随着生物信息分析平台和相应数据库的广泛建立,CRISPR/Cas9基因编辑技术利用反向遗传学、配合高通量测序,能有目的地选择一些有价值的等位基因进行高效定点编辑。自2013 年CRISPR/Cas9 技术被用于进行植物基因组定点编辑研究以来,该技术已在水稻、小麦、大麦、玉米、大豆、油菜、花生等粮油作物突变体创制、性状改良等方面得到广泛应用。
3.1 CRISPR/Cas9基因编辑技术在粮食作物遗传改良中的研究进展
3.1.1 在水稻遗传改良中的研究进展 水稻是重要的粮食作物,也是重要的单子叶模式植物,CRISPR/Cas9系统在水稻基因编辑改良中操作相对容易,并在水稻基因功能研究、突变体创制、品种遗传改良方面表现出巨大的潜力。2013 年Feng 等[29]利用CRISPR/Cas9 技术对 拟 南 芥BRI1、JAZ1、GAI和 水 稻 的ROC5(Rice Outermost Cell- specific gene5)、SPP(Stromal Processing Peptidase)、YSA(Youg Seedling Albino) 3 个基因为靶位点进行编辑,均获得了纯合或双等位基因突变体,且这些突变体之间差异显著,这是世界上首次关于成功利用CRISPR/Cas9技术对水稻进行基因编辑的报道,证实该技术不仅能对模式植物拟南芥、还能对其他作物如水稻的基因位点进行定点编辑。同年,Shan 等[30]利用CRISPR/Cas9 技术,也成功对水稻控制籽粒形状和分蘖的TaGASR7、TaDEP1基因进行了定点编辑,并获得纯合敲除突变体,与野生型表型相比,突变体株高降低、千粒重和分蘖数明显增加,进一步证实该技术在水稻基因定点编辑方面的可行性。从此,在水稻中掀起了利用CRISPR/Cas9系统进行基因编辑的研究热潮,并不断获得创新,使水稻成为农作物中利用该技术的模式植物,并且,中国在这一方面已经走在了世界前沿。
沈兰等[7]以控制粒型基因GS3和控制每穗粒数基因Gn1a为靶基因,利用CRISPR/Cas9 技术,通过农杆菌介导法对4 个优质水稻品种的靶基因进行编辑,在T0代获得gs3和gs3gn1a突变体,突变体粒长变长、千粒质量增加,T1代突变体株系除了目标性状得到改良外,其他性状未受到明显影响;同年,又对水稻品种‘日本晴’8个农艺性状基因的位点敲除成功,获得了具有多基因突变组合的突变体[31]。周文甲等[32]以水稻抽穗期基因Hd2、Hd4和Hd5及香味基因Bath2为靶基因,进行定点编辑,在T0代便获得编辑成功的突变植株、T1代分离出无转基因成分且编辑成功的株系,经田间抽穗调查和香味物质测定,突变株系早熟且带有香味;邵高能等[8]也对香味基因Badh2进行编辑,在T1代获得香味物质显著增加的突变体单株,在T2代便获得了分蘖数和结实率显著差异、其他性状没发生显著改变的香型株系。吴明基等[33]通过CRISPR/Cas9 系统,对可育水稻品种中间材料GH89的TMS5基因(tms5为温敏不育基因)进行编辑,获得纯合突变株和双等位突变株,快速成功创制了水稻温敏核不育系。冯璇等[34]以水稻优良保持系209B为材料,对水稻直链淀粉合成主效基因Wx位点进行定点编辑,T0代Wx位点纯合缺失突变率达26.9%,T1代纯合突变体直链淀粉含量显著降低、糯性品质优良、其他性状没发生显著改变,成功将高产的非糯性品系Wx209B 转为糯性品系WX209B,并转育糯稻不育系WX209A。王子璇等[35]对水稻成花素家族成员OsDTH11基因进行敲除,成功获得了该基因62 bp缺失、31 bp缺失的2种类型且能稳定遗传的纯合突变体材料。范美英等[36]利用CRISPR/Cas9 技术以Wx为靶基因,遗传改良优质粳稻‘秀水134’,发现45个转基因株系中有41个株系发生靶定位置碱基修改,突变率达到91.1%,并获得了糯稻新材料。徐鹏等[10]利用该技术对水稻稻瘟病相关基因Pita、Pi21和ERF922进行定点编辑,获得Pi21单突变纯合株系及Pita、Pi21和ERF922的三突变纯合株系,突变株系的稻瘟病抗性显著提高,获得了能够稳定遗传的抗稻瘟病水稻材料。还有高彩霞研究团队利用CRISPR/Cas9改良后的PPE 编辑系统,在原生质体中的9 个水稻位点产生了所有12种类型的单碱基替换,以及多种点突变和小DNA 片段插入,成功获得了单碱基突变、多碱基突变及精准删除的水稻突变体植株[5]。
以上研究成果表明,自2013 年以来,水稻的CRISPR/Cas9编辑系统已不断趋近成熟,能够快速、准确对水稻每穗粒数基因、抽穗基因、香味基因、控制糯性基因、温敏不育基因等各种功能性基因位点进行定点编辑,并能在短时间内获得能进行稳定遗传的突变植株和目标突变株系,大大缩短了水稻育种进程,提高了水稻育种效率,使水稻定向育种成为可能。
3.1.2 在小麦遗传改良中的研究进展 小麦是异源多倍体,基因组庞大(17 Gb)、重复性高、遗传结构复杂,导致利用CRISPR/Cas9 系统对小麦基因组进行定点编辑、实现遗传改良相对比较困难。高彩霞课题组率先实现利用CRISPR/Cas9系统对小麦特定基因进行定点突变,且在小麦基因组编辑方面一直处于国际领先水平。该课题组成员Shan 等利用CRISPR/Cas9 技术对控制小麦籽粒形状和分蘖的基因TaGASR7、TaDEP1进行定点编辑,原生质体突变效率达到14.5%~38.0%,首次实现了该技术对小麦基因的定点编辑[30]。课题组成员王延鹏等报道以六倍体小麦抗白粉病相关基因TaMLO单拷贝设计靶位点,利用CRISPR/Cas9技术对小麦原生质体进行定点编辑,成功在A基因组定点插入能稳定遗传的片段,表明该技术不仅可以同时突变多倍体小麦中的多个拷贝,也能特异突变单个基因拷贝[37]。2016 年,依然是该团队的Zhang 等继续对未成熟胚细胞的TaMLO位点进行编辑,T0代获得突变体材料,并在后代分离出没有任何转基因成分的突变体植株;2017 年,Zhang 等又对小麦EDR1基因的3 个同源基因同时进行敲除,在T1代便获得了没有任何可检出转基因成分的突变体材料,突变体植株对白粉病具有很好的抗性,进一步证实了CRISPR/Cas9 技术能对多倍体小麦进行定点编辑的可行性和有效性[9,38]。杜丽君等[39]以TaMOC1基因为靶位点,利用农杆菌将表达载体pBUE411-TaMOC1-Cas9 转移到野生型小麦品种‘科农199’的幼胚中,确定了TaMOC1对小麦分蘖的作用,并获得TaMOC1的转基因植株,但pBUE411-TaMOC1-Cas9 转化效率仅为1.6‰。高彩霞研究团队Liang 等 利 用CRISPR/Cas9 ribonucleoproteins(RNPs核糖核蛋白)技术对面包小麦的TaGW2TaGW2和TaGASR7基因进行编辑,同时与pGE-TaGW2 技术进行对比,原生质体突变效率从35.6%~41.2%降低到21.8%~33.4%、脱靶率从30.8%降至5.7%,未成熟胚细胞编辑效率从0.99%~1.00%降低到0.18%~0.21%、脱靶率从0.76%降至0.03%,虽然编辑效率有所降低、但同时更大幅度的降低了脱靶率;对获得的T0代植株基因位点的突变率进一步跟踪,gw2-RNPs 与pGETaGW2 两种技术的突变率分别为4.4%和4.7%,突变效率相当,实验结果表明CRISPR/Cas9 RNPs 技术不仅能完全消除CRISPR/Cas9体系质粒片段整合到目的基因,还能大幅度降低脱靶率、快速(7~9周内)获得不含任何外源基因的目标突变体,从而为更有效的利用CRISPR/Cas9编辑技术研究小麦基因功能以及定向培育新品种提供了新方法[40-41]。2020 年,该研究团队用一种优化过的CRISPR/Cas9 引导编辑系统(prime editing system,PPE),在原生质体中6个小麦位点上产生了所有12种类型的单碱基替换,以及多种点突变和小DNA片段插入,这些突变均难以通过现有的基因编辑系统实现[5]。以上研究结果表明,因为小麦是异源多倍体(六倍体居多)、基因组庞大,利用CRISPR/Cas9技术进行定点编辑时效率很低,但随着对系统的不断改进和优化,使其在短时间内成功获得纯合的、能稳定遗传的目标突变株系成为可能。

表1 CRISPR/Cas9技术在水稻遗传改良中的研究进展
3.1.3 在玉米遗传改良中的研究进展 在玉米方面,Liang等在玉米原生质体中,成功利用CRISPR/Cas9基因编辑技术对玉米磷酸激酶ZmIPK内2个不同位点进行编辑,这是玉米方面利用此技术最早的报道,但未获得 再 生 植 株[42]。2015—2016 年,Svitashev 等 利 用CRISPR/Cas9 技术,以乙酰乳酸合成酶基因ALS2为靶基因,通过基因枪轰击法,将CRISPR-Cas9-ALS2-gRNA 复合物转入玉米未成熟胚细胞,成功实现了对基因ALS2的定点编辑,并指出利用该技术可以高效地获得玉米基因编辑再生植株[43-44]。Feng 等[45]以玉米Zmzb7基因为靶基因,利用农杆菌将特异的CRISPRCas9-gRNA质粒侵染转化玉米未成熟胚,实现了基因定点编辑,突变率达19%~31%。2017 年,Char 等[46]利用农杆菌转移CRISPR/Cas9 编辑系统,成功对玉米4个基因ZmAgo18a、Zm-Ago18b、Zm-Ago a1和a4实现高效靶基因突变,并获得了突变植株。Li 等[47]利用特异RNA介导CRISPR/Cas9诱变系统,对玉米无叶舌基因LG1进行编辑,T0植株代中突变效率达到51.5%~91.2%,分别以突变体和野生型作为亲本进行杂交育种,突变体作为亲本的杂交玉米叶夹角生长角度更小。Chen 等[48]报道利用CRISPR/Cas9 技术编辑玉米雄性不育基因MS8,T0代获得了8个转基因株系,突变株系基因组分析结果表明MS8基因并没有发生突变,而是其他位点发生了单碱基突变,突变性状能稳定遗传给后代,获得新的无外源转基因污染的(Transgene-Free)的玉米雄性不育系品系。
3.2 CRISPR/Cas9 基因编辑技术在油料作物遗传改良中的研究进展
与水稻、小麦、玉米等粮食作物相比,受遗传转化效率低、缺乏通量载体等因素的影响,利用CRISPR/Cas9 技术在花生、大豆、油菜等油料作物中的研究进展相对比较落后,特别是在花生这一作物中,相关报道很少,He 等利用CRISPR/Cas9 技术、以花生毛状根为材料,对FAD2基因成功进行了定点编辑,但并没有成功获得相应的突变体植株[49]。
3.2.1 在大豆遗传改良中的研究进展Li等[50]采用粒子轰击转化法,将CRISPR/Cas9载体和供体DNA共转化到大豆胚愈伤组织中,在大豆中实现了靶位点突变和基因插入,其中DD20和DD432个基因位点的突变频率分别达到59%和76%,并且通过编辑大豆ALS1基因成功获得了氯磺隆抗性转基因大豆。Cai 等[51]利用CRISPR/Cas9 技术,首次应用农杆菌介导大豆子叶节遗传转化体系,对大豆光周期调节基因3 个不同靶位点进行靶向突变,结果证实T1代大豆植株在自然光周期下发生晚花现象,T2代大豆纯合体在长、短日照下均呈现出晚花表型;并从T1/T2代大豆植株中鉴定出一批不含有转基因元件的纯合突变体,成功创制出稳定遗传的大豆突变体材料,为深入研究GmFT2a基因的功能以及大豆育种提供了全新材料。以大豆子叶节为遗传转化体,不仅提高了获得突变植株的几率,还缩短了获得突变体植株的时间,为有效利用CRISPR/Cas9 技术进行大豆基因定点编辑具有非常重要的意义,后续研究人员基本上都是用大豆子叶节为转化体进行相关方面的研究,且成效显著。候智红等[52]以大豆‘华夏3号’为材料,利用CRISPR/Cas9技术对控制油酸转化为亚油酸的关键酶基因FAD2-1A外显子区进行靶向编辑,T1代获得纯合的GmFAD2-1A突变体,纯合突变体种子油酸含量达23%,显著高于‘华夏3 号’,但株高、叶形、花色、种皮色、生育期等其他性状均无显著差异,进一步证实FAD2-1A基因是油酸代谢过程中的关键基因,并获得了稳定纯合的株型健壮、丰产性突出、综合抗性好、油酸含量高的GmFAD2-1A突变体植株。吴艳等[53]利用CRISPR/Cas9 基因编辑技术,对大豆GmSPL3家族基因进行编辑,将pYL CRISPR/Cas9-GmSPL3-gRNA 载体转化到根癌农杆菌中,侵染大豆子叶节获得spl3abcd突变体,并与野生型表型进行对比,表明GmSPL3在调控大豆植株形态方面发挥重要功能。柏梦焱等[11]为研究豆科作物结瘤自我调节机制的作用机理,运用CRISPR/Cas9 基因编辑技术创制大豆品种‘华春6 号’超结瘤gmnark基因,获得了超结瘤、矮小和叶片深绿的突变体材料。以往研究结果表明,虽然花生与大豆都是豆科作物和油料作物,但是相对于花生,利用CRISPR/Cas9系统在大豆突变体创制、遗传改良方面要成熟得多,为利用此系统进行大豆定向育种提供了强有力的技术支撑,也为花生提供了有效的参考。
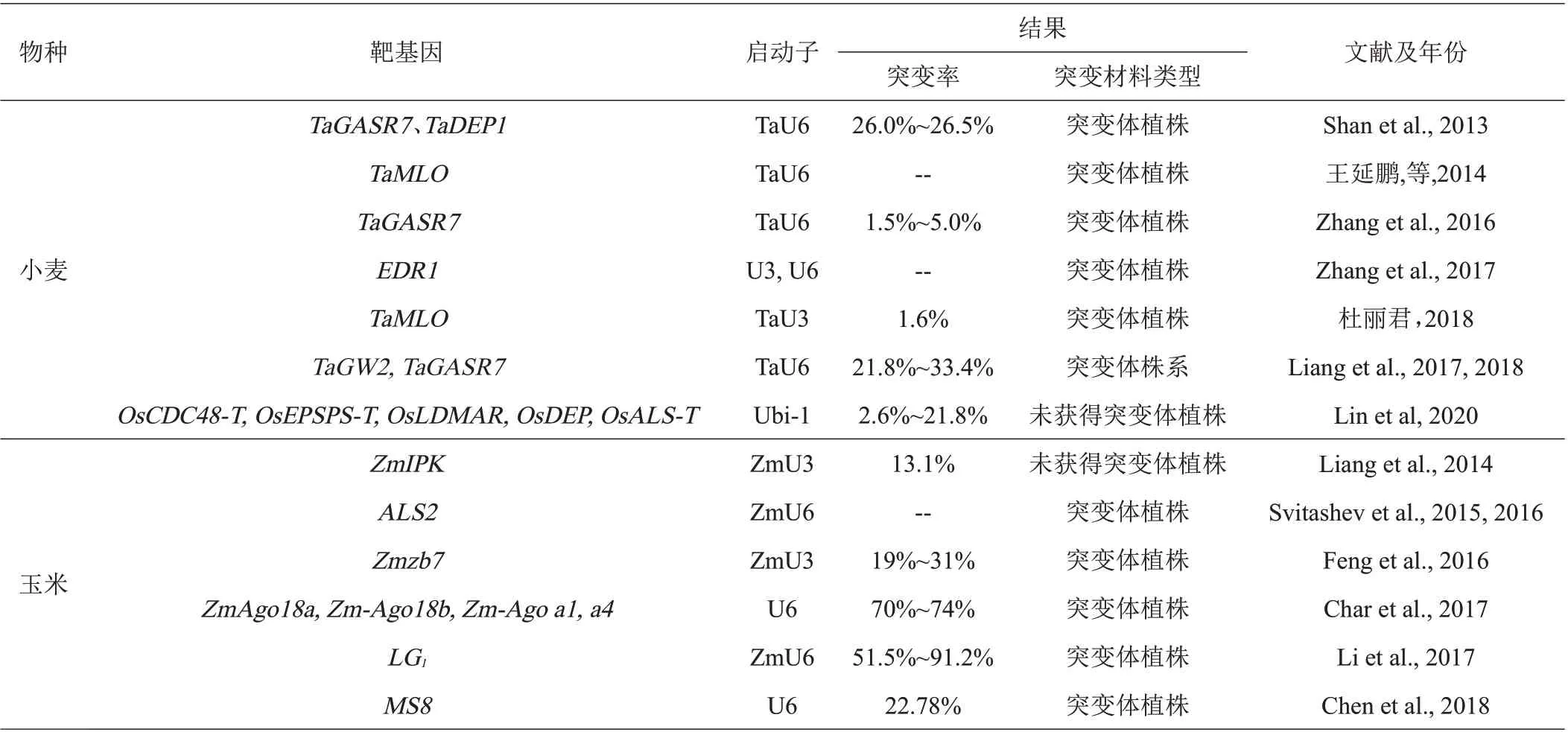
表2 CRISPR/Cas9技术在小麦和玉米遗传改良中的研究进展
3.2.2 在油菜遗传改良中的研究进展 在油菜方面,成功利用此CRISPR/Cas9系统进行基因定点编辑的最早报道是在2017年,Yang等[54]对油菜的BnCLV基因进行定点编辑,用不同的sgRNA 序列产生的突变频率为0%~48.5%不等,证实sgRNA 对CRISPR/Cas9 编辑效率的重要性,同时也证实了BnCLV基因对控制油菜的每荚粒数和重量具有重要作用。Sun等[55]利用该技术对BnWRKY11的2 个位点和BnWRKY70的4 个位点进行 编 辑,T0代 获 得 的22 株BnWRKY11和8 株BnWRKY70转化植株中,基因位点发生突变的分别有12株和4株,突变率分别为54.5%和50%,对T2植株继续跟踪,BnWRKY70位点发生突变的植株对菌核病的抗性增加、BnWRKY11发生突变的植株没有明显效果,从而推断出BnWRKY70基因可能与调控油菜菌核病抗性有关。Zhai等[56]对油菜的BnIND和BnALC2个基因进行定点编辑,在T0代获得的251 株BnIND和269株BnALC转化植株中,分别有202 株和206 株的基因位点发生了插入突变,突变率分别为80.5%和76.6%,对纯合的T2BnIND突变植株继续研究,结果表明BnIND基因可能与油菜抗裂荚有关,获得了能稳定遗传的、抗裂荚的纯合突变体株系,抗裂荚一直是油菜育种的瓶颈之一,很难通过普通育种方法得到改良,利用CRISPR/Cas9技术却在短时间内攻克了这一困扰油菜育种多年的难题。因此,CRISPR/Cas9 系统为油菜基因功能研究、高效定向培育新品种等方面提供了可靠而有效的新途径。
4 小结与展望
CRISPR/Cas9 系统原理简单,自2013 年诞生以来便得到了迅速发展和应用,是目前基因组编辑领域最受欢迎的新方法,操作简单、周期短、位点选择多,并且随着科技人员不断努力、技术日益创新,如何提高编辑效率、降低脱靶率等难题也不断得到了解决,能够实现对水稻、小麦、玉米、大豆、油菜等粮油作物的靶基因进行定向精准编辑。此外,通过该系统获得的转基因植株,通过传代,可以分离获得没有转基因片段、且能稳定遗传的突变株系及品种,不会产生类似由转基因引发的可能影响物种进化、食品安全等方面的不利因素,有利于利用CRISPR/Cas9基因组编辑技术改良后的粮油作物品种规模化、商业化生产,还能高效、定向改良某些性状(传统育种方法难以改良)从而育成目标新品种,所有这些都使该系统成为粮油作物及其他物种基因组编辑最热门的新手段。但是,CRISPR/Cas9 系统在粮油作物遗传育种上的利用效率很大程度上依赖作物本身功能基因的解码、转化体系的建立以及编辑效率的高低,因此,解决这些难题是加大应用该系统进行作物遗传改良、定向育种的关键。
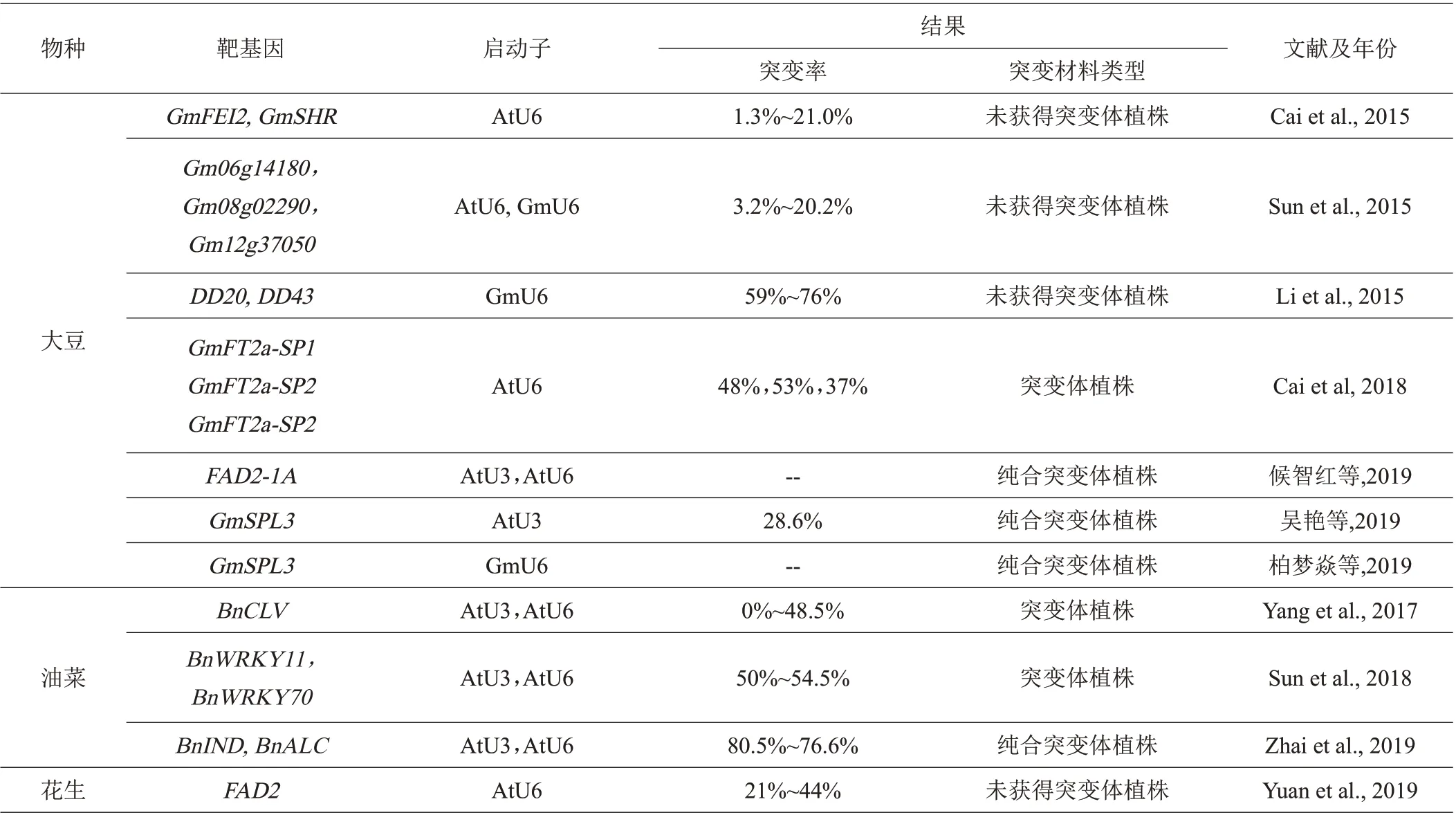
表3 CRISPR/Cas9技术在大豆、油菜和花生遗传改良中的研究进展
