硒对亚硝酸钠导致的草鱼肝细胞氧化损伤的保护作用
2021-09-08姚朝瑞李大鹏
姚朝瑞 马 聘 李大鹏 李 莉 汤 蓉
(华中农业大学水产学院, 池塘健康养殖湖北省工程实验室, 武汉 430070)
硒(Selenium, Se)是动物的必需微量元素之一。自1957年Schwar等[1]研究发现硒是阻止大鼠(Raltus norvegicus)食饵性肝坏死的第三因子的主要组分, 首次证实动物需要硒元素。目前研究已显示硒元素的重要生物功能包括抗氧化、抗应激、加强机体免疫力和抗肿瘤等[2,3]。Ferbal等[4]发现在鲤(Cyprinus carpio)饲料中添加适量硒元素, 能有效抵抗铅导致的肝脏和脑部的氧化损伤。Talise等[5]发现, 在饲料中添加亚硒酸钠能有效预防百草枯对斑马鱼(Danio rerio)的氧化损伤。Saffari等[6]证实在鲤幼鱼饲料中补充纳米硒能显著提升鲤生长性能和饲料利用率。而硒缺乏会损伤幼龄草鱼的免疫器官和免疫功能[7]。由于饲料中硒的利用率偏低及各种应激因子的不利影响, 养殖鱼类对硒元素的需求可能会不断提高[8]。
亚硝酸盐是生态系统中氮循环的一个天然组成部分, 养殖水体中亚硝酸盐浓度偏高也是水产养殖过程中一个不容忽视的问题[9]。近年来高密度的集约化养殖方式造成的高蛋白残饵和高含氮排泄物不断沉积于池底, 造成水体内源性来源的亚硝酸盐含量不断增高[10]。淡水鱼类对亚硝酸盐的吸收主要是通过与CⅠ-有效地竞争鳃上氯化物的主动吸收机制[11—13]。高浓度或长时间的亚硝酸盐暴露会致使鱼体应激增强, 组织缺氧, 体内氧自由基积累, 抑制抗氧化系统, 直接或间接的影响鱼类的免疫活力[14—16], 严重时会引发生物的暴发性死亡, 如何提高养殖鱼类对亚硝酸盐暴露的抵抗能力成为近些年来的研究热点。
Keap1-Nrf2介导的信号通路具有抗氧化应激和维持氧化还原平衡的功能, 能够诱导其下游的抗氧化相关基因(如GPX、SOD和CAT等)表达, 提高机体抗氧化能力[17,18], Fontagne′-Dicharry等[19]发现膳食硒能通过上调Nrf2通路, 提高GPX和CAT等抗氧化酶活性, 来提高虹鳟育苗的抗氧化能力,Noha等[20]在大鼠中也有发现硒能通过上调Nrf2通路来抵抗肝脏砷中毒现象。
草鱼(Ctenopharyngodon idella)属于鲤形目鲤科雅罗鱼亚科草鱼属, 生长速度快, 单位面积产出高, 而且肉质嫩白, 含丰富的营养成分, 具有可观的经济效益和营养价值。研究发现, 给草鱼适当补充硒元素能有效提高肝脏抗氧化性, 维持组织结构完整[21]。肝脏是鱼体重要的代谢和解毒器官, 本研究以草鱼肝细胞为研究对象, 观察和检测硒孵育后肝细胞在不同浓度的亚硝酸钠暴露后, 其氧化应激及细胞凋亡的状况, 以探究硒对亚硝酸钠导致的草鱼肝细胞损伤的干预作用。
1 材料与方法
1.1 材料
草鱼肝细胞系(L8824)购自中国典型培养物典藏中心; M199培养基、胰蛋白酶、青霉素-链霉素双抗(Penicillin Streptomycin, PS)均购自Gibco公司;胎牛血清(FBS)购自四季青公司; 磷酸盐缓冲溶液(Phosphate buffered solution, PBS)购自HyClone公司; 细胞增殖-毒性检测试剂盒(Cell Counting Kit-8)购自同仁化学科技有限公司; 总蛋白定量(BCA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX)试剂盒均购自南京建成试剂公司; Annexin V-FITC /PI凋亡试剂盒购自上海翊圣生物科技有限公司; 荧光定量试剂盒购自上海翊圣生物科技有限公司; 亚硝酸钠(NaNO2)为分析纯, 购自国药集团; 亚硒酸钠(Na2SeO3)为分析纯, 购自天津市化学试剂研究所。
1.2 草鱼肝细胞L8824的培养
L8824细胞培养于含10%胎牛血清、链霉素(100 μg/mL)和青霉素(100 IU/mL)的M199培养基中, 在28℃和5%CO2饱和湿度培养箱中培养细胞。根据细胞生长状况, 2—3d传代1次, 传代时用含EDTA的0.25%胰蛋白酶消化, 取生长状态良好处于对数生长期的细胞进行实验。
1.3 细胞活性检测
采用CCK-8法检测细胞活性, 取生长良好处于对数生长期的L8824细胞(6—8×105个/mL)接种于96孔板中, 保证每孔数量不低于1000个, 每孔100 μL,培养12h, 待细胞在孔底铺至70%—80%, 分别加入不同浓度的亚硒酸钠和亚硝酸钠, 使亚硒酸钠的终浓度为0、0.5、1、2、5、10、15、20、25和35 μmol/L,培养3h、6h、12h、24h、36h和48h, 亚硝酸钠终浓度为0、1、2.5、7.5、10、15、20、25、30和50 mg/L,培养24h, 空白组为基础培养基, 每组8个复孔, 每孔加入10 μL的CCK-8, 28℃孵育2h, 置于多功能酶标仪上, 检测波长为450 nm的吸光值(Optical density,OD), 细胞存活率(%)=[实验组-空白组]/[对照组-空白组] ×100。
将实验分为4组, 对照组: 加入等量M199培养基; Se组: 10 μmol/L的Na2SeO3作用36h; NaNO2组:不同浓度的NaNO2暴露, 使NaNO2的终浓度为5、10和25 mg/L, 暴露24h; Se+NaNO2组: 先加入终浓度为10 μmol/L的Na2SeO3预处理12h, 再加入5、10和25 mg/L的NaNO2, 暴露24h。
1.4 细胞形态学观察
取生长状态良好且处于对数生长期的L8824接种于12孔板中, 经对照组、Se组、NaNO2组和Se+NaNO2组的药物处理完毕后, 用PBS洗涤2次, 在倒置显微镜下观察细胞形态变化, 用CCD系统拍照。
1.5 氧化应激指标检测
取生长状态良好且处于对数生长期的L8824接种于12孔板中, 经对照组、Se组、NaNO2组和Se+NaNO2组的药物处理完毕后, 胰蛋白酶消化,1000 r/min离心6min得到细胞沉淀, 用PBS洗涤2次,PBS悬浮细胞, 分装至1.5 mL离心管中, 在液氮和28℃水浴锅中反复冻融3次, -20℃冻存。BCA法测定样品蛋白浓度, 按照试剂盒说明书进行操作, 用酶标仪在562 nm处测定, 并计算样品蛋白活性; 超氧化物歧化酶(SOD): 按照SOD试剂盒操作, 用酶标仪在550 nm处测定, 并计算SOD的活性; 过氧化氢酶(CAT): 按照CAT试剂盒操作, 用酶标仪在405 nm处测定, 并计算CAT的活性; GSH-PX 活性测定: 按照GSH-PX试剂盒操作, 用酶标仪在 412 nm 处测定, 并计算 GSH-PX 的活性。
1.6 细胞凋亡检测
取生长状态良好且处于对数生长期的L8824接种于12孔板中, 经对照组、Se组、NaNO2组和Se+NaNO2组的药物处理完毕后, 不含EDTA的胰蛋白酶消化, 300×g, 4℃离心5min收集细胞, 用预冷的PBS洗涤细胞2次, 每次均需300×g, 4℃离心5min,收集1—5×105细胞。吸弃PBS, 加入100 μL 1×Binding Buffer重悬细胞, 再加入5 μL Annexin V-FITC和10 μL PI Staining Solution, 轻轻混匀, 然后避光, 室温反应10—15min, 最后加入400 μL 1×Binding Buffer, 混匀后放置于冰上, 样品在1h内用流式细胞仪检测。
1.7 基因表达检测
取生长状态良好且处于对数生长期的L8824接种于6孔板中, 经对照组、Se组、NaNO2组和Se+NaNO2组的药物处理完毕后, 每孔加入1 mL Trizol, 用Trizol法抽提细胞RNA, 并用1%琼脂糖凝胶电泳和NanoDrop 2000分光光度计检测其浓度和质量。用Hifair®Ⅱ 1st Strand cDNA Synthesis SuperMix for qPCR试剂盒进行反转录, 实际操作根据试剂盒进行。得到cDNA后, 再用Hifair®qPCR SYBR Green Master Mix (Low Rox Plus) 试剂盒进行实时荧光定量分析,β-actin作为内参基因, 设计各个基因的引物(表 1), 反应体系为: Master Mix 10 μL,上游引物0.4 μL, 下游引物0.4 μL, cDNA1.2 μL,ddH2O 8 μL, 反应条件为: 95℃ 5min, 95℃ 10s,55—60℃ 20s, 40个循环, 72℃ 20s, 每个样品3个重复。

表1 qPCR引物Tab. 1 Primers used for qPCR
1.8 统计分析
实验结果用平均值±标准差(Mean±SD)表示,数据分析由SPSS 19.0统计软件进行单因素方差分析, 然后通过 Duncan氏法进行多重比较, 显著性水平P<0.05。
2 结果
2.1 亚硒酸钠和亚硝酸钠对L8824细胞活力的影响
结果显示, 低浓度亚硒酸钠处理后的细胞活力高于对照组, 较对照组有显著性差异(P<0.05), 活力呈先上升后下降趋势, 在10 μmol/L 3—36h阶段活力值最高(图 1), 在实验分组时, 选择10 μmol/L,12h作为Se+NaNO2组的预处理条件。在亚硝酸钠暴露后, 细胞活力随着浓度的升高而降低(图 2)。
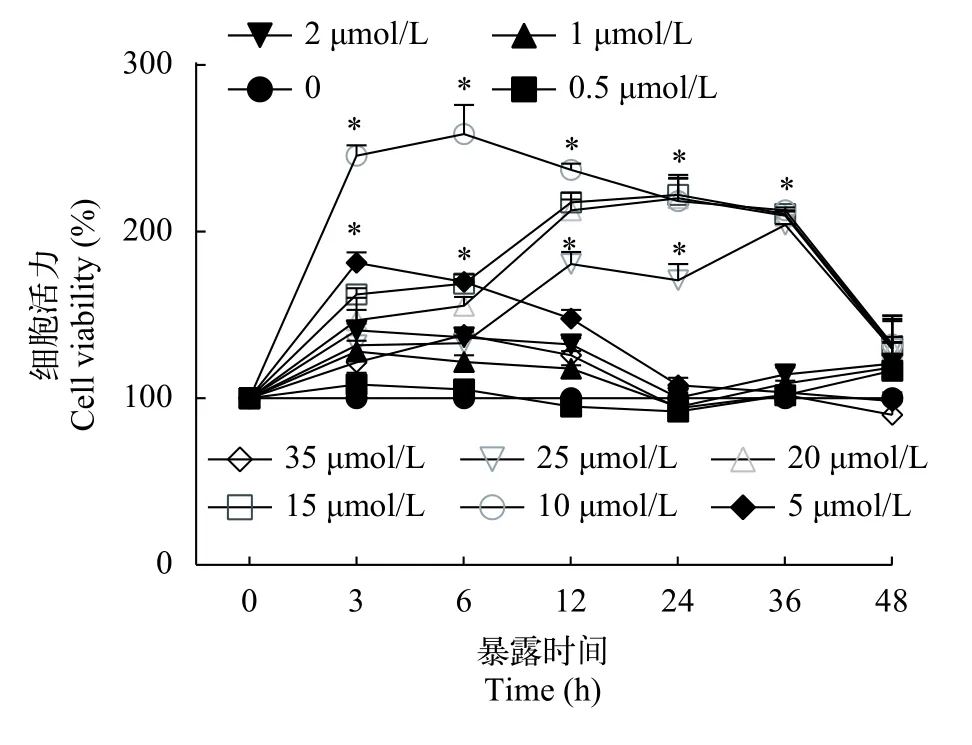
图1 不同浓度亚硒酸钠孵育不同时间对L8824细胞活力的影响Fig. 1 Effects of different concentrations of sodium selenite incubation at different times on the viability of L8824 cells
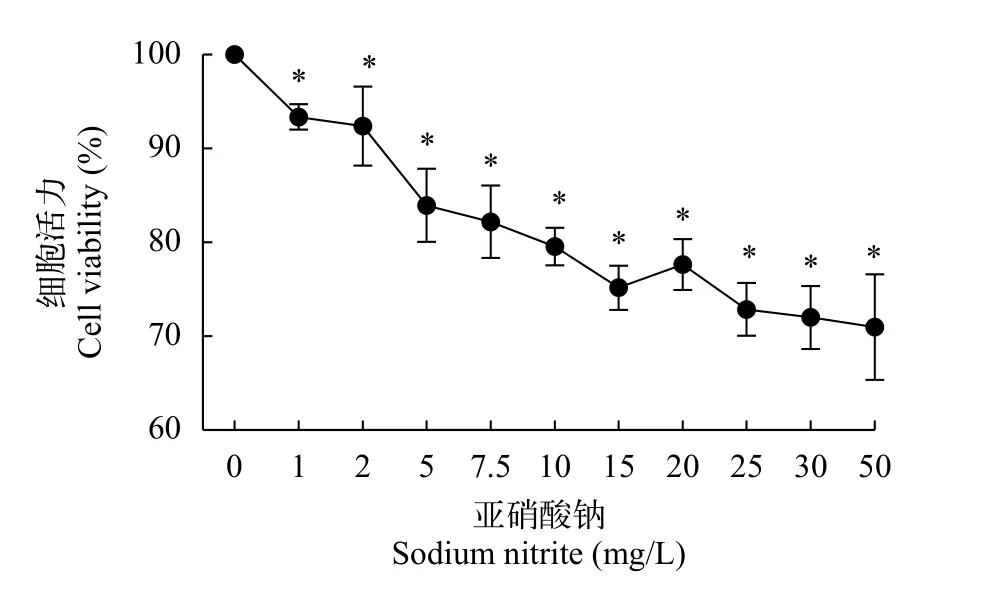
图2 不同浓度亚硝酸钠暴露24h对L8824细胞活力的影响Fig. 2 Effect of sodium nitrite exposure for 24h on the viability of L8824 cells
2.2 亚硒酸钠对亚硝酸钠暴露后的L8824细胞形态的影响
结果显示, 对照组L8824细胞呈梭形, 正常贴壁生长, 细胞边界清晰, 圆润, 未出现细胞空泡; Se组细胞正常贴壁生长, 形态清晰, 较对照组无明显差异; 在NaNO2组中, 5 mg/L组细胞贴壁能力开始变弱, 有小范围细胞脱落现象, 脱落细胞周围开始出现空泡; 10 mg/L组细胞脱落范围变大, 漂浮细胞增多, 细胞空泡较明显; 25 mg/L组细胞开始大面积脱落, 皱缩, 毒性作用明显; Se+NaNO2(5、10 和25 mg/L)组细胞贴壁良好, 边界清晰, 无皱缩现象, 有极少数空泡, 经硒孵育后, 在亚硝酸钠暴露下细胞仍生长良好(图 3)。

图3 亚硒酸钠和亚硝酸钠暴露后L8824细胞形态观察(10×)Fig. 3 Morphological observation of L8824 cells after exposure to sodium selenite and sodium nitrite
2.3 亚硒酸钠对亚硝酸钠诱导L8824细胞凋亡的影响
结果表明, 不同浓度的NaNO2对L8824细胞有不同程度的促凋亡作用, 随着浓度的增高, 早期和晚期凋亡细胞逐步增多, 较对照组有显著性差异(P<0.05), 当NaNO2浓度在25 mg/L时, 细胞凋亡率可达18.69%, 在Se+NaNO2组中, 细胞凋亡水平显著下降, 平均凋亡率为11.34%。结果显示, 硒的预孵育能有效缓解亚硝酸盐暴露导致的细胞凋亡(图 4)。
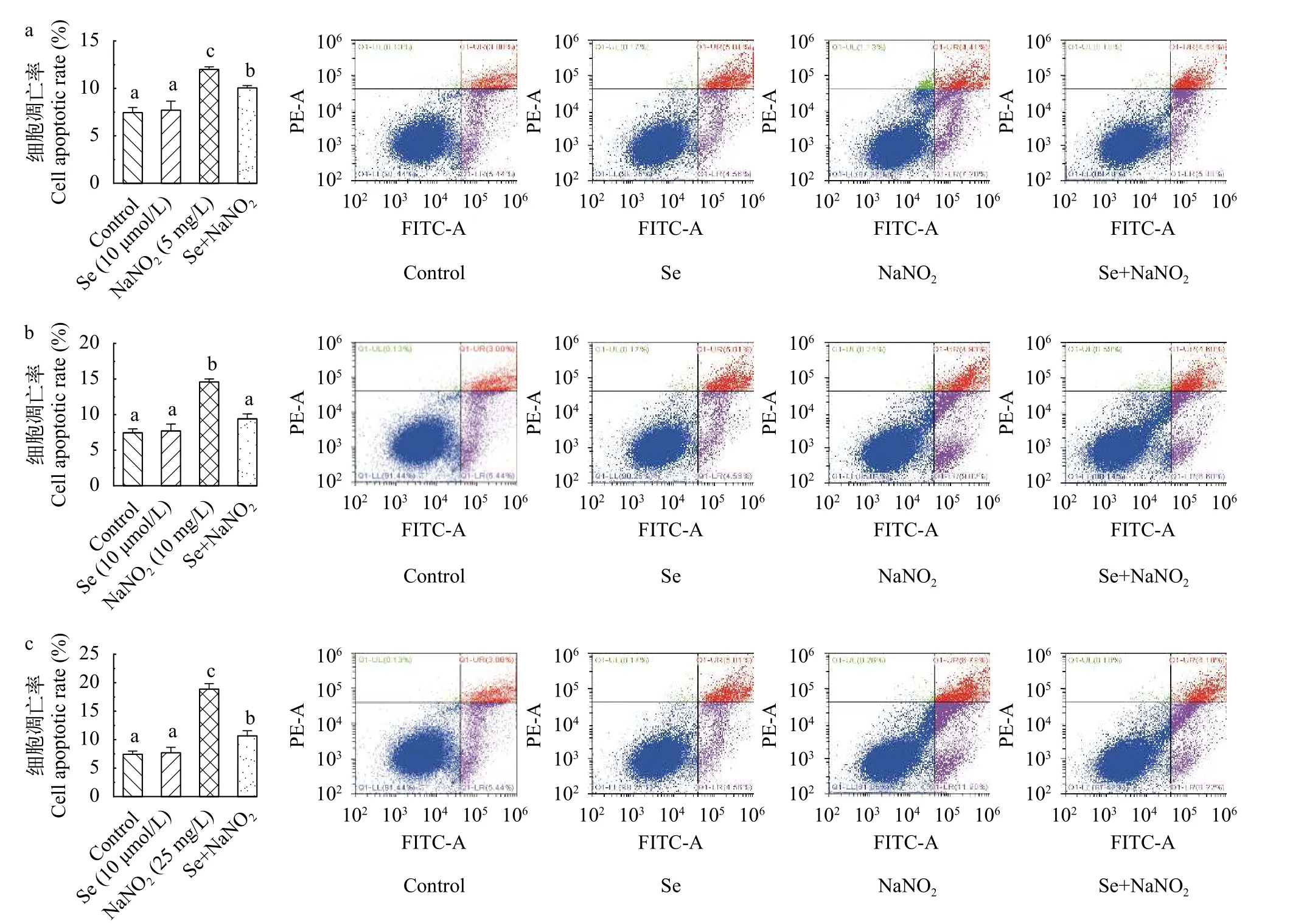
图4 亚硒酸钠预孵育对亚硝酸钠诱导L8824细胞凋亡的影响Fig. 4 Effects of sodium selenite and sodium nitrite on apoptosis of L8824 cells
2.4 亚硒酸钠对亚硝酸钠诱导L8824细胞氧化损伤的影响
结果表明, 在NaNO2浓度为5 mg/L时, SOD显著上升, GPX显著降低(P<0.05), CAT无明显变化,在NaNO2浓度为10和25 mg/L时, GPX、SOD和CAT的活性均逐渐降低(P<0.05), 在NaNO2浓度为25 mg/L时, SOD和CAT持续降低(P<0.05), GPX无明显变化, 在亚硒酸钠预孵育12h后, 各组细胞的GPX、SOD和CAT的活性基本能维持在正常水平,较对照组无显著性差异。结果显示, 硒的预孵育能提高细胞抗氧化能力, 抵抗NaNO2暴露带来的氧化损伤(P>0.05; 图 5)。
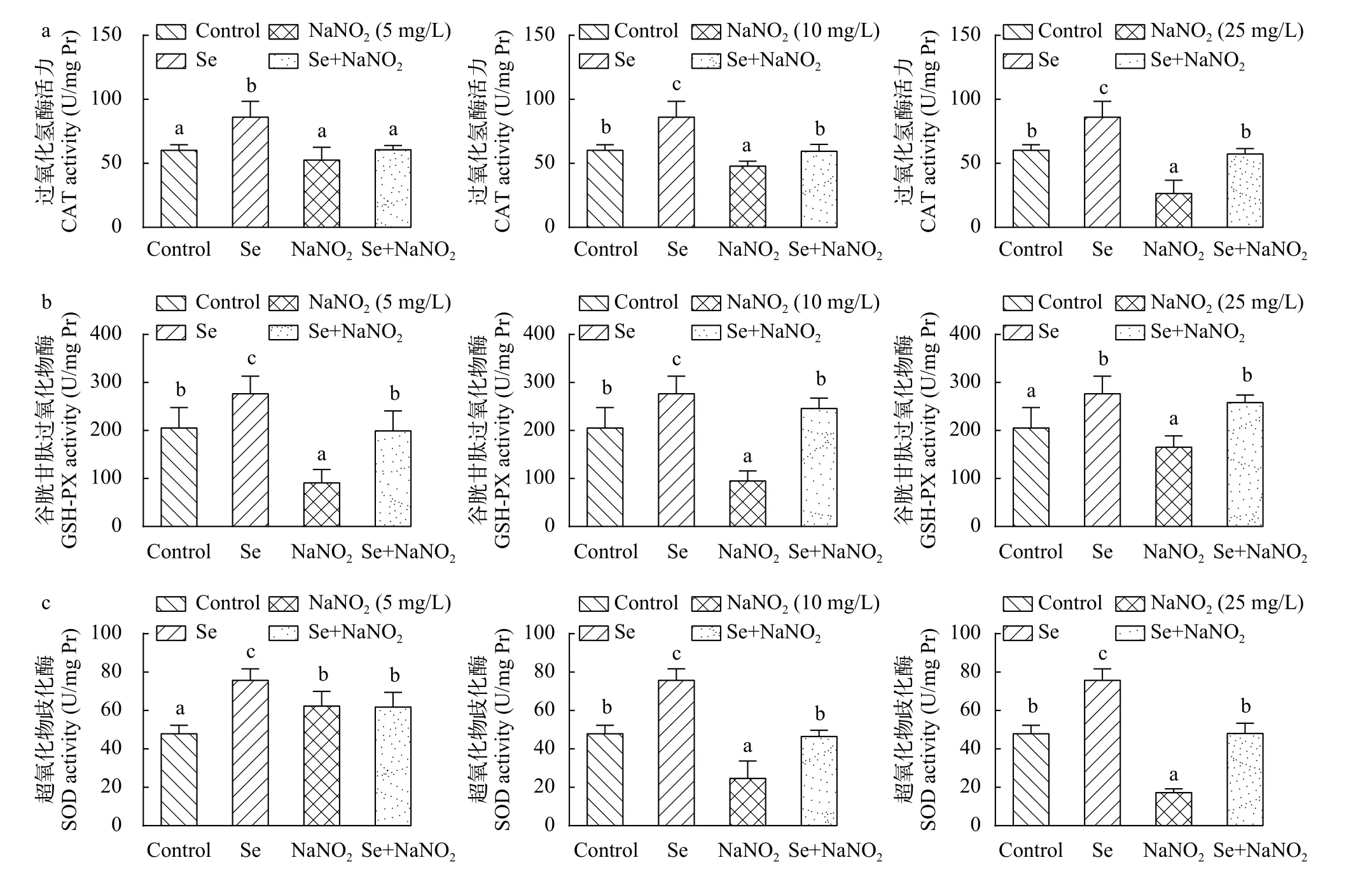
图5 亚硒酸钠预孵育对亚硝酸钠诱导L8824细胞氧化损伤的影响Fig. 5 Effect of sodium selenite on oxidative damage of L8824 cells induced by sodium nitrite
2.5 亚硒酸钠对亚硝酸钠暴露后的L8824细胞抗氧化及凋亡相关基因的影响
结果显示, 与对照组细胞相比, Se组细胞中的chop、bax、bcl-2和keap1 mRNA表达量差异不显著(P>0.05),Nrf2、gpx、sod和catmRNA表达量显著上升(P<0.05), NaNO2组细胞中,chop和baxmRNA表达量显著上升(P<0.05), 当NaNO2浓度为5 mg/L时,sodmRNA表达量显著上升(P<0.05), 浓度为10和25 mg/L时,sod、gpx和catmRNA表达量显著下降(P<0.05), 在Se+NaNO2组中,chop、bax、gpx、sod和catmRNA表达量差异不显著(P>0.05),其中NaNO2浓度为5和10 mg/L时,bcl-2 mRNA表达量显著上升(P<0.05)。结果表明, 细胞抗氧化能力的增强可能是通过Nrf2-Keap1通路来实现的(图 6)。
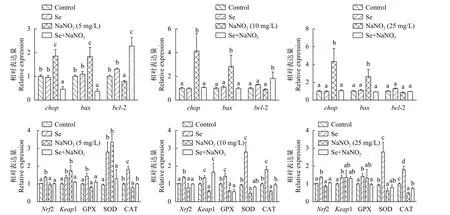
图6 亚硒酸钠预孵育对L8824细胞酶活及凋亡相关基因的影响Fig. 6 Effect of sodium selenite preconditioning on enzyme activity and expression of apoptosis-related genes in L8824 cells
3 讨论
3.1 硒对草鱼肝细胞抗氧化功能的影响
已有研究表明, 硒可通过增强机体的抗氧化功能, 清除过氧化物, 保护生物膜和生物大分子免受氧化损伤, 降低水产动物的发病率和死亡率[22—25]。在草鱼日粮中添加0.6—1.2 mg/kg的硒(Na2SeO3)能增强草鱼机体抗氧化功能[21], 在鲤和虹鳟幼鱼日粮中分别添加0.7和0.5—1.7 mg/kg的硒元素, 也发现了同样的现象[6,19], 与本实验中硒元素浓度基本一致。在本实验中, 10 μmol/L 亚硒酸钠的预孵育能有效提高肝细胞S O D、C A T 和G P X 的活性(P<0.05)。GPX的活性中心是硒半胱氨酸, 是衡量机体硒水平的一项重要生化指标[19], 硒孵育后能显著提高GPX的活性, 表明10 μmol/L 的亚硒酸钠作用12h后, 硒元素已进入胞内并发挥作用。
高浓度亚硝酸盐暴露会使鱼体内产生大量活性氧(ROS), 如超氧阴离子自由基(), 羟自由基(·OH)和 H2O2等[26,27], 还会抑制细胞清除活性氧的相关酶的活性, 鱼体对不良环境的抵抗能力下降,免疫代谢功能失调, 免疫力下降, 则会诱发鱼类发病[28,29]。在NaNO2暴露后, 肝细胞SOD活性呈先上升后下降的趋势, 较对照组有显著性差异(P<0.05),CAT和GPX活性均有显著性抑制(P<0.05)。这可能是由于低浓度短时间的亚硝酸盐暴露激活了细胞自身抗氧化系统, SOD升高, 清除胞内自由基; 而高浓度亚硝酸盐使细胞产生大量的超氧阴离子自由基(), 消耗大量SOD, 随着亚硝酸钠浓度逐渐升高, 细胞自身清除的平衡机制被打破, SOD受到抑制。同样, SOD在歧化反应及与其他抗氧化酶反应后会产生较多的H2O2, 消耗大量CAT和GPX, 且过氧化氢酶系统可能会通过氧化来解NaNO2的毒性机制[30], 在一段时间后, CAT和GPX便开始下降。
而在硒预孵育12h后再用亚硝酸钠暴露, 肝细胞GPX、SOD和CAT均能基本维持在正常水平(P>0.05)。可能是细胞经硒预孵育后, 胞内抗氧化酶活性升高, 当亚硝酸盐暴露产生大量自由基后, 这些抗氧化酶能及时有效的清除自由基, 使细胞维持正常的生理机制, 表明此时细胞抗氧化能力增强, 并能抵抗一定浓度亚硝酸盐暴露导致的氧化损伤。
3.2 硒对抗氧化基因和Nrf2/Keap1通路基因表达的影响
Nrf2/Keap1介导的信号通路具有抗氧化应激和维持氧化还原平衡的功能, 非应激状态时,Keap1在细胞质和Nrf2相结合, 促进Nrf2蛋白泛素化和蛋白酶体降解, 维持Nrf2在低水平状态, 应激状态时,Nrf2的泛素化和蛋白酶体降解被阻断,Nrf2转移至细胞核内, 诱导细胞保护相关基因的表达[31,32]。本实验结果显示, 在补硒组中,keap1、sod、cat和gpxmRNA表达量显著上升(P<0.05), 在硒预孵育后, 再经亚硝酸盐暴露, 细胞中gpx、sod和catmRNA表达量也能维持在正常水平, 较正常组无显著性差异(P>0.05)。Nrf2/Keap1通路能够诱导与ROS清除相关的基因表达, 如SOD和CAT等, 减少细胞内ROS含量[33]。在鸡的肝细胞中也发现硒能通过激活Nrf2/Keap1通路来抵抗重金属镉诱导的细胞凋亡[34]。在本实验中细胞可能通过上调Nrf2/Keap1通路, 诱导gpx、sod和cat基因表达, 提高抗氧化酶活性, 来增强细胞抗氧化能力, 并能在一定程度上抵抗亚硝酸盐暴露带来的抗氧化酶活性降低, 维持细胞抗氧化系统平衡。
3.3 硒对草鱼肝细胞凋亡的作用
细胞凋亡是指为了维持内环境的稳定, 由凋亡相关基因调控的细胞自主和有序的死亡, 又称程序性细胞死亡, 是细胞为了更好的适应环境而采取的一种主动的方式[35]。长时间或高浓度的亚硝酸盐暴露能诱导细胞凋亡[36]。本实验从细胞形态上看, 随着亚硝酸盐的浓度升高, 细胞贴壁能力下降, 成片脱落, 而硒预孵育12h后的细胞生长良好, 形态正常, 基本接近正常细胞组, 表明硒的预孵育有利于细胞在亚硝酸盐的暴露中维持正常生长形态, 维持贴壁能力。在FITC和PI双荧光染色后, 观察细胞凋亡特点,由亚硝酸盐引起的细胞凋亡具有浓度依赖性, 且主要变化集中在凋亡晚期, 较正常组及补硒组凋亡细胞显著增加(P<0.05), 相反的是, 硒的预孵育能显著降低L8824的凋亡率, 并使其恢复至正常水平。
硒能有效降低细胞中bax/bcl-2比值[37], 而长时间高浓度亚硝酸盐的暴露会诱导细胞凋亡[38], 在基因表达的结果中, 亚硝酸盐暴露能上调L8824细胞中chop和bax的表达,bax/bcl-2比值显著上升(P<0.05), 而在硒预孵育12h后的细胞中,bcl-2上调,bax/bcl-2比值显著下降(P<0.05), 但在25 mg/L时,bcl-2下降到无显著性差异(P>0.05), 在亚硝酸盐5 mg/L组下调了chop和bax的表达。从流式和凋亡基因结果分析, 随着亚硝酸盐暴露浓度升高, 硒的保护作用可能会逐渐失效。亚硝酸盐能启动凋亡信号通路, 引发了L8824的凋亡, 而亚硒酸钠的预孵育能上调抗凋亡基因表达, 维持促凋亡基因表达在正常水平, 能有效缓解亚硝酸盐带来的细胞损伤和凋亡。
综上所述, 给草鱼肝细胞适当补充硒元素能在一定程度和范围内有效缓解亚硝酸盐暴露带来的抗氧化系统失衡, 其中Keap1-Nrf2介导的信号通路可能发挥了重要作用, 同时可以降低细胞凋亡率,维持细胞正常生长, 但随着亚硝酸盐浓度的增高,硒的保护作用可能会逐渐失效。
