fbxo32基因在traf6缺失斑马鱼肝脏中的表达分析
2021-09-08吴士培李凯彬许巧情徐红艳
吴士培 欧 密 李凯彬 许巧情 徐红艳,3*
(1. 长江大学动物科学学院, 荆州 434025; 2. 中国水产科学研究院珠江水产研究所, 农业农村部热带亚热带水产资源利用与养殖重点实验室, 广州 510380; 3. 西南大学水产学院, 淡水鱼类资源与生殖发育教育部重点实验室, 重庆 400715)
Fbox32(也被称为atrogin-1或MAFbx)是F-box蛋白家族的一员, 而F-box蛋白家族是SCF泛素蛋白连接酶复合物中的一类亚单位蛋白, 它能够特异性地识别磷酸化的底物, 而不同的F-box蛋白可以相应地识别不同的磷酸化底物[1]。许多研究表明,Fbox32在各种原因引起的肌肉萎缩中起着关键的作用。如有研究发现, 在禁食导致的小鼠(Mus musculus)肌肉萎缩过程中,fbxo32基因在小鼠骨骼肌中的表达量上调超过9倍[2]。在小鼠肌小管中,fbxo32基因的大量表达导致肌小管出现萎缩现象, 而当敲除小鼠的fbxo32基因后,fbxo32-/-基因型小鼠肌肉萎缩的症状相比野生型小鼠明显减轻[3]。更有进一步的研究发现, 转录因子Foxo可以通过诱导fbxo32的表达使小鼠肌肉发生萎缩, 而IGF-PI3K-AKT信号通路则能通过使转录因子Foxo失活来抑制fbxo32的表达[4]。此外,fbxo32和endophilin-A之间的相互作用有助于维持泛素蛋白酶系统的稳定和神经元的健康[5]。在鸡(Gallus gallus)中,fbxo32的高表达会加快肌肉蛋白的降解速率[6]。同样, 有研究表明在禁食的虹鳟(Oncorhynchus mykiss)中,fbxo32的高表达可能与鱼体骨骼肌和平滑肌的萎缩相关[7]。在斑马鱼(Danio rerio)中,fbxo32的缺失会导致心肌发育及心脏功能异常[8]。
值得关注的是, 本研究组最近研究发现traf6基因的缺失能引起肝脏组织基因转录本表达谱的改变, 特别是fbxo32转录本的表达水平的变化尤为显著, 其在traf6基因突变体斑马鱼肝脏中的表达异常增加近100倍(与野生型相比)。为了进一步研究斑马鱼fbxo32生理功能, 我们进行了斑马鱼肝脏组织学分析;fbxo32转录本组织特异性分析, 进一步比较分析了fbxo32转录本在traf6突变体与野生型斑马鱼的相关组织中的差异表达。特别是通过冰冻切片原位杂交技术, 深入分析了fbxo32转录本在traf6突变体与野生型斑马鱼肝脏组织的细胞定位及差异表达。本研究结果进一步利用斑马鱼这一优异的人类疾病研究模式生物[9,10], 为探讨相关疾病特别是肝萎缩的病理机制提供了新的线索及靶标。
1 材料与方法
1.1 实验动物
本实验所用野生型斑马鱼(traf6+/+)和纯合型traf6突变体斑马鱼(traf6-/-)均来自中国水产科学研究院珠江水产研究所,traf6-/-斑马鱼是由本所研究团队通过CRISPR/Cas9基因敲除技术获得, 该突变体为traf6第二外显子发生蛋白编码移框突变, 导致Traf6蛋白缺失(未发表数据)。
1.2 cDNA的制备
本研究提取的野生型斑马鱼体组织包括: 脑、肝脏、脾脏、肾脏、精巢、卵巢、肌肉和肠。提取的纯合型斑马鱼体组织包括: 脑、肝脏、脾脏、肾脏和精巢。各个组织的总RNA是根据说明书, 用TRIzol法提取得到的, 提取的各组织总RNA均用DNaseⅠ处理。然后用RevertAid First Strand cDNA Synthesis Kit试剂盒并按照试剂盒附带的说明书将RNA反转录获得相应的cDNA。
1.3 肝脏组织学分析
2月龄野生型和纯合型斑马鱼各取1尾, 对斑马鱼进行麻醉后, 在4℃下固定于4% PFA(Paraformaldehyde, PFA)中, 固定48h。在固定完成后对斑马鱼样品进行脱水、渗透和石蜡包埋处理, 然后用病理切片机(RM2016, Leica)将包埋好的样品切片, 切片厚度为1 μm。最后将组织切片进行HE(Ehematoxylin and eosin)染色, 染色后的切片将用于常规组织学检查。
1.4 fbxo32基因在斑马鱼各个组织中表达分析
用荧光定量qRT-PCR法, 以EF1α为内参基因,检测斑马鱼fbxo32基因在不同组织中的相对表达情况。qRT-PCR所用的试剂盒为iTaqTMUniversal SYBR®Green Supermix, 进行qRT-PCR反应的仪器为StepOnePlus。PCR反应条件为: 95℃ 2 min; 95℃15s, 60℃ 30s, 72℃ 30s, 40个循环; 95℃ 15s, 60℃1min, 95℃ 15s。用2-ΔΔCt法将对应的结果与对照组结果进行比较得出相对表达量[18]。计算数据分别来自3个重复组。引物序列如表 1所示。

表1 引物序列Tab. 1 Primers list
1.5 冰冻切片原位杂交
原位杂交中合成探针所用的引物TZ-fbxo32-F和TZ-fbxo32-R的序列如表 1所示。用引物通过PCR反应合成带有SP6启动子和T7启动子的DNA,将所得DNA纯化, 再以经过纯化后DNA为模板, 用DIG RNA Labeling Kit试剂盒分别合成带地高辛(Digoxigenin)标记的反义RNA探针和正义RNA探针。成鱼肝脏组织: 各取1条野生型成鱼和纯合型成鱼的肝脏组织, 再经过4%PFA固定12—18h, 用不同浓度(25%、50%、75%和100%)的甲醇溶液(用DEPC水处理过的PBS配制)梯度脱水, 最后组织置于100%甲醇保存于-20℃备用。切片前将保存的肝脏组织取出用不同浓度甲醇梯度复水, 然后置于30%蔗糖在-4℃渗透过夜。在切片时, 用OCT包埋组织后进行冰冻切片, 切片厚度为4 μm。在切片准备完毕后, 用带地高辛标记的RNA探针进行原位杂交。具体原位杂交步骤参考之前研究采用的方法[11]。
1.6 统计学处理
荧光定量结果使用Prism 6软件处理并作图, 结果表示为平均值±SEM。用SPSS 20.0软件中的T检验进行差异显著性分析,P<0.05表示差异显著并用*标记,P<0.01表示差异极显著用**标记。
2 结果
2.1 traf6突变体肝脏组织发生病变
通过斑马鱼肝脏组织的石蜡切片及苏木精伊红染色组织学比较分析, 发现traf6突变体肝脏组织发生了明显的病理变化, 具体表现为肝脏组织结构松散零乱, 肝细胞脂肪滴稀少; 相反, 野生型肝脏组织中肝脏细胞胞体大, 排列规则, 其脂肪滴多且明显(图 1)。
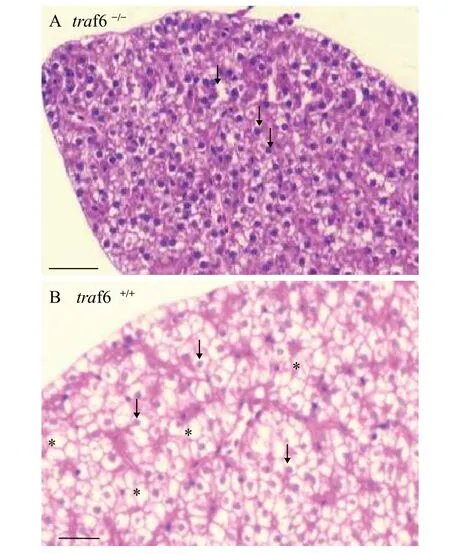
图1 traf6缺失斑马鱼肝脏组织结构异常Fig. 1 traf6 deficiency causes the abnormality of liver
2.2 斑马鱼基因的组织表达
本实验通过qRT-PCR技术分析了斑马鱼fbxo32基因在野生型斑马鱼体组织(包括肝脏、肌肉、脑、脾脏、肾脏、精巢、卵巢和肠道)的组织特异性表达分析。结果显示, 在野生型斑马鱼中,fbxo32在各个组织中都有表达, 其中在肝脏中表达量最低,在肌肉等组织中的表达量比较高(图 2)。进而, 我们比较分析了fbxo32在野生型和traf6突变体斑马鱼的肝脏和肾脏等组织中的差异表达, 结果发现fbxo32在traf6突变体斑马鱼肝脏的表达量相对其他组织来说是最高的, 并与野生型斑马鱼肝脏相比增加了近100倍(图 3)。结果暗示了traf6基因的缺失会诱导fbxo32在斑马鱼肝脏中的异常高表达。
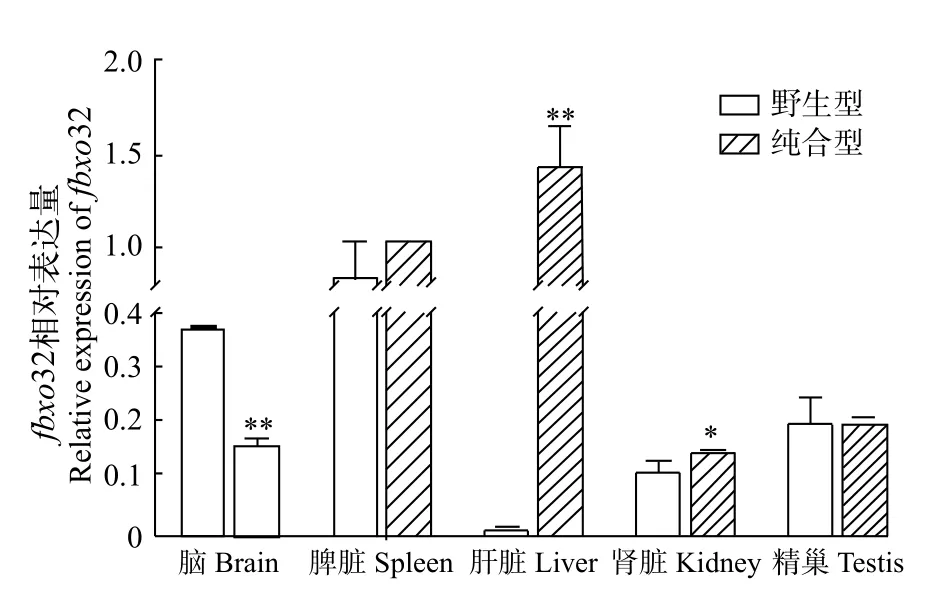
图2 fbxo32转录本在野生型斑马鱼各组织中的表达Fig. 2 The expression of fbxo32 mRNA in different tissues of wildtype zebrafish

图3 fbxo32转录本在野生型和traf6突变体斑马鱼相关组织中的表达差异Fig. 3 The differential expression of fbxo32 mRNA in different tissues between wild type and traf6 mutant zebrafish
2.3 fbxo32基因在肝脏组织中的表达
为了进一步分析fbxo32 mRNA在斑马鱼肝脏组织中的表达变化及细胞定位, 我们进行了traf6突变体及野生型斑马鱼肝脏组织的冰冻切片及fbxo32 mRNA的原位杂交分析。结果表明在traf6突变体肝脏组织中,fbxo32 mRNA杂交信号明显比野生型肝脏组织的强(图 4)。进一步结合PI染色结果分析,发现无论在traf6突变体肝脏组织还是在野生型斑马鱼肝脏组织中,fbxo32 mRNA杂交信号均特异分布在肝脏细胞中(细胞核比较圆), 而在肝脏组织中的其他细胞, 比如血细胞(细胞核长呈梭型)中就难以检测到杂交信号(图 5)。

图4 fbxo32转录本在肝脏组织中的表达水平Fig. 4 The expression level of fbxo32 mRNA in zebrafish liver tissue
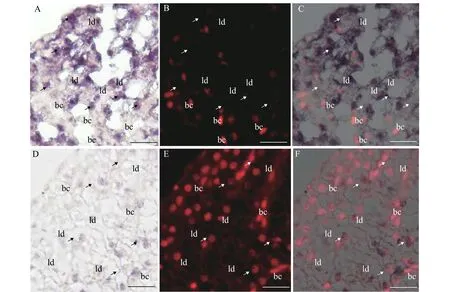
图5 fbxo32转录本在斑马鱼肝脏组织中的细胞定位Fig. 5 The cellular distribution of fbxo32 mRNA in zebrafish liver tissues
3 讨论
本研究通过荧光定量技术分析了fbxo32基因在斑马鱼不同组织中的表达情况, 结果显示,fbxo32在不同组织中都有广泛的表达, 在肌肉和卵巢组织中的表达量最高, 其次是脾脏和脑等组织。这一结果与其他物种中的fbxo32基因表达谱非常相似。比如在哺乳动物中,fbox32主要在心肌和骨骼肌细胞中表达[3], 在虹鳟[7]和大西洋鲑Salmo salar[12]中,fbxo32也是在各种组织中广泛表达, 并且相对而言,在肌肉中表达量较高。另外, 有研究报道fbxo32在卵巢癌和食管鳞状细胞癌中发生了表观遗传学沉默, 而重启fbxo32的表达则可以抑制卵巢癌细胞的增殖[13,14], 这暗示着fbxo32基因不仅在哺乳类和鱼类的肌肉和心脏中起着蛋白质降解的作用[3,7,12], 在调控动物卵巢(包括斑马鱼卵巢)的蛋白降解过程中也发挥着重要的调控作用, 而这还需要更进一步的研究来验证。
值得注意的是, 有许多文献证明了fbxo32能够将特定蛋白质底物呈递给泛素分子[2,3], 并在使其失活和对其进行标记后最终通过蛋白酶体进行降解[15]。而在哺乳动物中,fbxo32的上调能够加快与肌萎缩相关的蛋白质的分解代谢[3]。因此, 在动物中fbxo32的表达上调将会导致肌萎缩。而本研究发现, 在traf6-/-斑马鱼的肝脏中fbxo32表达量相比traf6+/+斑马鱼肝脏上调了超过100倍, 类似地, 在发生了各种萎缩症状的虹鳟、大西洋鲑和其他动物中也都观察到了fbxo32表达量的上调。另外, 与野生型斑马鱼肝脏相比,traf6突变体斑马鱼肝脏也表现出了一些肝脏萎缩的症状, 如肝脏组织结构形态不规则和松散、肝脂肪滴缺失等。综上所述, 我们可以得出结论: 斑马鱼traf6基因的缺失会导致fbxo32转录本的上调和肝脏萎缩。这个结论与在哺乳动物中的研究结果相近: 在哺乳动物中fbxo32的表达上调与骨骼肌的萎缩相关[16,17]。然而, 要探明traf6与fbxo32之间的调控机制还有待将来更深入的研究。本研究首次发现了肝萎缩中fbxo32转录本的上调, 这一发现有助于进一步开展对fbxo32基因的生理功能研究及阐明动物肝脏相关疾病发生的分子机制。
