胸段食管鳞癌日本食管协会和国际抗癌联盟分期的比较和思考
2021-09-08柳硕岩何皓王枫
柳硕岩 何皓 王枫
经历了数十年发展,国际上相继出现了多种食管癌的分期标准,目前最常用的是国际抗癌联盟(union for international cancer control,UICC)的TNM分期标准[1],日本食管协会(Japan esophageal society,JES)的TNM分期标准[2]。两个系统都由三个主要类别组成,即T、N和M,但两者之间存在较大差异。由于欧美人群的食管癌病理类型多是腺癌,而亚洲人群则是鳞癌,为此,日本食管学会亦对日本食管癌人群进行深入研究,制定了JES的TNM分期标准。对于同样是身处亚洲的中国人群而言,JES的TNM分期标准可能是更加合理的选择。由此,以下就食管癌UICC TNM分期标准(第8版)和JES TNM分期标准(第11版)进行比较,供大家参考。
一、位置的区别
UICC对肿瘤位置的界定:肿瘤的位置是根据肿瘤的中心位置确定的。而胸段食管癌按照解剖位置分为胸上段、胸中段及胸下段食管癌,其中胸上段是胸骨切迹水平至奇静脉弓下缘(相对应的是胃镜下距离门齿20~25 cm),胸中段是奇静脉弓下缘至下肺静脉下缘水平(相对应的是胃镜下距离门齿25~30 cm),胸下段是下肺静脉下缘水平至食管胃连接处以远的2 cm的胃(相对应的是胃镜下距离门齿30~42 cm)包括食管胃连接处。JES对肿瘤位置的界定:根据以下检查的优先顺序来界定的肿瘤位置:钡餐,CT和胃镜。首先是侵袭最深的部位来界定肿瘤的位置;当肿瘤跨越食管的多个部分,如果难以确定肿瘤侵袭最深的部位,则以肿瘤的中心点的位置记录为肿瘤主要位置。在多发病变的情况下,首先以侵袭最深的部位来描述肿瘤的位置。如果难以确认最深的病变部位,则描述最大的病灶的位置。胸段食管(Te):从胸骨切迹到食管裂孔的上缘。胸上段食管(Ut):从胸骨切迹到气管分叉处。胸中段食管(Mt):气管分叉和食管裂孔的上缘之间两个相等部分的近端。胸下段食管(Lt):气管分叉和食管裂孔的上缘之间的两个相等部分的远端。
总而言之,UICC的肿瘤位置是以肿瘤中心位置为准,而JES是由肿瘤侵袭最深的部位而定。在食管解剖位置方面,两者也不相同。UICC以奇静脉弓下缘作为胸上、中段的分界线,而JES则是以气管分叉为界。对于胸下段食管的解剖范围,UICC包含食管胃连接处[3],而JES把它归为腹段食管的范畴。
二、T的区别
UICC 和JES TNM分期标准在T分期方面主要的不同点在于对T1的界定和详细分类(表1)。
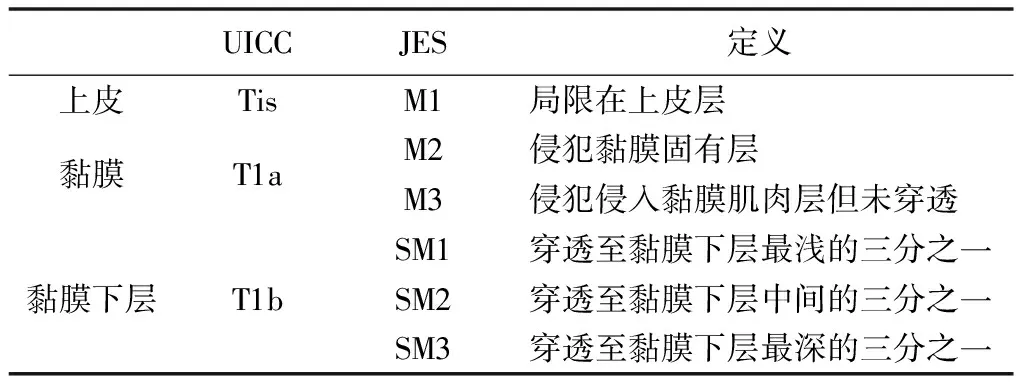
表1 UICC和JES T1的区别
UICC按照肿瘤侵犯的深度依次是Tis(局限在上皮层)、T1a(黏膜)、T1b(黏膜下层)。而JES更详细的T1肿瘤亚分类:首选分为T1a(黏膜)、T1b(黏膜下层),每个分期又细分成3个亚分期,其中局限在上皮层的食管癌,在JES中属于T1a中的M1分期。JES基于对T1病人更为深入的研究,将其更为细致的亚分期,精准分期的目的是为更精确的治疗。另外在JES标准中,当转移性淋巴结另外侵犯除食管以外的周围器官时,应将其归类为T4,并记录为“T4(转移性淋巴结数目——侵犯器官)”,细化了淋巴结结外侵犯的分期。
对于T1a(M、M2)的早期食管癌病人行内镜下治疗,已为大家所认可,但是对于浸润深度在T1a(M3)~T1b的食管鳞癌病人,尚存在争议。其实争议的焦点即是早期食管癌纵隔淋巴结转移的与否。大量研究显示,随着食管癌浸润深度增加,淋巴结转移率亦随着提高,M1、M2、M3、sM1、sM2/3期淋巴结转移率分别为0.0、5.6%、10%~27.0%、20%~53.1%、30%~56%[4-7]。本中心亦进行相关回顾性分析显示,M3淋巴结转移率为6.2%;sM1、sM2和sM3淋巴结转移率分别为20%、29.4%及 33.3%,T1b右喉返神经旁淋巴结转移率最高,达到16.4%,EI指数8.511 6[8]。由上可见,对于T1b病人区域淋巴结转移率并不低。因此,对于食管癌pT1a(M3)和pT1b的治疗,补充食管切除术仍然是ESD后的标准治疗方案。然而,放化疗是否有望成为一种替代治疗选择,学术界也进行相关研究。日本学者Tanaka等[9]回顾性分析2002年1月~2013年12月间接受ER并被诊断为pT1b(sM)的病人83例,其中,52例病人接受了额外治疗[19例手术,33例放化疗(CRT)];手术组的总生存率和无复发生存率均优于CRT组,但差异无统计学意义。为了获得更好的长期生存率,建议手术作为ER-pT1b食管癌的附加治疗;虽然CRT是一种可接受的替代方法,但应仔细确定适应证,特别是在肿瘤较大(≥40 mm)或淋巴脉管浸润的复发危险高病人还是建议首选食管切除术。Noordman等[10]认为,内镜治疗通常只适用于早期黏膜癌(T1a)的病人。但是亦有专家将早期食管鳞癌(T1a/M3~T1b)ESD后行放化疗和直接行根治性放化疗比较,结果显示,3年总生存率没有差别,但是总复发转移率、局部复发率、3度放化疗毒性反应均较低,而3年局部控制率高[11]。日本的JCOG9708临床研究提示,对于T1期的病人进行内镜下切除切除+放化疗(CRT)取得了较好的效果,4年总生存率达80.5%,同时4级不良反应也很低,高Cr比例和生存率与轻度毒性均提示针对T1的病人,内镜下切除+ CRT相对于食管切除术,在保证良好的生存基础上又保证消化道的完整性[12]。但这是一个单臂Ⅱ期临床试验,遗憾的是没有对T1进行细化亚分期;其后针对T1b的治疗,日本又发起了JCOG0502的临床研究[13],这是一个4臂的前瞻性临床研究,目前临床效果还在随访中,期待最后针对T1b的治疗有更为明确的答案。目前日本针对部分早期食管癌ESD后行放化疗可能并不亚于外科手术,这也是早期食管鳞癌治疗的一种选择。
三、N的区别
UICC 和JES TNM分期标准最大的区别就是N分期的差异性。UICC仅仅根据转移性区域淋巴结的数量来定义N分期,这在术后病理分期较为简略,而且锁骨上淋巴结是属于区域外淋巴结,换而言之,阳性的锁骨上淋巴结是属于远处转移(M1)。JES淋巴结分组解剖学标志明确,定位准确,利于术前评估、术中精准清扫及术后治疗的评估;同时不仅强调清扫的个数,也强调清扫的范围,更有利于对清扫的质控及学术研究;并根据肿瘤的主要位置将区域淋巴结分为五种不同的类型,较为复杂,锁骨上淋巴结被认为是胸段食管癌的区域淋巴结(表2)。JES中独有的第4站淋巴结是指位于第1~3组之外的淋巴结,无论是否涉及任何其他区域淋巴结组。
N分期是预后的最重要的因素之一,也是淋巴结清扫的一个指导因素,故要进行细致、精确的判断。由于目前对淋巴结转移的临床诊断率低[14-16],在影像学检查中通过计算转移淋巴结的数量来确定UICC标准中的N分期似乎并不可靠。而JES标准是通过淋巴结位置确定N分期,这可以在术前比较准确评估。
在UICC和JES系统中锁骨上淋巴结转移的定位有很大的不同。UICC推荐阳性的锁骨上淋巴结是属于远处转移(M1),被认为是根治性手术的禁忌证,故锁骨上淋巴结清扫不具有生存获益。但在11版的JES分类中,锁骨上淋巴结被归类为中上胸段食管癌的第2站淋巴结、下胸段食管癌的第3站淋巴结。日本学者认为,锁骨上淋巴结应被视为中上胸段食管癌的区域性淋巴结,而不是远处转移[17-21]。这个观点得到了一些我国和美国外科学者的支持[22-23]。本中心亦对1 156例食管癌病人进行相关研究[24],分析显示胸上段食管癌病人,锁骨上淋巴结转移率(22.4%,43/192),胸中下段食管癌病人,锁骨上淋巴结转移率(14.5%,140/964),阳性淋巴结个数≥7枚病人,锁骨上淋巴结转移率(49.2%,30/61),喉返神经旁淋巴结阳性病人,锁骨上淋巴结转移率(23.2%,44/190),将锁骨上淋巴结按照区域及M1的标准进行分期、比较后发现,将锁骨上淋巴结视为区域淋巴结可以带来更优的预后预测、疗效评估;同时我们进行相关危险因素分析,锁骨上淋巴结的关联危险因素为:胸上段食管癌、阳性淋巴结个数≥7枚、喉返神经旁淋巴结阳性,对于此类病人,我们中心的治疗策略是行食管癌三野根治术。Taniyama等[25]亦认为,喉返神经旁阳性淋巴结可作为胸段食管癌病人锁骨上淋巴结转移的指标,即使只发生单侧淋巴结转移,也应建议双侧锁骨上淋巴结清扫。因为以前没有在多中心前瞻性系列研究中对此进行过研究,为此,荷兰Hagens等[26]正在进行TIGER研究,这是一项国际观察队列研究,预计入组5000例病人,由世界著名的食管癌中心参与,目前有50个中心参与,分布在18个国家,包括欧美、亚洲等国家,将确定鳞状细胞癌和腺癌的淋巴结转移模式,淋巴结转移位置的路线图,涉及肿瘤组织学、肿瘤位置、肿瘤浸润深度、淋巴结和淋巴结转移的数量、术前诊断、新辅助治疗和生存率等。期待TIGER研究结果早日发表,明确食管癌淋巴结转移模式。
四、淋巴结清扫的区别
NCCN食管癌指南建议食管癌手术需要清扫至少15枚淋巴结,虽然对清扫强度进行数量上的界定,但对于清扫的范围和位置并未进行推荐。如果锁骨上淋巴结受累,被认为是不可切除的食管癌。JES标准中,建议食管癌淋巴结清扫需要大于术前检查中发现的淋巴结转移范围。回溯JES的发展历史[27],在1969年第一版的指南中,淋巴结分为3站,清扫要求到第2站即行D2清扫;当到了1972对JES进行第2版的修订,淋巴结就划分为4站,要求清扫到第3站即行D3清扫,这种分4站和行D3清扫的要求一直延续至今。有学者进行相关研究建议,胸段食管癌需进行D3淋巴结清扫,即完成第1~3站淋巴结清扫,包括锁骨上淋巴结清扫[18,28-30]。
锁骨上淋巴结转移在UICC中被认为是M1,但是有研究显示,锁骨上淋巴结转移的病人似乎比内脏转移的病人存活率更高[31-34]。Tachimori等[21]研究3 827例接受R0食管切除术的鳞状细胞癌病人,通过EI指数分析[疗效指数(EI)计算方法是将某个区域转移的频率(%)与该区域转移病人的5年生存率(%)相乘,然后除以10],上、中、下胸段食管鳞癌的锁骨上淋巴结转移率分别是33.4%、22.8%、17.6%,EI指数分别是14.1、9.2、5.3,认为淋巴结清扫的范围应根据肿瘤的位置进行调整,建议所有胸段食管鳞状细胞癌病人进行上纵隔清扫,锁骨上淋巴结清扫对于上段食管癌病人不可或缺,对于中段食管癌病人推荐。Tachimori等[19]报道1309例胸段食管癌病人行食管切除术(R0)和锁骨上淋巴结清扫术,其中有190例(14.5%)有锁骨上淋巴结转移,N0病人的5年生存率为73.7%,无锁骨上淋巴结转移的淋巴结阳性病人为40.4%,锁骨上淋巴结转移病人为24.1%,锁骨上淋巴结转移的预后明显差于无锁骨上淋巴结转移的病人,但也意味着24.1%的锁骨上淋巴结转移的病人因根治性手术而获得至少5年生存时间。亦有大量的研究表明,锁骨上淋巴结是胸段食管的区域淋巴结中,颈部及颈胸交界处淋巴结重要性的前移,强调清扫的重要性,并强烈推荐三野淋巴结清扫用于位于上胸段食管的食管癌,用于胸中段食管癌是可行的,但其用于下胸段食管癌的可行性尚不明确[18,20,35]。虽然在胸下段食管癌行三野淋巴结清扫还有争议,Tachimori等[21]研究表明,胸下段食管癌行三野淋巴结清扫后,颈部淋巴结转移的概率有17.6%,这组人群清扫后5年生存率仍有30%,体现了很好的清扫效能,故对胸下段食管癌病人手术如何选择,选择出适合人群进行精准的手术措施,如何在规范化基础上做到个体化治疗,给我们提出更高的要求。我们认为,我国与日本食管癌人群所属人种、病理类型等极为相似,建议采用日本JES的食管癌淋巴结清扫理念指导手术。
五、TNM分期的区别
UICC标准根据食管癌病理类型鳞癌和腺癌,分为两种TNM分期系统,根据术前术后再次进行临床(cTNM)和病理分期(pTNM),亦有独立的新辅助治疗后术后病理的ypTNM分期,分期类型复杂,不利于临床使用,可能是为了使不同分期系统中相同分期的病人的预后相似。然而,术前精准的临床分期和术后病理分期存在差异,例如,诊断为cT2N1M0 Ⅱ期的鳞状细胞癌病人,但在手术后,如果诊断准确,则该病人将被归类为pT2N1M0,ⅢA期。如果病理为腺癌,类似的肿瘤将被分类为cT1N1M0 ⅡA期,并将被升级为pT1N1M0 ⅡB期。如何理解,UICC系统中增加了组织学分类(G)的影响,这是不同于TNM的因素,G分类越高,预测淋巴结转移可能性大[36-38]。所以,在UICC系统中增加G分类的影响作用。JES标准的TNM分期系统,虽然根据不同时段将T分为c(临床)、e(内镜)、s(术中)、p(病理)及f(最终)的分期,但无论哪个分期,最终的TNM分期标准只有一个,最终化繁为简、简单明了,更利于临床实践掌握。日本学者普遍认为,至少对于发生在食管任何部位的鳞状细胞癌来说,JES系统可以更精确地表达肿瘤扩散的状态,并且可以更详细地指导确定实际的治疗策略。
六、结论
虽然JES标准在区域淋巴结的严格详细划分及清扫方面较UICC复杂,这可能导致一部分食管外科医生在淋巴结记忆及清扫方面增加困难,但是我们认为JES标准在描述胸段食管癌的位置及相应淋巴结转移区域、TNM分期临床实用性和治疗策略方面均优于UICC标准。JES根据食管的位置,划分区域淋巴结范围,并将锁骨上淋巴结包括在胸段食管癌的区域淋巴结中,这是非常重要的观点,但UICC按照转移淋巴结个数进行分层,方法简单,易记忆,易推广。我们期待UICC和JES标准能够相互融合、合二为一,成为国际统一分期标准、学术交流的通用语言,进而精准分期、预后判断及指导后续治疗。
