纳米氧化物和溶磷真菌对盆栽水稻生物量和土壤有效磷含量的影响
2021-09-08贾艳艳徐建明吴传万顾大路杨文飞杜小凤王伟中
贾艳艳,徐建明,吴传万,顾大路,杨文飞,杜小凤,王伟中,诸 俊*
(1.农业农村部 长江下游平原农业环境重点实验室,江苏 南京 210014;2.江苏省环洪泽湖生态农业生物技术重点实验室(淮阴师范学院),江苏 淮安 223300;3.江苏徐淮地区淮阴农业科学研究所,江苏 淮安 223001)
磷是作物生长必不可少的营养元素之一。植物体需要的磷主要从土壤磷库中获得。我国自19世纪70年代开始便向土壤中施入较多的磷肥,然而磷肥在农田土壤中的利用率极低。研究显示,当季施用的磷肥大部分与Ca2+、Fe3+、Al3+等结合成难溶性磷酸盐滞留在土壤中,仅8%~20%的磷被植物根系吸收利用[1,2]。因此土壤中已积累了大量的磷资源;这些磷多以无效态固定于土壤中而不能被作物吸收利用。这不仅造成了巨大的资源浪费,而且导致了严重的农业面源污染。
施入土壤后磷肥被快速固化为作物根系无法吸收的化合物是当季农田磷肥利用率低的主要原因[3]。微生物是土壤元素转化、吸收的中心,它们既是土壤有机质转化的执行者,又是植物营养元素的活性库,具有转化有机质、分解矿物和降解有毒物质的作用[4,5]。植物根际土壤酸度变化、有机酸分泌和磷酸酶释放等均有利于活化和利用土壤中的磷素资源[6,7]。大量研究表明,土壤中部分溶磷细菌和解磷真菌能够分泌胞外磷酸酶和有机酸类来催化难溶性磷酸盐溶解,从而可以提高植物根系表面原生磷的可获得性[6,8]。从植物根际土壤筛选得到的溶磷微生物主要包括细菌、真菌和放线菌。虽然溶磷真菌的数量和种类远少于溶磷细菌,但其溶磷能力普遍高于溶磷细菌,并具有较强的溶磷遗传稳定性[9,10]。目前已研究报道的溶解难溶无机磷能力较强的真菌主要有曲霉属(Aspergillus)和青霉属(Penicillium)真菌[11]。
随着纳米科技的快速发展,纳米材料在农作物养分吸收方面的应用研究也越来越受到关注。研究发现纳米氧化物颗粒作为辅酶因子,能刺激根际微生物酶的分泌,改变植物根际磷的利用率[12,13]。譬如在干旱条件下纳米ZnO改良剂能够促进高粱对土壤磷素的吸收,从而提高高粱的产量[14];在小麦幼苗期施用纳米CuO和ZnO颗粒,能够刺激小麦根毛增殖和侧根形成,增加根系对氮、磷等养分的吸收[15]。Raliya等[13](2016)研究显示作物绿豆施用纳米ZnO后根系土壤磷酸酶、植酸酶的活性显著增加,绿豆的磷素吸收量增加了10.8%。此外,在溶磷真菌与纳米TiO2共同作用下绿豆根际微生物数量以及与磷素循环相关的土壤胞外酶的活性均显著提高,绿豆的叶蛋白、叶绿素含量等物候学指标也得到改善[16]。目前纳米颗粒对水稻根系吸收磷素的改善作用还缺乏深入研究。
本试验选取纳米ZnO和纳米TiO2两种典型金属氧化物纳米材料为研究对象,以实验室常用的两种曲霉属溶磷真菌为试验菌株,通过培养基培养和盆栽方法研究了不同浓度、不同粒径纳米ZnO、纳米TiO2与溶磷真菌共同作用对培养基滤液有效磷含量、水稻生物量、土壤磷酸酶活性和土壤磷素含量的影响,旨在为稻田土壤磷素的转化和可利用率的提高提供理论依据和技术支持。
1 材料与方法
1.1 供试菌株及纳米材料
本试验所用纳米ZnO为30、200 nm两种粒径材料,纳米TiO2为15、30 nm两种粒径材料,均购于阿拉丁试剂有限公司(含量≥ 99.5%)。试验用菌株为烟曲霉AspergillusfumigatusL. 和黄曲霉AspergillusflavusL.,购自中国普通微生物菌种保藏管理中心。使用PDA培养基扩繁菌株直至其产生孢子,制备成浓度为1×108CFU/mL的孢子菌悬液。
1.2 在纳米颗粒影响下溶磷真菌对难溶性磷酸盐的溶解能力试验
试验采用难溶性磷酸盐液体培养基:葡萄糖10 g、MgSO4·7H2O 10.3 g、FeSO4·7H2O 0.03 g、MnSO4·H2O 0.03 g、NaCl 0.3 g、KCl 0.3 g、(NH4)2SO40.5 g、难溶性磷酸盐5 g、1 L蒸馏水,调整pH值为6.0~6.2,在121 ℃下湿热灭菌30 min,分装到锥形瓶中备用。在上述培养基中难溶性磷酸盐为等量的磷酸钙、磷酸铝、磷酸锌和磷酸铁的混合物。
纳米颗粒添加试验共设置10、100、500 mg/L三种浓度,以不添加纳米颗粒为对照,总计13个处理(3种浓度处理×4种纳米粒径处理+1个无纳米颗粒对照):无纳米颗粒对照CK-0;30 nm粒径纳米ZnO 10、100、500 mg/L处理(纳米ZnO 30-10、30-100、30-500);200 nm粒径纳米ZnO 10、100、500 mg/L处理(纳米ZnO 200-10、200-100、200-500);15 nm粒径纳米TiO210、100、500 mg/L处理(纳米TiO215-10、15-100、15-500);30 nm粒径纳米TiO210、100、500 mg/L处理(纳米TiO230-10、30-100、30-500)。将各个粒径的纳米ZnO和纳米TiO2按照设置的浓度分别加入到装有难溶性磷酸盐培养基的锥形瓶中,超声波震荡15 min,混匀。
分别取两种菌株的部分孢子菌悬液,在121 ℃下湿热灭菌30 min,制成灭活菌液。按照5%的接种量将烟曲霉A.fumigatus、黄曲霉A.flavus菌株的孢子悬液以及灭活菌液分别接入到含有不同粒径、不同浓度纳米颗粒的培养基中,同时设不接菌对照CK。每个处理4次重复,所有处理在28 ℃、150 r/min下振荡培养5 d。在培养结束后,将培养液以8000 r/min的转速离心15 min,然后采用钼锑抗比色法测定上清液中有效磷的含量。
1.3 在纳米颗粒影响下真菌的土壤溶磷效果及促生效果试验
试验采取室内盆栽的方法进行,盆栽用土采集自江苏徐淮地区淮阴农业科学研究所现代农业高新科技园创新基地稻田(119°1′26.43″E,33°31′26.55″N)。土壤类型为沙壤土,土壤(0~20 cm)有机质含量为12.78 g/kg,全氮含量为1.14 g/kg,有效磷含量为6.82 mg/kg, pH 6.9。将采集的土壤过2 mm筛,风干后在121 ℃下湿热灭菌2 h。所用塑料盆规格为20 cm口径×25 cm高,每盆装入5 kg灭菌土;将供试的难溶性磷酸盐按照1 g/kg的用量与土充分混匀,难溶性磷酸盐为等量的磷酸钙、磷酸铝、磷酸锌和磷酸铁的混合物。
根据1.2节的实验结果筛选出最优纳米颗粒与菌株组合,设置空白对照、单独接菌处理、单独添加纳米颗粒处理、接菌同时添加纳米颗粒处理以及接灭活菌株同时添加纳米颗粒处理,每个处理4次重复。按照10 mL/kg的用量将无菌水制备的菌株孢子悬液(1×108CFU/mL)均匀施加到盆栽土壤中,采用逐层添加法[17]进行纳米颗粒添加处理。供试水稻品种为‘水旱两优898’,在播种前使用10% H2O2表面消毒10 min,并用去离子水浸泡3 h,以每盆5粒的种子量进行播种,在出苗后定苗1株。所有盆栽水稻植株在培养60 d后收获,测量水稻地上和地下生物量。同时测定土样中有效磷的含量和磷酸酶活性。磷酸酶单位酶活力(IU)定义为1 g土样每小时分解产生1 mg P2O5所需的酶量[18]。
室内实验在江苏徐淮地区淮阴农业科学研究所作调中心实验室进行,所用溶液和化学试剂均为国药分析纯。
1.4 数据处理
采用SPSS软件对试验数据进行统计分析;在5%水平下用LSD Duncan法检验各处理平均值之间的差异显著性。
2 结果与分析
2.1 在纳米ZnO影响下真菌的溶磷效果
表1数据显示,总体来看,除了无纳米颗粒对照CK-0外,在两种接菌处理下难溶性磷酸盐培养基滤液中有效磷含量均显著高于接种灭活菌株处理;接种烟曲霉菌剂A.fumigatus处理的有效磷含量普遍大于接种黄曲霉菌剂A.flavus的。接种A.fumigatus时纳米ZnO 30-10、200-10和200-100处理下滤液中有效磷含量均显著大于CK-0和CK的,而纳米ZnO 30-500和200-500处理的则显著低于CK-0的(P<0.05)。接种A.flavus时纳米ZnO 30-10、30-100和200-10处理下滤液中有效磷含量均显著大于CK-0和CK的;纳米ZnO 30-500和200-500处理下的有效磷含量均显著低于CK-0的。在纳米ZnO 30-10+接种A.fumigatus处理下滤液中有效磷含量最高(180.37 mg/L),显著高于其他处理组的,说明30 nm粒径纳米ZnO在10 mg/kg浓度添加下与菌株A.fumigatus一起培养时产生的有效磷量最多。
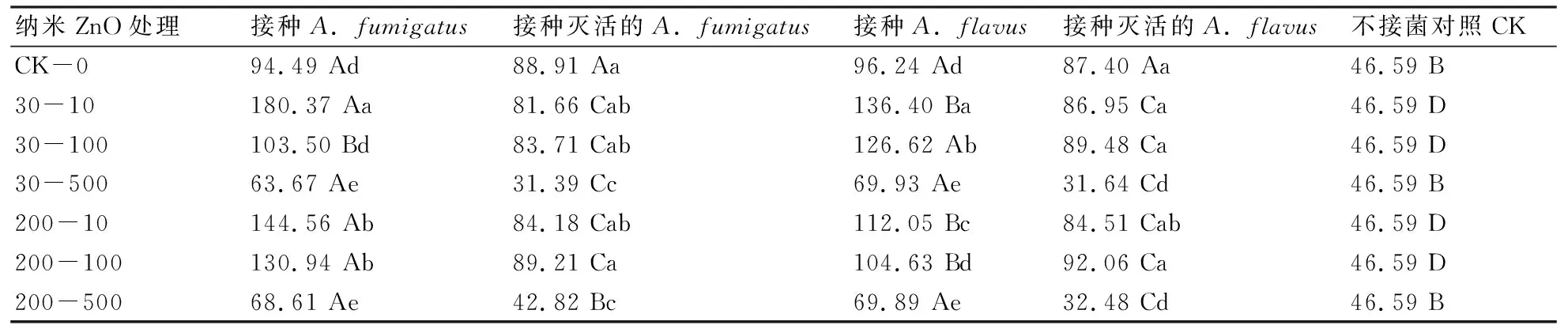
表1 接种菌剂和纳米ZnO添加处理下难溶性磷酸盐培养基滤液中有效磷含量 mg/L
2.2 在纳米TiO2影响下真菌的溶磷效果
从表2可以看出:在添加纳米TiO2影响下,接种两种菌剂处理的培养基滤液中有效磷含量显著高于相对应的接种灭活菌株处理和CK的,说明两种菌剂的溶磷效果较好;在添加纳米TiO2影响下,接种黄曲霉菌剂A.flavus处理的有效磷含量普遍大于接种烟曲霉菌剂A.fumigatus的,说明纳米TiO2与A.flavus组合培养的溶磷效果较好;在接种A.fumigatus时,纳米TiO2仅在30-100处理时滤液有效磷含量显著大于CK-0的;在接种A.flavus时,纳米TiO215-100和30-100处理下滤液中有效磷含量均显著大于CK-0和CK的,其中15-100处理组的有效磷含量最高,达到142.19 mg/L,显著高于其他处理组的(P<0.05)。

表2 接种菌剂和纳米TiO2添加处理下难溶性磷酸盐培养基滤液中有效磷含量 mg/L
2.3 接种菌剂和添加纳米颗粒对土壤磷酸酶活性、土壤有效磷含量和水稻生物量的影响
土壤磷酸酶的主要功能是水解有机质中的磷脂键,从而将无机磷酸盐从有机质中水解释放到土壤中,其活性高低直接影响土壤中有机磷的分解转化及其生物有效性。由表3可知:纳米ZnO 30-10+A.fumigatus处理和单独接种A.fumigatus处理中土壤磷酸酶的活性显著高于CK和纳米ZnO 30-10处理的;与CK相比,纳米ZnO 30-10+A.fumigatus处理的土壤有效磷含量和磷酸酶活性分别显著增加了35.83%、35.47%;接种A.fumigatus处理以及纳米ZnO 30-10+A.fumigatus处理的土壤磷酸酶活性均显著高于对照的;但盆栽水稻的地上生物量在各个处理之间无显著差异;与CK相比,在纳米ZnO 30-10+A.fumigatus处理下水稻的地下生物量显著增加了52.32%。说明以10 mg/kg的剂量添加30 nm粒径的纳米ZnO配合接种菌剂A.fumigatus可以提高土壤磷酸酶的活性,从而增加盆栽水稻的地下生物量。

表3 接种菌剂和添加纳米ZnO处理下土壤有效磷含量、磷酸酶活性和水稻生物量
3 讨论与结论
近年来,纳米颗粒在农业上的应用越来越多,已有多种工程纳米颗粒被用于农药、杀虫剂以及农业新型肥料[19-21]。本试验研究了将30、200 nm粒径纳米ZnO和15、30 nm粒径纳米TiO2以10、100和500 mg/kg的剂量添加到培养基中对黄曲霉和烟曲霉溶磷效果的影响,发现纳米ZnO在10 mg/kg、TiO2在100 mg/kg浓度下能够显著促进两种曲霉属真菌的溶磷效果;其中添加10 mg/kg 30 nm粒径的纳米ZnO+接种A.fumigatus处理的溶磷效果最好,盆栽水稻土壤中的磷酸酶活性增加了35.47%。据Raliya等[13](2016)报道,对作物绿豆施用10 mg/L纳米ZnO后,根系土壤磷酸酶活性提高了84%,绿豆的磷素吸收量增加了10.8%;该团队推测,纳米颗粒能够促进根系对磷素的吸收,可能是因为纳米氧化物颗粒作为辅酶因子刺激了与作物根系周围磷素反应相关的微生物分解酶的分泌,将土壤中复杂形式的磷分解成植物能吸收的形式[13,16]。Zahra等研究了纳米TiO2对生菜、水稻和小麦根际土壤磷素的影响,指出:除了作为辅酶因子外,金属纳米颗粒对磷离子的吸附作用也可引起磷化作用的改变;根际纳米颗粒的适应力可能也对增强根系溶磷酶的分泌和酸化有促进作用;所有这些变化都导致了植物根系磷素的可用性和根系吸收磷素能力的提高[12,22-25]。可见利用金属纳米颗粒作为辅助剂有望提高作物根系对土壤磷素的吸收与利用。因此纳米ZnO、纳米TiO2等金属纳米颗粒与水稻根际溶磷微生物、土壤溶磷酶活性以及土壤磷素转化之间的关系值得深入探讨。
Itroutwar等[26](2019)报道了生物ZnO纳米粒子能够改善水稻的外部形态特征。尹勇等[27](2019)的研究显示500 mg/kg纳米ZnO处理后水稻幼苗的鲜重、干重和株高分别增加了24.95%、12.42%和9.71%。Yang等[28](2015)的研究表明纳米ZnO的植物毒性作用表现为浓度依赖性,其2000 mg/L的浓度能够显著抑制玉米和水稻根系的伸长。本研究发现30 nm粒径纳米ZnO在10 mg/kg浓度下显著促进了水稻地下生物量,在500 mg/kg浓度下对真菌生长产生了抑制作用,显著降低了培养基中有效磷的含量。多项研究数据显示,金属纳米颗粒进入环境后会受其中各种固相和液相成分的影响而发生氧化还原等反应,其溶解性、沉降性等特性会发生变化,其持久性、反应活性以及毒性效应从而会改变[29]。土壤环境中的pH强度、离子强度、有机质组成及含量、粘土含量及矿物质(P、K、Mg、S)均会对纳米颗粒的环境行为造成影响[17,30,31]。因此,随着应用与产量的日益增多,在纳米科技合理农用的同时,纳米颗粒的环境暴露与生态风险问题也不容忽视。
综上所述,纳米ZnO在10 mg/kg浓度水平与烟曲霉菌株A.fumigatus一起施用,可促进土壤磷酸酶活性,提高盆栽水稻地下生物量。我们下一步的研究拟将纳米颗粒与溶磷真菌应用于水稻磷肥减施方向,在保障纳米颗粒环境安全的同时调节磷肥的使用量。
