丙酸氟替卡松雾化吸入用混悬液体外溶出方法的建立
2021-09-07沈莹卢望丁
沈莹 卢望丁
摘 要 本项研究目的为开发体外溶出方法应用于丙酸氟替卡松雾化吸入用混悬液体的评价。实验结果表明,采用目前开发的体外溶出方法评价自研和原研产品时,其溶出行为一致。
关键词 吸入 混悬液 体外溶出
中图分类号:R927.11; R977.11 文献标志码:A 文章编号:1006-1533(2021)15-0075-04
The establishment of an in vitro dissolution method for the evaluation of fluticasone propionate inhalation suspension
SHEN Ying, LU Wangding
(Shanghai Chenpon Pharmaceutical Co., Ltd., Shanghai 201210, China)
ABSTRACT The purpose of this research was to establish an in vitro dissolution method for the evaluation of fluticasone propionate inhalation suspension. The results showed that the dissolution behavior of the self-made product was consistent with the reference listed product when the established method was used for the evaluation of their in vitro dissolution.
KEY WORDS inhalation; suspension; in vitro dissolution
在口服固体制剂产品的开发过程中,有效的体外溶出方法可以用于药品批件一致性的质量控制和预测体内释放行为。通常可以建立体外溶出数据和体内药代动力学的相关性[1]。目前,口服吸入制剂的溶出度实验没有监管要求或药典要求。即使2008年,USP的吸入制剂顾问小组根据吸入剂型体外溶出实验的科学依据得出没有充分的证据表明溶出实验在批准口服吸入制剂的药动学或临床方面的重要性,工业界和学术界对开发吸入制剂的体外溶出方法仍有相当大的兴趣[2]。
吸入制剂溶出方法的开发中,溶出度数据和药物动力学、药效学和/或其他临床数据之间关系的性质和相关度尚未得到确认。它们可能是产品和患者特异性的,即取决于吸入操作、吸气流量、目标人群中肺部的情况、治疗状况(例如,哮喘与慢性肺阻塞),疾病状态(中度与严重)等[3]。人体的肺部分为中心区域和周边区域,不同区域的生理结构的不同会影响药物活性成分(active pharmaceutical ingredients,API)沉积后的体内过程。如果API沉积在肺部导入区域,肺部自身的排异清除功能会排出长期停留在该部位的粒子;沉积在肺部呼吸区域,长期沉积的粒子会被巨噬细胞所吞噬[4]。因此,API沉积的部位以及API的溶出过程会影响体内血药行为。本实验以Apparatus-V桨碟法作为溶出模型,采用新一代药用撞击器接收第4级的微细粒子,对自研和原研产品的溶出行为进行评价[5]。开发测定吸入混悬剂的溶出方法,评价且对比自研和原研丙酸氟替卡松雾化吸入用混悬液产品的溶出行為。
1 材料与方法
1.1 材料
丙酸氟替卡松雾化吸入用混悬液自研产品(批号11918006,上海臣邦医药科技股份有限公司);丙酸氟替卡松雾化吸入用混悬液原研产品(商品名:辅舒酮,批号GM6695,葛兰素史克公司);丙酸氟替卡松原料药(浙江澳锐特公司)。
1.2 仪器
Ultimate 3000高效液相色谱仪(美国赛默飞世尔科技);Agilent 708-DS溶出度仪(美国安捷伦公司);Model 170新一代药用撞击器(英国Coply公司);CPA225D/ME403E电子天平、FE20酸度计(瑞士梅特勒-托利多集团);Sigma 1-16/F-114离心机(西格玛公司);Hypersil BDS C18色谱柱(4.6 mm×150 mm,3 mm,德国默克公司)。
1.3 实验步骤
1.3.1 溶出介质的配制
建立溶出方法的过程中,需要筛选合适的溶出介质。由于丙酸氟替卡松溶解度极低[6],为保证溶出过程中的漏槽条件,在筛选介质中加入十二烷基硫酸钠(SDS)增加介质的溶解度;同时还将模拟肺液作为筛选的溶出介质。
1)SDS磷酸盐缓冲液 分别称取SDS0.15或0.75 g至烧杯中,各加磷酸盐缓冲液(0.1 mol/L,pH 7.4)150 mL,超声30 min,即得质量浓度为1或5 mg/mL SDS磷酸盐缓冲液。
2)模拟肺液 称取磷酸二氢钾2.04 g至烧杯中,加0.1 mol/L氢氧化钠溶液118.5 mL,用水稀释至300 mL,加1.2 g卵磷脂和4.5 g环氧乙烷,搅拌均匀,超声30 min,即得。
1.3.2 丙酸氟替卡松在不同介质中溶解度的测定
1)在SDS磷酸盐缓冲液介质中 称取丙酸氟替卡松原料药0.2 g至20 mL容瓶中,加1或5 mg/mL SDS磷酸盐缓冲液定容至刻度,涡旋5 min,超声30 min(控制水温37 ℃),放入摇床振摇48 h(37 ℃,150 r/min)。振摇结束后,于1 000 r/min离心10 min,取上清液3 mL,继续离心10 min;取上清液1 mL于5 mL量瓶中,用1或5 mg/mL SDS磷酸盐缓冲液定容至刻度。平行配制6份样品,测定后取平均值。
2)在模拟肺液介质中 称取丙酸氟替卡松原料药0.02 g至20 mL容量瓶中,加模拟肺液定容至刻度,处理方式同上,平行配制6份样品。
1.3.3 雾化后丙酸氟替卡松样品收集及溶出试验
根据自研产品空气动力学粒径分布测定值,雾化后在药用撞击器中第四级(S4)收集的粒子总量为各级盘中收集比例的最高值。因此,将S4收集的粒子作为溶出样品。具体制备步骤如下:
1)在药用撞击器S4下中加入滤纸。
2)将组装好的撞击器与L型连接管在冷却装置(5℃)中预冷至少90 min。
3)连接真空泵,调节气流速度为15 L/min。
4)取丙酸氟替卡松1支,摇匀后,倒入雾化杯中,连接新一代药用撞击器、适配器与雾化杯。开启真空泵,30 s后开启雾化器,持续雾化5 min。
5)关闭雾化器,30 s后关闭真空泵。
6)拆除撞击器,将S4级滤纸取出,用吹风机吹干后,重新放入新的收集盘中;第二、第三、第四支样品,同第一支操作;雾化5 min后,拆除撞击器。将滤纸吹干后,置于不锈钢网碟中,作为溶出评价样品。
7)照溶出度与释放度测定方法(中国药典2015年版四部通则0931第四法),以含5 mg/mL SDS磷酸盐缓冲液作为溶出介质,设定转速为50 r/min,依法操作。
8) 于5、10、15、30、60、120、180、240 min时间点各取样6 mL作为供试品溶液,每次取样后补液。
9) 将供试品溶液离心(15 000 r/min,6 min),取上清液作为待测溶液。
10)实验结束后,将网碟取出,用稀释剂清洗滤纸,并超声10 min,定容至50 mL作为待测溶液。
1.3.4 丙酸氟替卡松含量测定
丙酸氟替卡松含量测定采用高效液相色谱(HPLC)法。采用Hypersil BDS C18色谱柱,柱温40 ℃,进样体积50 μL,流速1.0 mL/min, 检测波长239 nm,运行时间10 min。
2 结果
2.1 丙酸氟替卡松在不同介质中的溶解度
丙酸氟替卡松在质量浓度为1和5 mg/mL SDS磷酸盐缓冲液及模拟肺液中的溶解度分别为(1.30±0.26)、(11.78 ± 0.03)、(0.39± 0.11)mg/mL。为保证溶出过程中的漏槽条件,故采用5 mg/mL SDS磷酸盐缓冲液作为溶出介质。
2.2 丙酸氟替卡松雾化样品收集
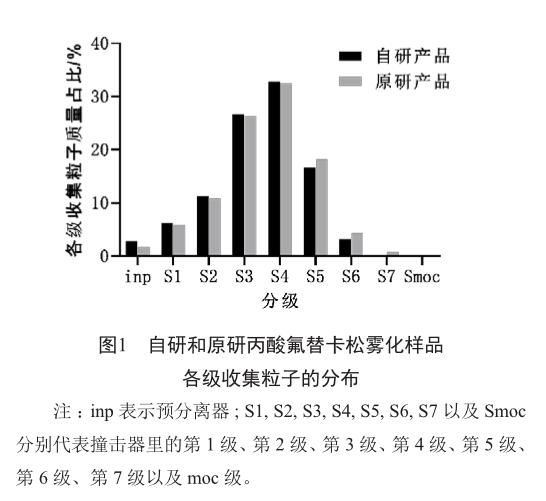
根据自研和原研产品空气动力学粒径分布测定值,雾化后在药用撞击器中收集的各级粒子的分布如图1所示,S4收集粒子的总量占进入撞击器总量的30%以上,为各级收集粒子比例的最高值,且S4收集粒子的空气动力学粒径范围为3.30~5.39 μm。因此,将S4收集的粒子作为溶出样品。
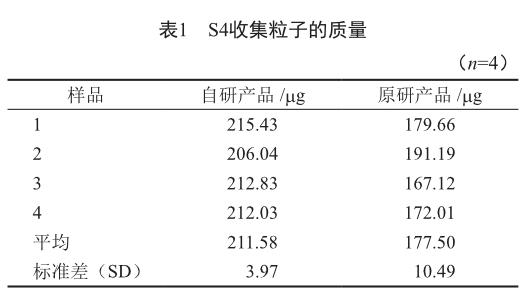
2.3 原研与自研产品S4收集的量
为分别考察原研与自研产品的S4收集粒子质量的重现性,各重复雾化4次后测定,结果显示,在药用撞击器中S4收集粒子的质量有较好的重现性(表1)。
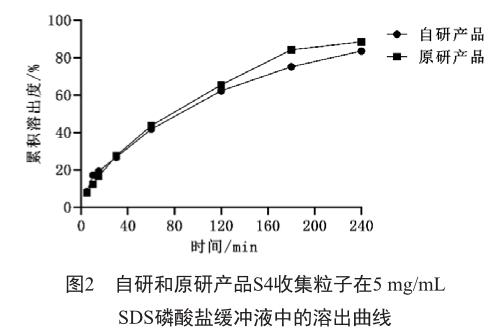
2.4 自研和原研产品溶出曲线对比
对比结果表明,自研和原研产品的S4收集粒子在5 mg/mL SDS磷酸盐缓冲液中溶出行为一致(图2)。
3 讨论
选择药用撞擊器的S4收集微细粒子基于以下考虑:①S4截止粒径在3.30~5.39 μm, 属于微细粒子剂量的一部分,即体外表征体内进入肺部的粒子;②自研和原研样品S4收集粒子相对其他级别收集的量更大,有利于降低实验操作误差。因此,基于粒子体内沉积以及可操作性两点考虑,选择S4收集的粒子作为溶出评价样品。由于S4一次收集的粒子量仅为约200 μg,考虑到尽量降低检测的相对误差,采取一次重复收集4个样品作为溶出评价样品。同时,由于撞击器收集样品后,滤纸会被润湿且过饱和,因此每次收集之间均要吹干。由于丙酸氟替卡松为极难溶物质,雾化后API已呈颗粒状态而非分子状态被滤纸收集,因此在吹干过程中,API不会析晶,且不会影响溶出行为。
由于药用撞击器试样本有的误差,S4收集的粒子并非固定值。溶出实验开始时S4收集的粒子量未知。因此,溶出实验结束后,通过累计加合各部份的丙酸氟替卡松计算得到S4收集的粒子中API总量,即溶出评价样品的API总量。计算各时间点溶出量与样品API总量的比值,从而得出溶出曲线。
虽然自研和原研产品的S4收集粒子在5 mg/mL SDS磷酸盐缓冲液中溶出行为一致,但丙酸氟替卡松在模拟肺液中的溶解度极低[(0.39± 0.11)μg/mL],故采用Apparatus-V桨碟法并非最佳溶出模型。后期可考察加快转速或者采用其他溶出模型进行评价。
参考文献
[1] Riley T, Christopher D, Arp J, et al. Challenges with developing in vitro dissolution tests for orally inhaled products (OIPs)[J]. AAPS PharmSciTech, 2012, 13(3): 978-989.
[2] Gray VA, Hickey AJ, Balmer P, et al. The inhalation Ad Hoc Advisory Panel for the USP performance tests of inhalation dosage forms[EB/OL]. [2021-03-07]. https://www. researchgate.net/profile/Neal-Davies/publication/237379078_ The_Inhalation_Ad_Hoc_Advisory_Panel_for_the_ USP_Performance_Tests_of_Inhalation_Dosage_Forms/ links/5460ea060cf27487b4526592/The-Inhalation-AdHoc-Advisory-Panel-for-the-USP-Performance-Tests-ofInhalation-Dosage-Forms.pdf.
[3] Floroiu A, Klein M, Kr?mer J, et al. Towards standardized dissolution techniques for in vitro performance testing of dry powder inhalers[EB/OL]. [2021-03-07]. http://dissolutiontech. com/issues/201808/DT201808_A01.pdf.
[4] Eriksson J, Th?rn H, Sj?gren E, et al. Pulmonary dissolution of poorly soluble compounds studied in an ex vivo rat lung model[J]. Mol Pharm, 2019, 16(7): 3053-3064.
[5] May S, Jensen B, Wolkenhauer M, et al. Dissolution techniques for in vitro testing of dry powders for inhalation[J]. Pharm Res, 2012, 29(8): 2157-2566.
[6] Edsb?cker S, Wollmer P, Selroos O, et al. Do airway clearance mechanisms influence the local and systemic effects of inhaled corticosteroids?[J]. Pulm Pharmacol Ther, 2008, 21(2): 247-258.
