青海沙地白刺根际解淀粉芽孢杆菌DGL1的牧草促生活性及其基因组分析
2021-09-07谢永丽吴晓晖青丽婷陈海龙
杨 雪, 谢永丽*, 陈 兰, 吴晓晖, 王 添, 青丽婷, 陈海龙
(1.青海大学省部共建三江源生态与高原农牧业国家重点实验室, 青海 西宁 810016;2.青海省青藏高原优良牧草种质资源利用重点实验室, 青海 西宁 810016)
极端生境芽孢杆菌资源因具有较高耐逆性、对环境友好等优点,近年来受到了广泛的关注[1],有益芽孢杆菌属可通过拮抗作用,与病原菌竞争生态位,诱导植物产生抗病效应,通过产生有益代谢物及溶菌作用等途径发挥对植物的防病促生作用,成为了生物防治病害的研究热点[2-4]。
青海高原位于世界屋脊,地处低温、缺氧、强紫外线照射的环境,由于极端环境的限制,草地生态环境相对脆弱,该地区牧草具有生长期短、产草量低等特点。草原超载放牧,病、虫、鼠害侵袭,进一步加剧天然草地退化[5-8]。芽孢杆菌作为新型绿色环保肥料,能够促进植物生长,将其应用于退化草地的修复,具有广阔的应用前景。吴晓晖等[9]报道解淀粉芽孢杆菌KKLW1具有显著促高原牧草梭罗草(Roegneriathoroldiana)生长的活性,其种子萌发率和幼苗根长分别提高了8%和12%。芽孢杆菌促生机制是多方面的。部分芽孢杆菌具有固氮活性,能够固定并为植物供应氮素,促进植物生长发育,改善土壤环境,提高作物产量。王楠等[10]报道称,具有固氮活性的芽孢杆菌BJ-18对番茄(Lycopersiconesculentum)幼苗具有显著的促生作用。芽孢杆菌可以通过非核糖体合成途径合成脂肽类物质泛革素(Fengycin)、表面活性素(Surfactin)和伊枯草菌素(Iturin)[11],还可通过核糖体途径合成肽类物质枯草菌素[12],这些抗生素对水稻条斑病(Xanthomonasoryzae)[13]、小麦全蚀病菌(Gaeumannomycesgraminis)[14]、黄瓜霜霉病菌(Pseudoperonosporacubensis)[15]等多种病菌具有较强的抑菌活性。此外,青海作物秸秆资源缺乏充分的利用,造成极大的浪费。筛选出适应高原生境的、具有降解纤维素活性的芽孢杆菌菌株,应用于秸秆还田或牧草微贮,可提高多糖降解[16]及转化率、饲料利用率,促进家畜胃肠道消化吸收[17],抑制有害微生物的生长[18],因此筛选具有降解纤维素活性的芽孢杆菌在农业生产中具有一定的应用潜力。
随着高通量测序的不断发展,微生物基因组技术可从分子水平了解其基因组的结构、功能、调控机制,为微生物在农牧业、医疗、卫生等领域的应用研究提供新的理论基础[19]。本实验室前期对青海省海西州高寒草原、盐碱地、湿地、荒漠沙地、荒漠、盐湖等多个典型生境进行采样,从分离的千余株芽孢杆菌中筛选具有抑菌促生活性的菌株,其中分离自大格勒干旱沙地白刺(N.tangutorum)根围的解淀粉芽孢杆菌DGL1表现出良好的生物活性。本研究对菌株DGL1进行拮抗活性、降解纤维素活性测定、固氮活性,及促高原牧草燕麦(Avenasativa)、冷地早熟禾(Poacrymophila)、紫羊茅(Festucarubra)、中华羊茅(Festucasinensis)生长活性的研究,并利用二代测序技术对菌株DGL1的基因组进行测序,对其编码基因进行功能注释,同时对菌株的固氮、降解纤维素、抑菌的关键基因进行挖掘,以期为揭示菌株DGL1促生抗菌机制及进一步研发提供理论基础。
1 材料与方法
1.1 试验材料
供试菌株:解淀粉芽孢杆菌DGL1分离自青海海西州大格勒干旱沙地白刺根围(海拔3 010 m,东经95°45′,北纬36°45′)。
病原指示菌:瓜类枯萎病菌(F.oxysporum)、锐顶镰孢病菌(F.acuminatum)、小麦赤霉菌(F.graminearum)由青海大学高原草地资源与生态省部共建实验室保存。
牧草草种:燕麦(A.sativa)、冷地早熟禾(P.crymophila)、紫羊茅(F.rubra)、中华羊茅(F.sinensis)由青海省青藏高原优良牧草种质资源利用重点实验室提供。
改良阿须贝无氮液体培养基:葡萄糖10.0 g,K2HP040.2 g,NaCl 0.2 g,CaCO35 g,MgSO4·7H2O 0.2 g,蒸馏水1 000 mL。
培养基:LB (Luria-bertani)培养基用于芽孢杆菌的活化及培养[20];马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基用于病原真菌的培养[21];改良阿须贝(Ashby)无氮液体培养基用于芽孢杆菌固氮能力检测[22];羧甲基纤维素钠(Carboxymethylcellulose sodium fluid medium,CMC)培养基用于芽孢杆菌降解纤维素活性检测[23]。
1.2 拮抗病原真菌活性能力的测定
将病原真菌瓜类枯萎病菌、锐顶镰孢病菌、小麦赤霉菌活化后打菌碟,分别接种于PDA平板上,在平板等距离对称的点上,放上直径4 mm的滤纸片,吸取活化的DGL1菌液5 μL点于滤纸片中央,重复3次,置于25℃条件下培养5 d后,取出观测并记录抑菌圈直径[24]。
1.3 降解纤维素活性测定
在CMC筛选培养基平板上,在平板等距离对称的4个点上,放置直径4 mm的滤纸片,将菌株DGL1接种在LB液体培养基中,37℃,200 r·min-1过夜培养12 h,取待测菌液5 μL点于滤纸片中央,每个处理重复3次,37℃培养2 d后,将Gram碘染液注入平板表面,盖上皿盖,静置4 min后倒去染液,计算透明圈直径与菌落直径的比值A,A越大说明降解纤维素活性越大[25]。
1.4 菌株固氮能力测定
挑取活化的芽孢杆菌菌株DGL1转接到10 mL改良阿须贝(Ashby)无氮液体培养中,37℃,200 r·min-1条件下培养5 d后,取出菌液与对照进行比较,观察菌株在无氮培养基中的活化程度[26]。
1.5 芽孢杆菌促牧草植物生活性测定
1.5.1芽孢杆菌菌悬液制备 用接种环蘸取少量—80℃保存的菌株DGL1的菌液在LB固体平板上划线,37℃恒温培养过夜,待LB平板上长出单菌落后,挑取单菌落接种于盛有20 ml LB液体培养基的三角瓶中,37℃,200 r·min-1条件下培养12 h,将培养好的菌液离心取菌体,用无菌水悬浮,菌液浓度调整至106cfu·mL-1,制备成芽孢杆菌菌悬液[27]。
1.5.2菌液DGL1促牧草种子萌发试验 选择种皮完好的燕麦、冷地早熟禾、紫羊茅、中华羊茅种子于20%次氯酸钠溶液中消毒处理后,将4种牧草种子在DGL1菌悬液中浸种(菌悬液浓度为106cfu·mL-1)2 h,无菌水处理作对照。将浸种后的种子放于无菌培养皿中,置于光照培养箱中培养(28℃,光周期16 h/8 h),每天按时定量补足水分,培养7 d后测量燕麦(每一重复20粒种子),冷地早熟禾(每一重复50粒种子),紫羊茅(每一重复50粒种子),中华羊茅(每一重复50粒种子)种子的萌发情况、芽长和根长,每个处理3个重复,统计菌株DGL1对4种牧草种子的促萌发效果。
1.5.3菌液DGL1促幼苗生长试验 选择种皮完好的燕麦、冷地早熟禾、紫羊茅、中华羊茅种子于20%次氯酸钠溶液中消毒处理后,将4种牧草种子在DGL1菌悬液(菌液浓度为106cfu·mL-1)处理种子2 h,无菌水处理作对照。将种子(15株/盆)播于穴盆中,在光照培养箱中培养(27℃,光周期16 h/8 h)。定时定量补足水分,培养20 d后测量燕麦(30 株·盆-1)、冷地早熟禾(50 株·盆-1)、紫羊茅(50株·盆-1)、中华羊茅(50 株·盆-1)幼苗株高、根长和鲜重,每个处理3次重复,统计菌株DGL1对4种牧草幼苗的促生效果。
1.6 菌株DGL1全基因组测序
1.6.1样品制备 将芽孢杆菌DGL1进行活化后,接种于于盛有20 mL LB液体培养基的三角瓶中,37℃,200 r·min-1条件下培养12 h,将培养好的菌液离心10 min(10 000 r·min-1)后取菌体,液氮速冻后,委托上海美吉生物医药科技有限公司进行全基因组测序。
1.6.2全基因组测序 收集纯化的DGL1基因组DNA,利用Covaris仪将基因组DNA片段化,构建合格的基因组测序文库,进行桥式PCR后的Illumina Hiseq测序,将下机得到的数据利用组装软件SOAPdenovo2进行多个Kmer参数的拼接,得到最优的contigs组装结果,然后把reads比对到contig上,根据reads的paired-end和overlap关系,对组装结果进行局部组装和优化,形成scaffolds,将组装后的序列进行生物学分析。
1.6.3基因组注释功能与预测 采用GO[27],KEGG[28]和COG[29]对细菌基因组进行快速注释,并得到相应的注释信息;采用Prodigal[30],RNAmmer[31]等工具对编码序列、核糖体RNA基因进行注释与预测,使用CGView[32]软件绘制菌株DGL1的基因组环形图谱。
2 结果与分析
2.1 拮抗病原真菌活性的测定
以病原真菌锐顶镰孢菌、瓜类枯萎菌、小麦赤霉菌作为病原指示菌,通过平板对峙法检测菌株DGL1的抑菌活性,结果表明:菌株DGL1对锐顶镰孢病菌的抑菌圈直径为29 mm,对瓜类枯萎病菌抑菌直径为26 mm,对小麦赤霉菌的抑菌圈直径为29 mm,表明DGL1菌株具有显著拮抗病原真菌活性(图1)。

图1 菌株DGL1对锐顶镰孢病菌(A)、瓜类枯萎病菌(B)、小麦赤霉菌(C)产生的抑菌圈Fig.1 Bacteriostatic circles of DGL1 strains against F. acuminatum (A), F.oxysporum (B) and F.graminearum (C)注:中间菌落是病原指示菌,周围四个菌落是待测芽孢杆菌DGL1Note:The middle of the pathogenic bacteria is the indicator bacteria,around the four colonies is tested Bacillus DGL1
2.2 降解纤维素活性测定
通过CMC法测定菌株DGL1降解纤维素活性,结果表明:菌株DGL1在以纤维素为唯一碳源的CMC培养基上产生了降解透明圈,表明菌株DGL1具有降解纤维素的能力,能够通过代谢作用产生解纤维素酶降解了CMC平板上的纤维素。通过降解透明圈与菌落直径比值A测定降解纤维素活性大小,透明圈直径为17 mm,菌落的直径为7.1 mm,比值A是2.40,表明DGL1具有一定的降解纤维素活性(图2)。

图2 菌株DGL1降解纤维素形成的透明圈Fig.2 Transparent circles produced by DGL1 for cellulose degradation
2.3 固氮活性测定
检测菌株DGL1的固氮活性,结果表明:芽孢杆菌DGL1经改良阿须贝(Ashby)无氮液体培养基培养5天后的发酵液(A)比对照(B)浑浊,表明菌株DGL1可在无氮培养基中生长,初步推测其具有一定的固氮能力(图3)。

图3 菌株DGL1在无氮液体培养基生长情况Fig.3 Growth of strain DGL1 in nitrogen-free liquid medium
2.4 促牧草生长活性测定
2.4.1菌液DGL1促牧草种子萌发试验 与对照相比,经菌悬液处理的燕麦、冷地早熟禾、中华羊茅、紫羊茅草种的发芽率分别为64.90%,23.80%,76.60%,81.20%,相比清水处理组CK增幅为4.5%,8.0%,44.3%,18.4%;其中,菌液处理对中华羊茅的芽长和根长促生效果最佳,与对照比分别增幅为186%,213.4%,对紫羊茅的芽长和根长促生效果最弱,与对照比增幅仅为15.4%,13.0%(图4,表1),表明菌株DGL1菌悬液对燕麦、冷地早熟禾、紫羊茅、中华羊茅草种均有较明显的促萌发效果。

图4 菌株DGL1促牧草种子萌发(7 d)Fig.4 Effect of plant seedling promoted by DGL1(7 d)注:A,紫羊茅;B,燕麦;C,中华羊茅;D,冷地早熟禾Note:A,Festuca rubra;B,Avena sativa;C,Festuca sinensis;D,Poa crymophila
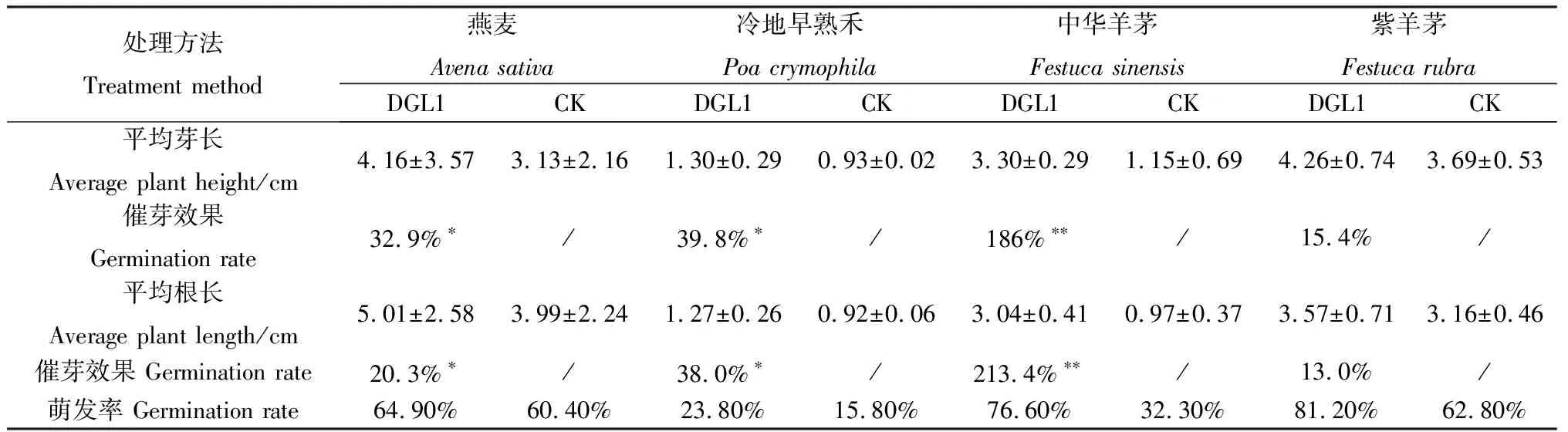
表1 菌株DGL1对牧草种子萌发的影响Table1 Effect on plant seedling promoted by DGL1
2.4.2菌液DGL1促牧草生长活性测定 DGL1菌悬液对燕麦、紫羊茅、中华羊茅幼苗的株高、根长、鲜重均具有显著性提高。经DGL1菌液处理的燕麦幼苗的株高、根长、鲜重分别达到26.70 cm,12.60 cm,0.39 g,与对照组相比增加29.6%,45.3%,69.6%;经DGL1处理的冷地早熟禾幼苗的株高、根长、鲜重分别达到7.54 cm,3.44 cm,0.009 g,与对照组相比增加17.6%,57.8%,80%;经DGL1菌液处理的中华羊茅幼苗的株高、根长、鲜重分别达到18.98 cm,4.80 cm,0.05 g,与对照组相比增加112.3%,98.3%,400%;经DGL1菌液处理的紫羊茅幼苗的株高、根长、鲜重分别达到18.71 cm,8.69 cm,0.08 g,与对照组相比增加24.4%,88.1%,100%;菌株DGL1对中华羊茅的株高、根长、鲜重的促生效果最佳,对冷地早熟禾的株高以及燕麦的鲜重促生效果最弱(图5,表2)。

图5 菌株DGL1促牧草幼苗生长(20 d)Fig.5 Effect of plant seedling promoted by DGL1(20 d)注:A,燕麦;B,紫羊茅;C,中华羊茅;D,冷地早熟禾Note:A,Avena sativa;B,Festuca rubra;C,Festuca sinensis;D,Poa crymophila
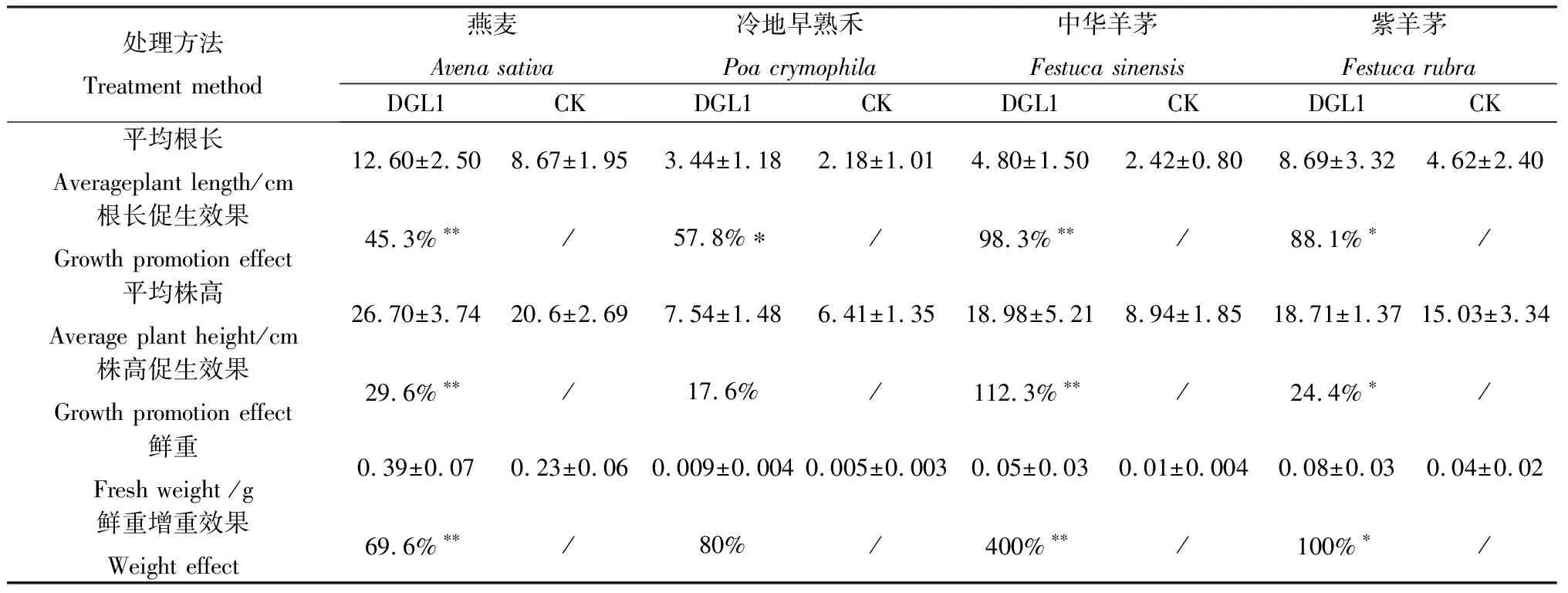
表2 菌株DGL1促牧草幼苗生长Table 2 Effect of plant seedling promoted by DGL1
2.5 菌株DGL1基因组测序
2.5.1基因组的基本特征 通过SOAPdenovo软件对二代测序数据进行组装,根据组装结果分析可知,二代测序Reads总数为9 802 908条,碱基总数高达1 480 239 108 bp;碱基识别准确率在99%以上的碱基所占百分比为97.06%;碱基识别准确率在99.9%以上的碱基所占百分比为92.00%,DGL1的染色体是一条长为3 915 550 bp的环形结构,GC含量为46.47%,CDS数量为3 972,有86个tRNA,27个rRNA,基因组圈图见图6,DGL1基因组序列已上传NCBI,登录号为CP065539。

图6 菌株DGL1的基因组圈图Fig.6 Circular map of Bacillus amyloliquefaciens strain DGL1注:圈图从外到内第一圈和第四圈为正链、负链上的CDS,不同的颜色表示不同的COG功能分类;第二圈和第三圈分别为正链、负链上的CDS、tRNA、rRNA;第五圈为GC含量,向外的部分表示该区域GC含量高于全基因组平均GC含量,峰值越高表示与平均GC含量差值越大,向内的部分表示该区域GC含量低于全基因组平均GC含量,峰值越高表示与平均GC含量差值越大;第六圈为GC-Skew值,具体算法为(G-C)/(G+C),可以辅助判断前导链和后滞链,一般前导链GC skew>0,后滞链GC skew<0,也可以辅助判断复制起点(累计偏移最小值)和终点(累计偏移最大值),尤其对环状基因组最为重要;最内一圈为基因组大小标识Note:The first and fourth circles from outside to inside are CDS on positive and negative strands,with different colours indicating different COG functional classifications;the second and third circles are CDS,tRNA and rRNA on positive and negative strands,respectively;the fifth circle is GC content,with the outward part indicating that the GC content of the region is higher than the genome-wide average GC content,with a higher peak indicating a greater difference from the average GC content,and the inward.The sixth circle is the GC-Skew value,the specific algorithm is (G-C)/(G+C),which can help to determine the leading strand and lagging strand,generally the leading strand GC skew>0 and the lagging strand GC skew<0,also can help to determine the starting point (cumulative offset minimum) and the ending point (cumulative offset maximum) of replication.) and endpoints (cumulative offset maxima),especially for circular genomes;the innermost circle is the genome size marker
2.5.2基因组功能注释 将菌株DGL1的基因序列与COG数据库进行比对,进行了20个功能分类,共注释到2 970个基因,占总基因的74.77%。其中预测到的已知功能中,氨基酸转运和代谢、转录、碳水化合物的运输和代谢功能预测的最多(图8)。

图8 GO注释聚类分析Fig.8 Gene distribution based on GO classification
将菌株DGL1的基因序列与GO数据库进行比对,共注释到3类2 926个基因,占总基因的73.67%,其中与细胞组成(Cellular component)相关基因数量有1 555个,主要与膜的组成部分、细胞质、质膜的形成有关;与分子功能(Molecular function)相关的基因数量2 288个,主要与ATP结合、DNA结合、转录因子活性、序列特异性DNA结合过程有关;与生物过程(Biological process)相关的基因数量2 133个,主要与氧化还原过程、转录调控、DNA模板有关(图9)。
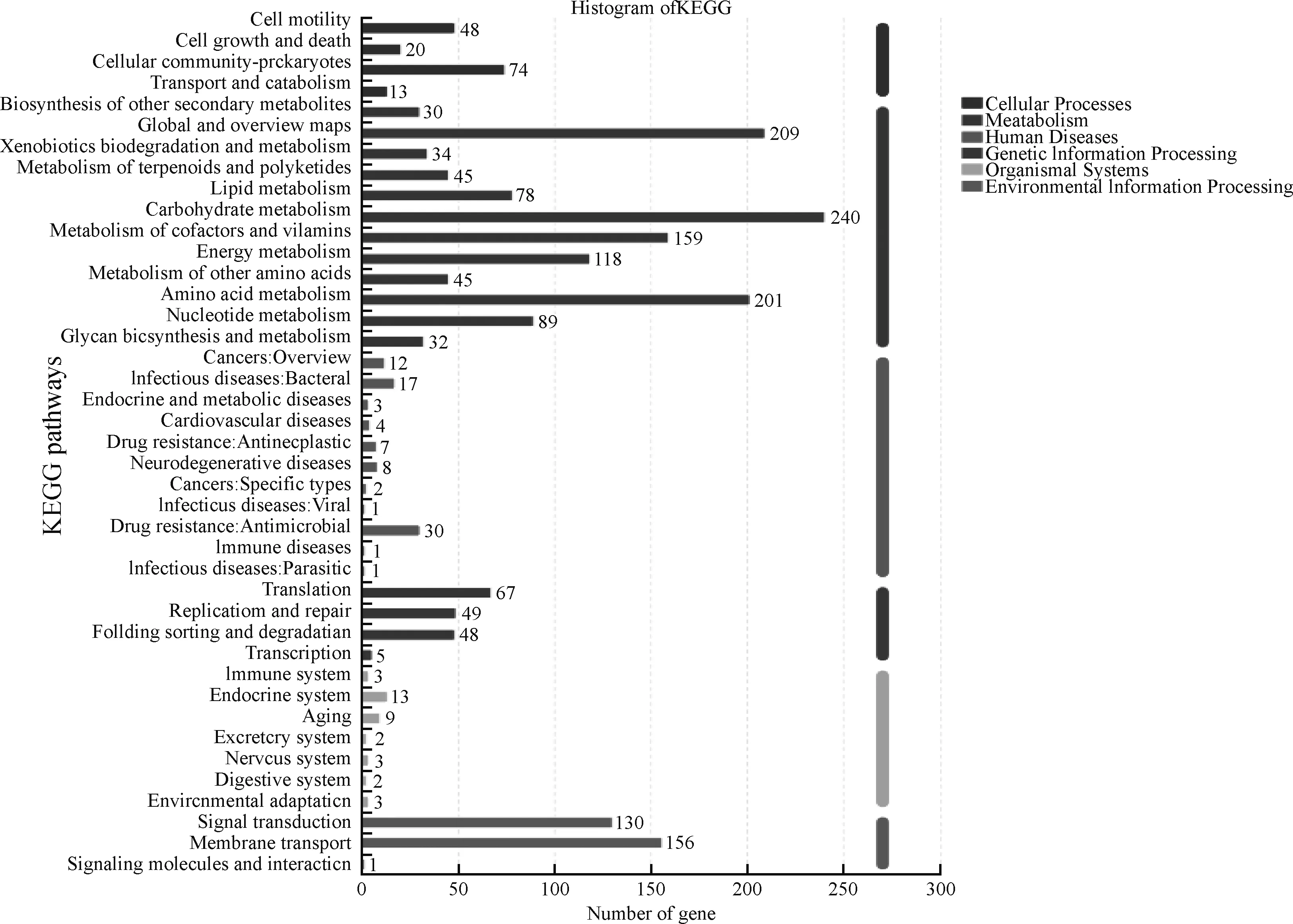
图9 KEGG注释分类统计图Fig.9 Classification statistics of KEGG annotation
通过对解淀粉芽孢杆菌DGL1的KEGG途径分析发现,共有2 160个基因参与了功能注释,155条途径参与细胞生命过程,169条途径参与环境信号转导过程,1 280条途径参与物质新陈代谢过程,其中主要是以氨基酸代谢、碳水化合物代谢途径最多(图10)。
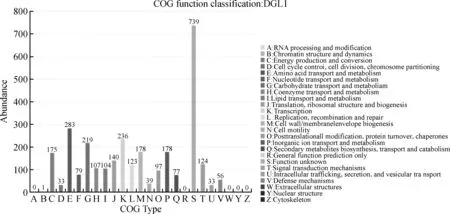
图7 COG注释聚类分析Fig.7 Gene distribution based on COG classification
2.6 菌株DGL1的相关功能基因分析
2.6.1降解纤维素活性相关基因分析 通过基因功能注释分析表明,芽孢杆菌DGL1基因组存在4个内切葡聚糖酶基因,这些编码基因与纤维素酶的合成有关。通过生物学活性测定,发现菌株DGL1能够在CMC-Na上产生透明圈,能够将纤维素降解为单糖,并通过KEGG代谢通路发现2条与降解纤维素有关的途径,途径一是由内切葡聚糖酶分解成纤维糊精(cellodextrin),再由β-葡萄糖苷酶分解成葡萄糖;途径二是纤维素可以由内切葡聚糖酶分解成纤维二糖(cellobiose),之后再降解成葡萄糖(表3)。
2.6.2拮抗活性相关基因分析 通过基因功能注释对次级代谢产物分析发现,菌株DGL1具有编码脂肽类抑菌fengycin蛋白的基因簇,该基因簇包含ppsA,ppsB,ppsC,ppsD,ppsE等基因共49个,与编码fengycin基因簇的同源性可达到100%,也具有编码脂肽类抑菌Surfactin蛋白的基因簇,该基因簇包含SrfAA,SrfAB,SrfAC等共48个,与编码Surfactin基因簇的同源性可达到91%,据刘邮洲等[32]报道,萎缩芽孢杆菌中提取到的泛革素、表面活性素对草莓枯萎病菌菌丝的生长具有明显的抑制作用,通过平板对峙试验发现,菌株DGL1能够明显抑制瓜类枯萎病菌、锐顶镰孢病菌、小麦赤霉病菌在PAD平板上生长,预测菌株DGL1可能通过代谢合成泛革素、表面活性素,增加菌株的抑真菌活性(表3)。
2.6.3促生抗逆相关功能基因分析 通过基因功能注释分析表明,芽孢杆菌DGL1基因组中存在与生长激素合成的关键基因yhcX[34],dhaS[34],YsnE[35]。菌株DGL1可能合成IAA,促进植物组织细胞的分裂生长,大量研究表明,芽孢杆菌属可以合成吲哚乙酸从而促进植物生长。
基因功能注释分析表明,芽孢杆菌DGL1基因组中存在固氮所必需的基因glnB[36]及在共生固氮过程中起调控作用的基因NifA[37],本研究通过改良阿须贝无氮培养基法初步测定出菌株DGL1具有固氮能力,能够通过增加植物体内氮素的含量从而促进植物生长,同时注释到编码合成增强植物抗逆性物质2,3-丁二醇的关键基因alsR[38],从而增强芽孢杆菌在逆境环境的生存生长(表3)。

表3 菌株DGL1相关基因分析Table 3 Related gene analysis of DGL1
3 讨论与结论
本研究对分离自青海大格勒干旱沙地白刺(N.tangutorum)根围的解淀粉芽孢杆菌DGL1进行拮抗病原真菌活性分析发现,菌株DGL1对病原真菌瓜类枯萎病菌、锐顶镰孢病菌、小麦赤霉病菌均具有良好的拮抗活性。据报道,拮抗菌在代谢过程中可以产生多种抑菌物质,包括脂肽类、多肽类、抑菌蛋白,其中脂肽类抗生素在生防制剂中占据主导地位[39]。陈华等报道[40],枯草芽孢杆菌JA产生的脂肽类化合物对丝状真菌具有较好的抑菌活性;钱常娣等报道[41]枯草芽孢杆菌菌株BAB-1产生的脂肽类物质性质稳定,能够显著抑制番茄灰霉菌菌丝生长及分生孢子的萌发。本研究通过全基因组测序发现,DGL1基因组中存在与脂肽类化合物合成有关的编码基因簇Surfactin,fengycin,预测DGL1具有的拮抗病原真菌活性与脂肽类化合物Surfactin,fengycin有关。
蒋加拉等[42]报道,芽孢杆菌能够抑制胃、肠道致病菌的入侵,调节免疫,提高食物利用率和促进植物生长等生物学功能,在饲料加工及秸秆还田方面具有一定的应用潜力。本研究测定分析表明菌株DGL1具有降解纤维素的能力,同时通过基因注释发现DGL1基因组存在与降解纤维素基因有关的β-葡聚糖酶基因,并通过KEGG数据库,注释到与降解纤维素有关的代谢途径。目前,芽孢杆菌作为生物菌肥,已经被广泛的应用在农业生产中,王美琴等[43]报道枯草芽孢杆菌对番茄种子的萌发具有很强的促生作用,渠露露等[44]报道类芽孢杆菌能够明显增加了水稻幼苗的根长、根数和苗高。本研究分离筛选的解淀粉芽孢杆菌DGL1菌悬液对燕麦、冷地早熟禾、紫羊茅、中华羊茅草种均有较明显的促萌发效果,同时对4种牧草幼苗的株高、根长、鲜重具有明显的促生增产作用。芽孢杆菌通过多种途径促进植物生长,如通过固定空气中的氮元素供给植物生长,合成植物生长激素促进细胞伸长生长,合成铁载体吸收土壤中的铁元素供给植物利用[45]。本研究经过阿须贝无氮培养基法测定发现菌株DGL1具有固氮能力,同时基因注释到DGL1基因组中存在固氮所必需的基因glnB,在共生固氮过程中起调控作用的基因NifA,以及IAA合成必要的基因yhcX,dhaS,YsnE。本研究对菌株DGL1进行全基因组测序,探究菌株DGL1的生防机制。测序分析表明菌株DGL1的染色体是一条长为4 248 134 bp的环形结构,GC含量为43.57%,CDS数量为4 465,有85个tRNA,30个rRNA,通过与COG,GO,KEGG数据库比对分别注释到2 970,2 926,2 160个功能基因。
菌株DGL1具有良好的抑制病原真菌、降解纤维素和固氮活性,能够明显促进高原牧草燕麦、冷地早熟禾、紫羊茅、中华羊茅植物的生长,在植物的生长发育和对病害的防御过程中起着重要的作用,在退化草地生态恢复中具有一定的应用潜能。本研究通过生物学活性检测与基因组测序结合分析,揭示了菌株DGL1促牧草生长的作用效应,展现了DGL1具有微生物制剂的研发潜能。
