局部晚期结肠直肠癌治疗和联合脏器切除
2021-09-07顾晋
顾 晋
(北京大学肿瘤医院胃肠肿瘤中心三病区,北京 100140;北京大学首钢医院胃肠外科,北京 100144)
在我国,结肠直肠癌(colorectal cancer,CRC)是常见的恶性肿瘤。发病率和死亡率分别占所有恶性肿瘤的第3位和第5位[1]。我国社会经济发展不平衡,各地区医疗条件和水平参差不齐,CRC的诊疗水平相差较大。由于国家层面、大规模的CRC早期筛查尚未普遍开展,我国CRC病人初诊时大多为局部进展期或晚期[2]。目前我国县级医疗机构都在开展CRC的外科手术,无论从技术和仪器设备来看,都取得相当大的进步。但是,对于部分局部晚期CRC,又称局部进展期CRC,特别是侵犯周围脏器的巨大肿瘤和局部复发的CRC,基层医疗机构的处理能力受到技术和条件的限制。另外,对于这些医疗机构的外科医师来说,局部晚期CRC治疗理念的更新和认识受到地域等因素的影响,包括合理的术前综合治疗选择、规范的多脏器联合切除、合理的术后辅助化疗等理论和技术方面在内的系统培训仍是广大基层临床外科医师的迫切需求。
局部晚期CRC的概念
对于局部晚期CRC,临床上最重要的是正确的术前临床分期。当前我国基层医院的外科医师,对于CRC的正确术前分期存在诸多问题。没有正确的术前临床分期,规范化的外科诊治无从谈起。笔者观察到的现象是,许多外科医师只会手术,而忽略术前分期和必要的术前治疗。目前,CRC术前分期大多采用美国癌症联合委员会 (American Joint Committee on Cancer,AJCC)第 8 版[3]恶性肿瘤 TNM临床分期。根据肿瘤的TNM分期,将CRC分为早期、局部晚期和晚期。2017年中国局部进展期直肠癌诊疗专家共识[4]也是根据经典的TNM分期,将局部晚期直肠癌定义为:经影像学检查或病理检查发现的原发肿瘤侵出肠壁肌层至周围结构(c/pT3~4b),或系膜内及真骨盆范围内出现淋巴结转移(c/pN1~2),但无远处转移(M0),即TNM分期的Ⅱ、Ⅲ期。这类病人术前的正确分期,对指导临床治疗有重要意义。临床较易混淆的概念是,将T4b的病人(肿瘤突破肠壁浆膜、侵及周围脏器)看作晚期。事实上,这部分肿瘤仍是临床Ⅱc期,属于局部晚期,治疗策略与晚期不同。有资料表明,50%~64%的直肠癌诊断时就已属于局部晚期[5]。
术前评估方法及MDT讨论决策
一、纤维结肠镜检查
纤维结肠镜检查可得到组织病理学检查的确切诊断,这是所有治疗的前提条件。活检标本的组织学分型,甚至必要的免疫组织化学、基因检测对于需新辅助治疗的病人至关重要。特别是近肛门的肿瘤,术前的病理学诊断尤为重要。因牵涉到保留病人的肛门括约肌与否,如未得到确切的病理学阳性诊断,贸然手术会引发医患矛盾。
二、CT检查
推荐结肠癌病人行全腹、盆腔及胸部CT检查,可兼顾肿瘤原发灶及常见转移部位(肝、肺)。必要时选择全身骨扫描排除骨转移。
三、盆腔MRI检查
对于局部晚期直肠癌客观准确的临床分期,术前的MRI检查非常重要。规范的术前cTNM分期是选择合理术前治疗的重要前提。
四、血清肿瘤标志物CEA、CA199的检测
肿瘤标志物对于病人术后的辅助治疗以及局部复发的监测有重要意义[6]。对怀疑卵巢转移的病人,建议增加CA125的检测。
五、MDT
复杂的CRC往往涉及临床多学科团队(multi-disciplinary team,MDT)的合作[7]。 女性局部晚期直肠癌可侵犯子宫阴道,男性可侵犯膀胱和前列腺等重要脏器,部分病人肿瘤还可能侵犯骶骨等。通常需MDT对病人进行全面评估。根据肿瘤的位置和侵袭程度,决定是否行术前新辅助放、化疗。通过最合适的术前治疗策略,以得到最佳的临床效果[8]。局部晚期CRC的MDT评估通常涉及结肠直肠外科、肿瘤内科、放射治疗科、影像科、病理科、泌尿外科、妇科、骨科、整形外科等多个学科,以及护士、造口师等专业人员的配合。
术前治疗措施
一、新辅助治疗原则
对于可切除的局部晚期结肠癌,根治性手术切除是首选治疗方式。大多数局部晚期结肠癌,确诊时均可直接手术。尽管一些巨大的肿瘤对周围脏器有侵犯,由于结肠癌的特殊解剖部位,如巨大的乙状结肠癌累及膀胱底部,但仍可完整切除。至于一些因肿瘤巨大,且多个脏器受累,或肿瘤受累脏器解剖部位深在(如十二指肠降部),脾曲结肠巨大肿瘤同时侵及胰尾等,在外科手术Ⅰ期完整切除有困难的情况下,为达到使肿瘤降期的目的,可考虑术前新辅助治疗,主要以辅助化疗为主[9-10]。
按照中国CRC诊疗规范[2],对于局部晚期中、低位直肠癌cT3~4或TanyN+的病人,均应接受术前新辅助放、化疗(neoadjuvant chemoradiotherapy,nCRT)。有证据表明,nCRT可显著降低局部复发率,提高R0切除率,增加保肛率[11]。通常,直肠癌侵及骶骨,前方侵及前列腺和精囊腺,女性侵及子宫和双侧卵巢的病人,经常采用术前nCRT,使肿瘤降期,以便手术达到R0切除。
二、放疗
局部晚期直肠癌放疗通常分为长程 (50.4 Gy/25 f)[12]和短程(25 Gy/5 f)[13],短程放疗和长程放疗在局部控制、长期生存率的差异无统计学意义。两者放疗后的等待时间不同。短程放疗的等待时间一般为2周,近年,对直肠癌术前长程放、化疗的等待时间从原来的 6~8 周,延长到现在推荐的 8~12 周[14]。
三、肿瘤巨大合并急性肠梗阻的肠造口
CRC相关急症包括急性肠梗阻、肠穿孔、急性消化道大出血,尤以急性肠梗阻常见,约占所有肿瘤相关急症的80%[15]。肠造口术是解除梗阻的重要方法。肠造口术虽不复杂,但造口方式选择不当或制作不佳,不仅达不到手术目的,还会导致造口并发症发生,甚至危及生命。不同梗阻部位的肠造口方式选择造口应符合以下几点:①腹壁开口和造口肠段部位选择恰当,有条件的单位应在造口师的指导下进行。②造口垂直拉出无张力。③造口血运良好[16]。另外,推广术前造口定位理念。在外科规范培训阶段,外科医师应接受造口治疗培训,增加造口治疗师的培养,提高术前造口定位比例。
联合脏器切除的外科手术原则
肿瘤巨大并不是CRC手术的禁忌证。总的原则是在能达到R0切除的基础上,尽量保护脏器功能,并进行合理的区域淋巴结清扫。一项回顾性研究收集了21 789例病理T4期结肠癌病人。结果表明,R0切除后病人的生存率明显优于R1切除。前者3年总生存率为81.6%,后者仅37.0%[17]。在287例Ⅱ期病人的研究中,结肠癌152例。经术后病理检查证实,83例(54.6%)有相关脏器癌性浸润。经联合脏器切除后,83例伴癌性浸润病人1、3和5年的生存率分别为89.2%、55.4%和38.5%。该研究还包括直肠癌135例。经病理检查证实,76例(56.3%)病人有相关脏器癌性浸润。经联合脏器切除后,伴癌性浸润病人1、3和5年的生存率分别为82.9%、55.3%和 42.1%[18]。
一、右半结肠癌合并十二指肠受累——联合胰十二指肠切除
右半结肠癌,特别是肝曲结肠癌易侵犯十二指肠,这在临床上十分常见。许多外科医师见到巨大的肝曲结肠癌与十二指肠界限不清时,往往因误判为“十二指肠受累”而放弃手术。事实上,这些病人经过认真解剖,肿瘤真正侵犯十二指肠的范围很小(见图1)。对于这部分病人,手术要点如下:①术中认真评估,将结肠从右后侧游离掀起整个结肠肿瘤,了解其与十二指肠的关系。②先不离断肠管,从肿瘤的左侧游离结肠,逐渐接近肿瘤。③从肿瘤的上方幽门下游离结肠,在小网膜孔观察结肠癌与十二指肠的关系。经过3个方向的游离,完全可显露肿瘤与十二指肠的关系。④明确肿瘤与十二指肠关系后,确定可切除部分十二指肠,从结肠肿瘤远处离断回肠,将整个右半结肠游离。最后从左侧离断横结肠(见图2)。临床上,升结肠癌侵及十二指肠行胰头十二指肠切除术,可达到R0切除。
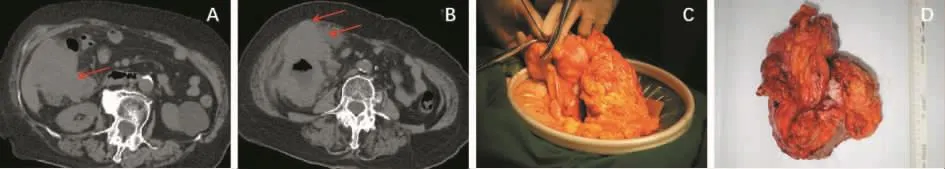
图1 右半结肠癌可疑侵犯周围脏器(图片资料来自笔者手术团队)
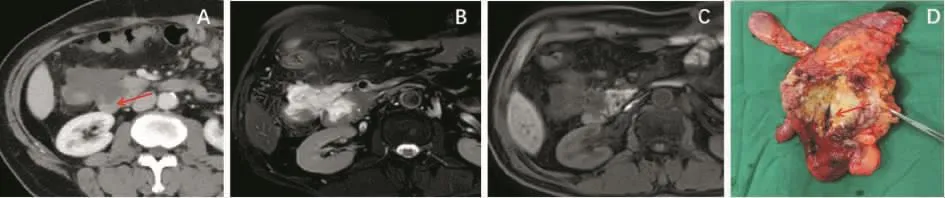
图2 右半结肠癌侵犯十二指肠(图片资料来自笔者手术团队)
二、左结肠癌胰尾-脾-胃联合切除
脾曲结肠癌侵及胰尾及脾门。左半结肠癌侵及脾门有时处理非常棘手。通常原因是肿瘤巨大、位置深在。在肿瘤与脾脏(特别是脾门)分不开的情况下,如无法排除胰尾受累,建议手术操作:①确定行联合脏器切除,不要分离肿瘤和脾脏的“粘连”。②显露腹腔干,将脾动、静脉游离,放置止血带。③从降结肠部位开始解剖,更易找到界线,离断降结肠。将近端结肠提起向后方游离结肠肿瘤。④游离脾曲前,用大纱布垫填塞至脾后方,将脾垫起,减少脾门损伤、撕裂导致的出血。⑤从横结肠开始切断肠管,向脾方向游离,离断脾结肠韧带。⑥注意后方的胰尾。⑦一旦脾门出血,收紧止血带即可止血。切忌分离脾和结肠肿瘤间的组织。经过仔细分离脾曲结肠,连同肿瘤一并切除。如脾脏受侵,建议游离胰腺。检查正常的胰腺,用直线切割器将胰腺体尾部整块切除缝合(见图3)。
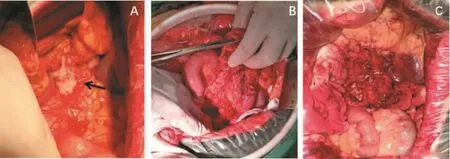
图3 左半结肠癌侵犯脾门(图片资料来自笔者手术团队)
三、乙状结肠癌-膀胱联合切除
乙状结肠癌最易侵及膀胱。然而,这种侵犯往往仅限于膀胱底。仅中段直肠癌,才有侵及膀胱三角的可能。该部分手术要点如下:①在切除肿瘤前,充分评估膀胱受累的最低部位,主要是膀胱三角。②不要首先分离直肠与膀胱的粘连,一旦分破,会导致肿瘤残留。③从肿瘤的左侧开始游离,可锐性加钝性分离;注意保护左侧输尿管。④如肿瘤位置很高,乙状结肠往往曲折,需尽量找到膀胱和直肠的最低点。⑤如肿瘤与膀胱关系紧密,可距肿瘤1 cm处切开膀胱全层,确保受累膀胱壁获得完整的R0切除。⑥一侧输尿管开口受累,在不破坏膀胱三角中尿道和对侧输尿管开口的情况下,可切除一侧输尿管,修正后将病侧输尿管干净切缘重植回膀胱(见图4)。
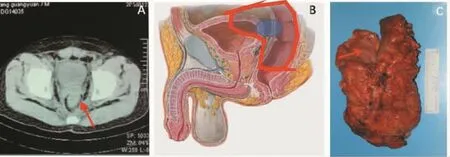
图4 中段直肠癌侵犯膀胱(图片资料来自笔者手术团队)
四、直肠癌联合子宫双附件的后盆腔切除或联合前列腺部分切除
直肠癌侵及子宫、附件、阴道及男性前列腺、精囊腺,常发生在低位直肠癌,特别是直肠前壁的肿瘤。此时肿瘤往往巨大。女性病人卵巢受侵犯位于一侧。阴道受累则见于直肠的前壁巨大肿瘤。手术要点:①一侧卵巢受累的直肠癌,联合脏器切除应切除双侧附件[19]。②阴道受累的直肠癌,应连同阴道一并切除。多数情况下,部分阴道切除后可缝合,保证阴道的完整性。③直肠前壁肿瘤侵及前列腺,可实施前列腺的部分切除。④注意保留骨盆自主神经,特别是低位直肠癌的手术操作。
五、直肠癌侵及骶骨
骶骨侵犯不是直肠癌晚期的标志。一般外科医师会放弃手术。但是,骶骨S2以下的侵犯是可切除的(见图5)。手术要点:①充分游离直肠近端肠管,显露至与骶骨相连部分以上,不作进一步分离。②距肿瘤上缘5 cm处离断直肠,近端行永久性造口,关腹。③改折刀位,骶骨做“工”字形切口,显露骶骨,切除尾骨,预计切除平面切除骶骨。
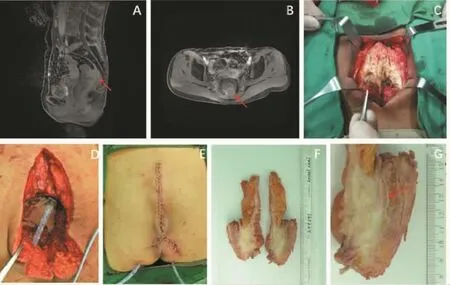
图5 低位直肠癌侵犯骶骨(图片资料来自笔者手术团队)
六、全盆腔脏器切除
直肠癌浸润广泛时,手术切除极为困难,常需联合部分或全部盆腔脏器切除术(total pelvic exenteration,TPE)。TPE是指整块切除肿瘤及乙状结肠、直肠、膀胱、远侧输尿管、转移淋巴结、盆底腹膜、肛提肌及会阴组织等,男性包括前列腺及精囊腺,女性包括子宫及阴道(见图6)。应当强调,实施TPE前,要充分预估病人是否存在远隔转移。有远隔转移的直肠癌病人,应放弃TPE。其手术要点:①从腹主动脉分叉处开始,靠近髂动脉向下分离,髂内动脉要分离至臀上动脉分叉以下。结扎髂内动脉,必要时结扎髂内静脉和骶正中动脉。②从膀胱间隙分离向后扩展,与直肠旁间隙汇合,向下清除。同时将输精管及跨此间隙的血管分离、切断。③切断远端输尿管,重建泌尿道,包括输尿管直接造口或回肠代膀胱术。根据情况切除部分或全膀胱,切断阴道及直肠,整块切除肿瘤及盆腔脏器。④根据情况闭锁残端或重建消化道,止血和处理盆底。TPE的手术难点是术中出血的控制、盆底修复和术后并发症发生。研究资料显示,R0手术切除是影响局部晚期直肠癌预后的关键因素。局部晚期直肠癌TPE后的总生存率优于其他盆腔肿瘤[20]。此外要强调的是,术前与病人及其家属充分沟通十分重要。
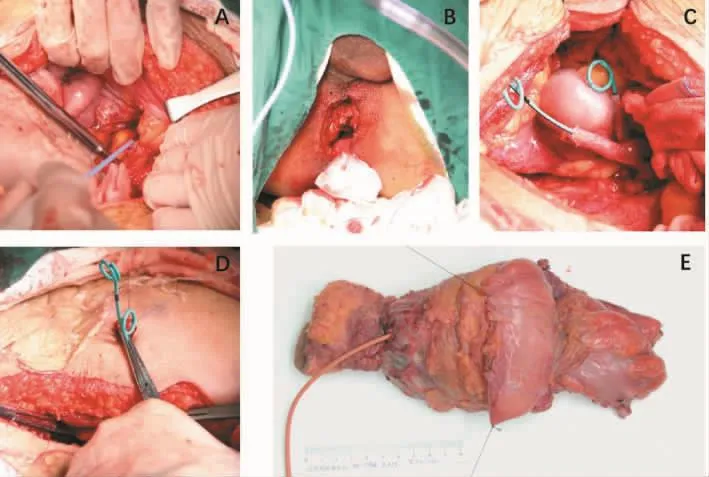
图6 全盆腔脏器切除术+输尿管皮肤造口(男性)(图片资料来自笔者手术团队)
术后辅助治疗
与单纯手术或手术结合新辅助治疗相比,局部晚期CRC术后辅助化疗 (adjuvant chemotherapy,ACT)可显著提高病人生存率[21-23]。自20世纪90年代初Moertel等[24]发表关于5-FU联合左旋咪唑治疗局部晚期CRC病人的研究以来,局部晚期CRC病人接受根治性切除术联合术后ACT,一直被认为是标准的治疗方案。尽管ACT提高局部晚期CRC病人的生存率,但高危Ⅱ期和Ⅲ期CRC病人接受ACT后5年复发率仍相当高,分别为20%~30%和50%~65%[25]。在几个与癌症复发相关的因素中,ACT的完成率已被证实为主要的预后因素。在完全应答的病人中可观察到最大生存获益。然而,有关研究显示,Ⅲ期CRC病人的辅助治疗完成率仅不到 70%[26-28]。此外,术后及时进行 ACT也很重要。研究表明,手术8周后才开始ACT的Ⅲ期结肠癌病人5年总生存率为61%,而≤8周开始ACT的病人则为68%。与未延迟ACT的病人相比,延迟ACT的病人总体死亡风险增加34%[29]。
近年,全程新辅助治疗(total neoadjuvant therapy,TNT)提出后得到广泛应用,其与术后ACT之间的疗效对比引人注目。一项最新的回顾性研究表明,入组的4 300例TNT和术后ACT病人的5年总生存率均为77%。校正潜在混杂因素后总生存率差异仍无统计学意义。倾向评分匹配后,TNT病人(16.1%)病理完全缓解率高于术后ACT病人(12.0%)(P=0.003 7)[30]。 与术后 ACT 相比,TNT 病人明显有更好的身体耐受力和依从性,但其长期总生存率尚未明确,仍需进一步研究。另外,来自中山大学第六医院的一项最新研究显示,对于nCRT后病理完全缓解的局部晚期直肠癌病人,与接受或未接受ACT的病人术后3年预后(总生存、无病生存)相似(P均>0.05),表明ACT并未改善nCRT后pCR 病人生存[31]。
尽管结肠与直肠的腺癌具有相似的病理特征,但对于局部晚期结肠癌术后病人,增加辅助放疗后生存并不获益,反而毒性较单纯ACT更高[32]。然而近来也有研究表明,对T4期结肠癌病人使用辅助放疗后可获得局部控制并延长病人无病生存期[17,33]。但相似的证据较少。目前国内、外指南也并未推荐对可切除的结肠癌病人常规使用辅助放疗。
结 语
对局部晚期CRC,尤其是cT4b期的肿瘤,充分的术前评估至关重要。临床MDT的密切合作,可使局部晚期CRC的综合治疗更完善。客观精准的手术探查,精细的解剖学操作,MDT的配合,对复杂困难的T4b期CRC仍可达到R0切除。联合围术期的新辅助/辅助治疗,有望做到根治合理、治疗充分、功能保全和改善预后。对于复杂的CRC,外科医师应始终保持高度的责任感和科学的态度,不轻易放弃,为病人争取最大的生存机会。我们的坚持,就是病人的希望。
致谢:本文病例图文整理得到杨勇、石景怡、黄安、高兆亚医师的帮助,在此一并感谢!
