人参皂苷在不同商品人参中的分布研究进展
2021-09-06吕重宁路金才
吕重宁,路金才
人参皂苷在不同商品人参中的分布研究进展
吕重宁,路金才*
沈阳药科大学中药学院,辽宁 沈阳 110016
商品人参种类较多,已经有大量的研究证实不同生境、生长模式、生长年限、移栽次数、加工炮制的人参商品在性状方面会有差异,体现在药效物质基础上则是人参皂苷含量和种类也会有差异。但到目前为止,相关研究主要集中于对园参、生晒参和红参中皂苷类成分的含量分析、分离纯化及鉴定上。基于此,将商品人参的主要化学成分人参皂苷进行系统综述,明确不同类型和种类的人参皂苷在各种人参商品中的分布,为今后不同商品人参的药效物质基础和活性对比研究提供帮助。
商品人参;人参皂苷;分布;不同生境;生长模式;生长年限;移栽次数
人参为五加科人参属植物人参C. A. Meyer的干燥根及根茎,具有大补元气、复脉固脱、补脾益肺、生津养血、安神益智等功效[1]。现代药理研究表明人参具有提高免疫力[2]、抗肿瘤[3]、改善心脑血管[4]、抗疲劳[5]等作用。
根据生长模式、生长年限和移栽次数的不同,人参商品可分为野生人参、林下山参、野山参、园参、趴货等。栽培者为“园参”,也是目前市场销售量最多的货品,一般多于播种后3~6年采收[6];自然传播,生长于深山密林的原生态人参为“野生人参”[7];播种在深山密林中任其自然生长的人参为“林下山参”,多于播种10年以上收取[6]。按《野山参鉴定及分等质量(GBT18765-2015)》规定,现在商品所称的“野山参”即为生长15年以上的林下山参[7]。目前,野生人参资源濒临枯竭,我国已将其列入《国家重点保护植物(第二批)》中并禁止采挖,故市场上流通的商品人参主要为园参与林下山参(含野山参)。
“趴货”,并不是规范的商品名称,它是人参市场和行业交流中的通俗用语,具体地趴货又分为“林下趴”“池趴”“园趴”。其中,目前市场趴货以“林下趴”“池趴”居多。林下趴是指把人工培育的参苗移栽到山野林下,任其自然生长,这类在市场商品又称“移山参”。池趴,则是将人工培育的参苗移栽到林下的池床中生长。据笔者前期前往人参市场考察,目前市场趴货的销售和存货数量并不大,也非主流人参商品。根据炮制加工方法的不同,人参又分为鲜参、大力参、生晒参、红参、白糖参、黑参、Sun ginseng等。其中目前市场销售主要以生晒参和红参为主,相关研究也主要集中于生晒参、红参、黑参、Sun ginseng等[8-9]。其中生晒参又分为通常所说的未经加工的林下山参、野山参和园参。
目前,已经有大量的研究证实[10-11],不同生境、生长模式、生长年限和移栽次数的人参在芦、艼、体、纹、须、皮、点等性状方面会有差异,体现在药效物质基础方面则是人参皂苷的含量和种类也会有差异。同时,随着炮制加工方法的不同,人参中的人参皂苷的含量和种类也会发生复杂变化,同时伴有新的人参皂苷类成分生成[12]。总之,不同的商品人参的化学成分随着采收、加工、生长年限等因素影响而会有所不同,功效和活性也会产生较大差异,如生晒参和红参的差异、园参和野山参的差异等。
但到目前为止,文献的相关研究主要集中于园参、生晒参和红参,随着林下山参的大量上市,目前也已经开始有相关的报道。因此,本文将对园参、林下山参、红参等主要化学成分人参皂苷进行系统综述,明确人参皂苷在各种商品人参中的分布,为今后不同商品人参的药效物质基础和活性对比研究提供帮助。
人参皂苷是人参的主要活性成分之一,主要以达玛烷型、齐墩果酸型、羊毛脂烷型、乌苏烷型为母核的三萜及其苷类化合物为主,其中达玛烷型和齐墩果酸型人参皂苷占绝大多数,已知从人参及其炮制品、人参内生真菌、人参不同程度水解产物、人参生物(酶、真菌、细菌)转化产物中分离和鉴定了人参皂苷已经超过200个,但从商品人参中分离得到的原生人参皂苷约为100个[13]。
1 达玛烷型人参皂苷
达玛烷型皂苷依据苷元C-6是否有羟基、C-17侧链构型的差异等又可分为4种亚型:原人参二醇型(protopanaxadiol,PPD)、原人参三醇型(protopanaxatriol,PPT)、奥克梯隆型(ocotillol)、其他类型(C-17 侧链变化型,C-17 side chain varied type)[14]。PPD和PPT型皂苷的成苷部位主要在C-3、C-6、C-20,极少在C-12位成苷(12--人参皂苷Rh4[15])。糖基部分主要由β--吡喃葡萄糖、α--吡喃葡萄糖、α--吡喃鼠李糖、β--吡喃木糖、α--吡喃阿拉伯糖、α--呋喃阿拉伯糖构成。
1.1 PPD型皂苷
PPD型人参皂苷因C-20绝对构型不同,又可分为20()-PPD型与20()-PPD型,20()-PPD型占大多数,20()-PPD型人参皂苷极少,至今仅从人参中分离得到20()-人参皂苷Rg3与20()-人参皂苷Rh2。不同商品人参中的原人参二醇型皂苷见表1。结构见图1。

表1 不同商品人参中的PPD型皂苷
CG-园参 RG-红参 BG-黑参 SG-Sun ginseng MCG-林下山参,下表同
CG-garden ginseng RG-red ginseng BG-black ginseng SG-Sun ginseng MCG-forest ginseng, same as below
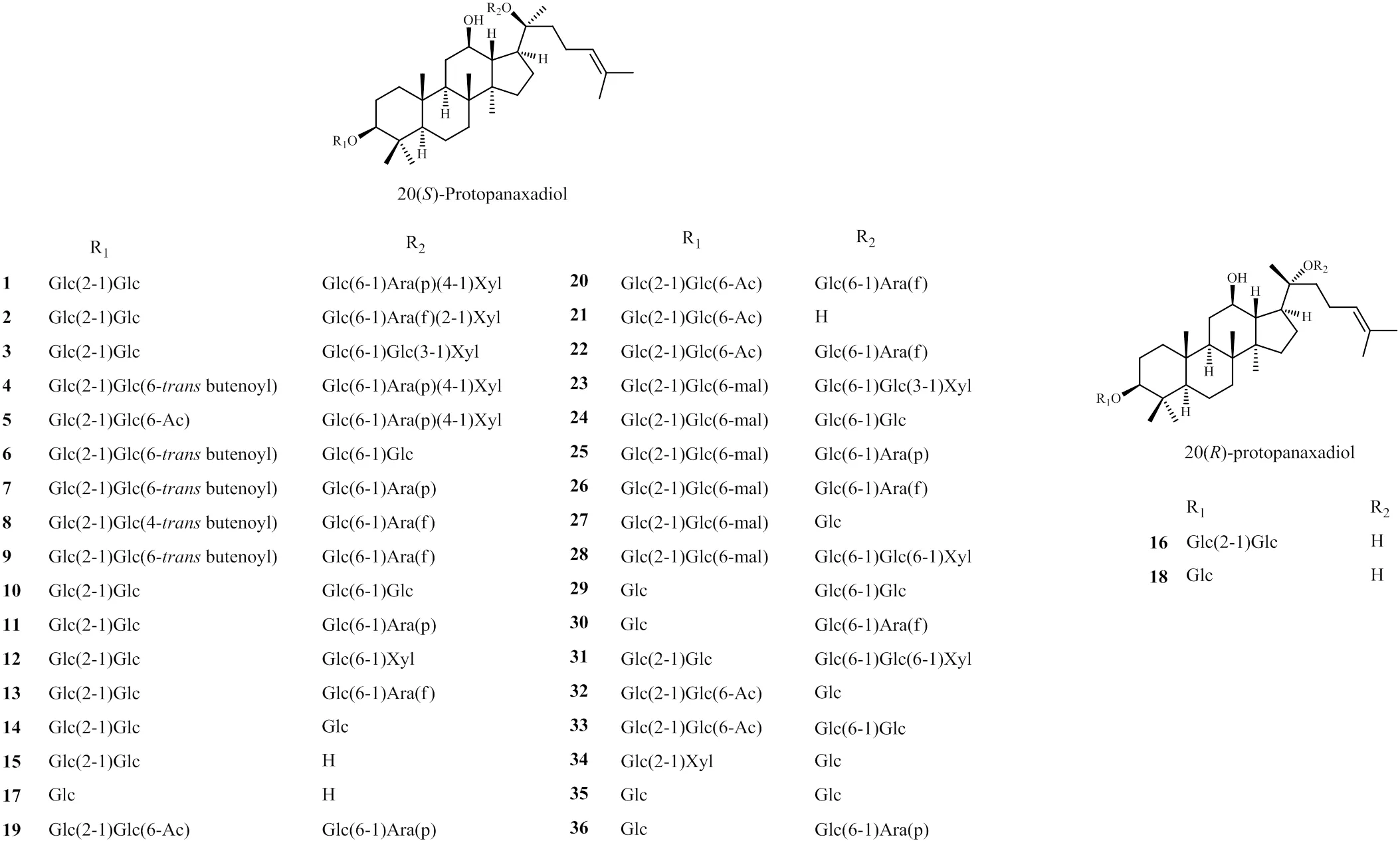
图1 商品人参中的PPD型人参皂苷结构
同黑参、红参等相比,园参(生晒参)中分布有一定量的丙二酰基等人参皂苷,如化合物23~28,化合物6~9,而蒸煮后的红参和黑参中未见分布,推测可能是随着温度升高,该类成分不稳定导致发生基团降解。同时,园参和红参中仅仅分离得到了1个20()-PPD型人参皂苷(16),但近年来才开始进行分离研究的林下山参中,已经分离得到2个20 () - PPD型人参皂苷(16、18),因此,猜测生长年限可能会对PPD型人参皂苷20位的构型产生一定影响。
1.2 PPT型皂苷
PPT型人参皂苷因C-20绝对构型不同,可分为20()-PPT型与20()-PPT型,大部分为20()-PPT型,不同商品人参中的原人参三醇型皂苷见表2。结构图见图2。同前述的PPD型人参皂苷类似,目前从人参中仅分离到20()-人参皂苷Rg2(46)[21]、20()-人参皂苷Rh1(49)[20]、6′-乙酰基20()-人参皂苷Rh1(57)[26]3种PPT型人参皂苷,但林下山参中发现的20()-PPT型人参皂苷的种类和相对量均明显高于园参。同时,同园参中的人参皂苷相比,红参中的人参皂苷母核中失去20位糖链的类型相对量较多,和以往的文献也已证实高温炮制会导致此位置糖链容易断裂一致。
1.3 奥克梯隆型人参皂苷
奥克梯隆型皂苷是一类其侧链含有呋喃环的达玛烷型四环三萜皂苷,主要存在于人参属植物中,如西洋参、珠子参、喜马拉雅假人参等[39]。迄今为止,仅从园参[40]中鉴定到了拟人参皂苷F11(64),红参[26]中分离得到(20, 24)-环氧达玛-12, 25-二醇-3-β--吡喃葡萄糖苷(65),以及从林下山参[21]中分离得到林下参皂苷A(66)、林下参皂苷B(67)。结构见图3。虽然目前林下山参的研究才刚起步,但是其中分离得到的该类型化合物比园参和红参要多,且化合物64是通过HPLC-MS进行鉴定而非通过分离经NMR鉴定。
1.4 其他C-17侧链变化型皂苷
PPD与PPT型皂苷的苷元母核与C-17侧链容易发生双键移位、水加成、氧化、环氧化、脱水等反应,从而形成的一系列皂苷,本文中统一称为其他类型皂苷,商品人参中的其他类型皂苷见表3,结构图见图4。
2 齐墩果酸型人参皂苷
齐墩果酸型人参皂苷是一类五环三萜类皂苷,人参中此类型的皂苷数量比达玛烷型皂苷数量和含量均少,人参中最主要的齐墩果酸型皂苷为人参皂苷Ro(114)[16,22,37]。此外,目前还从商品人参中分离得到了人参皂苷Ro1(115)[54]、人参皂苷Ri(116)[55]、聚乙炔人参皂苷Ro(117)[56]、人参皂苷Ro甲酯(118)[56]、6′--丁酯人参皂苷Ro(119)[38]、齐墩果酸-β--吡喃葡萄糖酯(120)[26]和3--β--吡喃葡萄糖-齐墩果酸-28--β--吡喃葡萄糖苷(121)[37],其中从园参中分离得到了化合物114~118,红参中分离得到了114、119和120,从林下山参中分离得到了化合物114和121。结构见图5。
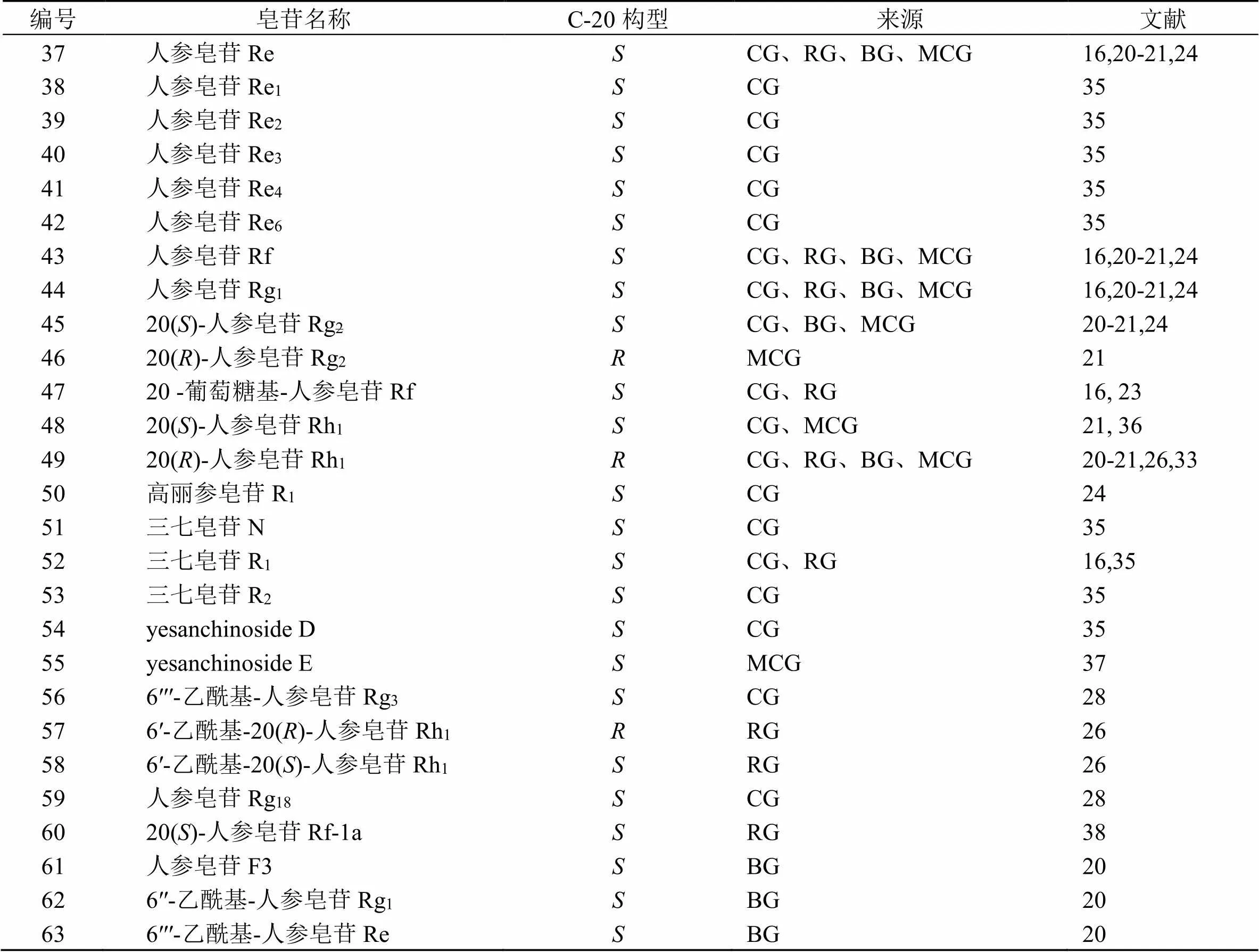
表2 不同商品人参中的PPT型皂苷
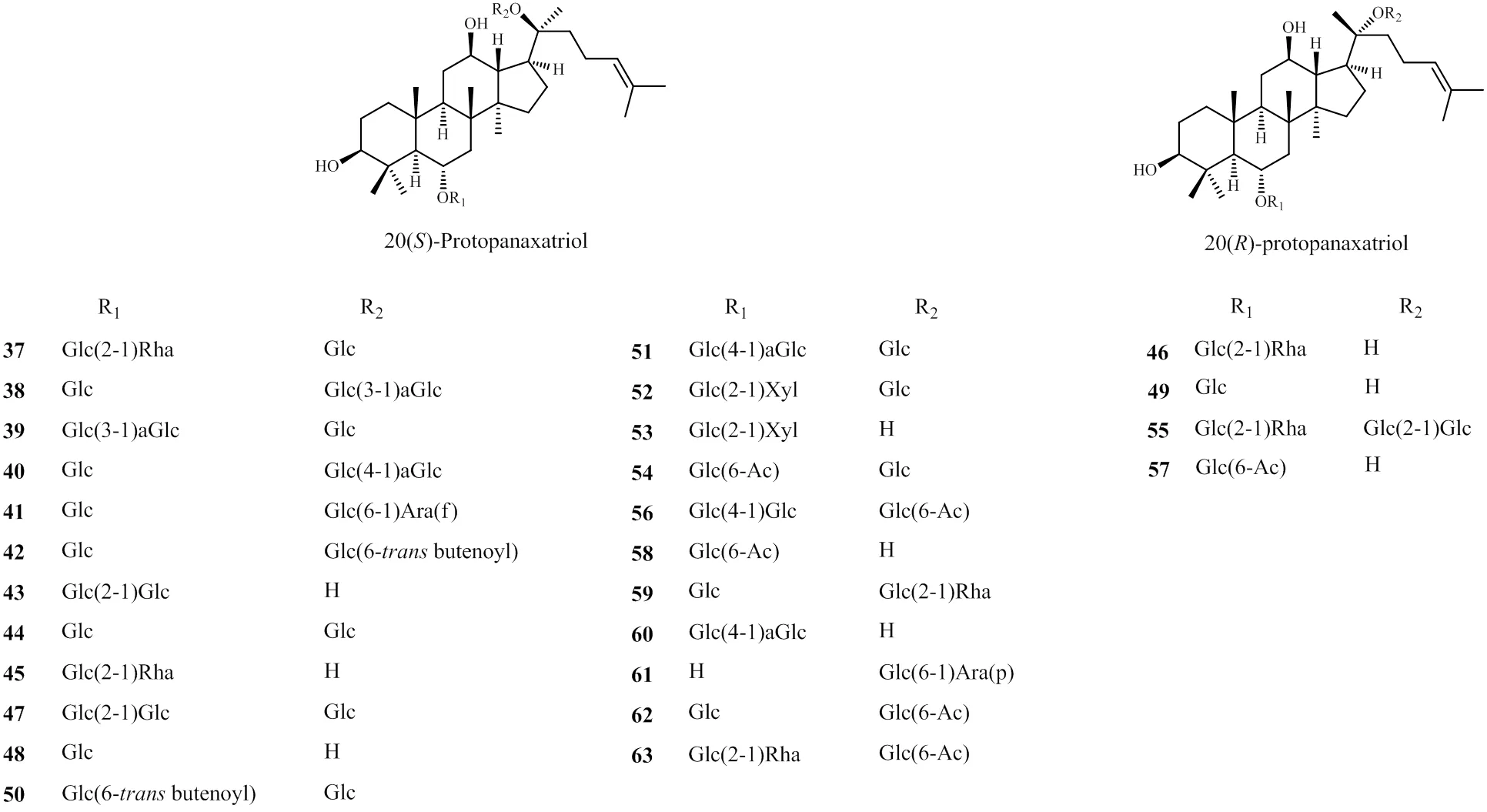
图2 商品人参中PPT型皂苷的结构
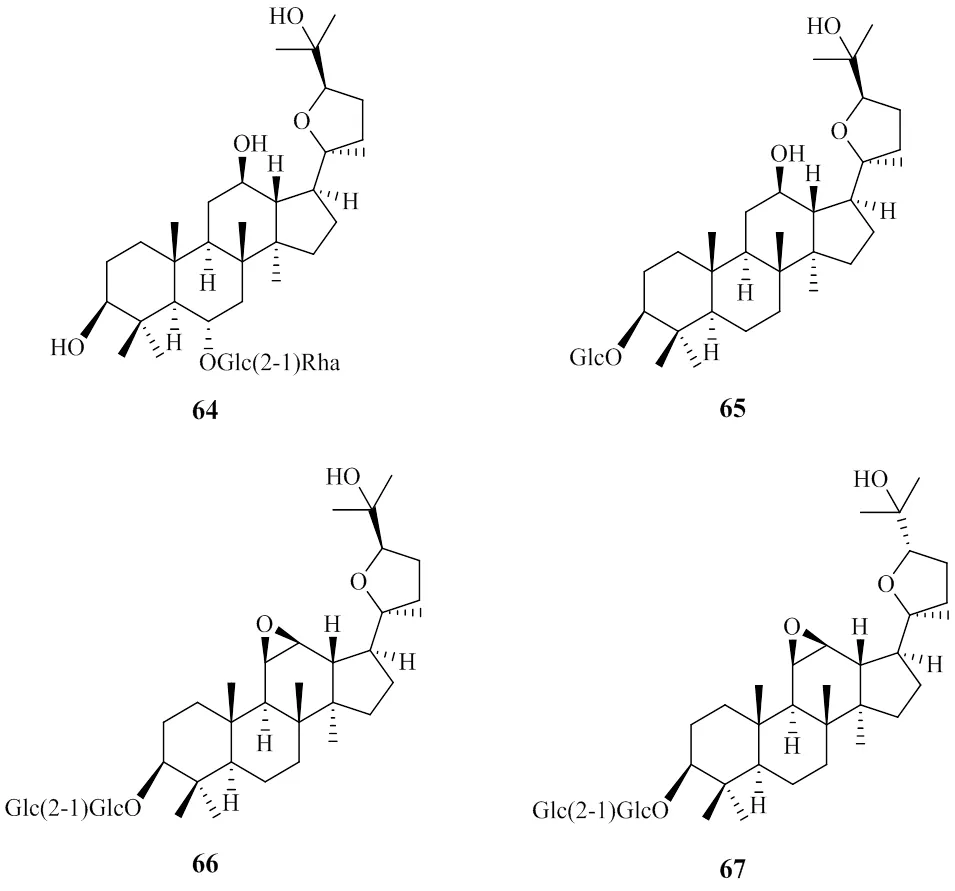
图3 商品人参中奥克梯隆型人参皂苷的结构
3 羊毛脂烷型皂苷
化合物(122~124)属于羊毛脂烷型四环三萜,此类化合物特点是C-10、C-13、C-14上分别连有β、β、α、-CH3,C-20为型,人参中这种类型的三萜皂苷并不多,目前为止仅分离得到3个羊毛脂烷型四环三萜。其中羊毛脂烷-5,24-二烯-3β-醇-3--β--吡喃葡萄糖-(6-1)-β--吡喃葡萄糖-(6-1)-β--吡喃葡萄糖苷(122)从红参[57]中得到,羊毛脂烷-24-烯-3β-醇-3β--吡喃木糖-(2′→1′′)-β--吡喃木糖苷(123)从Sun ginseng[58]中得到,羊毛脂烷-24-烯-3β-醇-3----吡喃阿拉伯糖-(2′→1")--α--吡喃阿拉伯糖苷(124)从园参[59]中得到,结构图见图6。
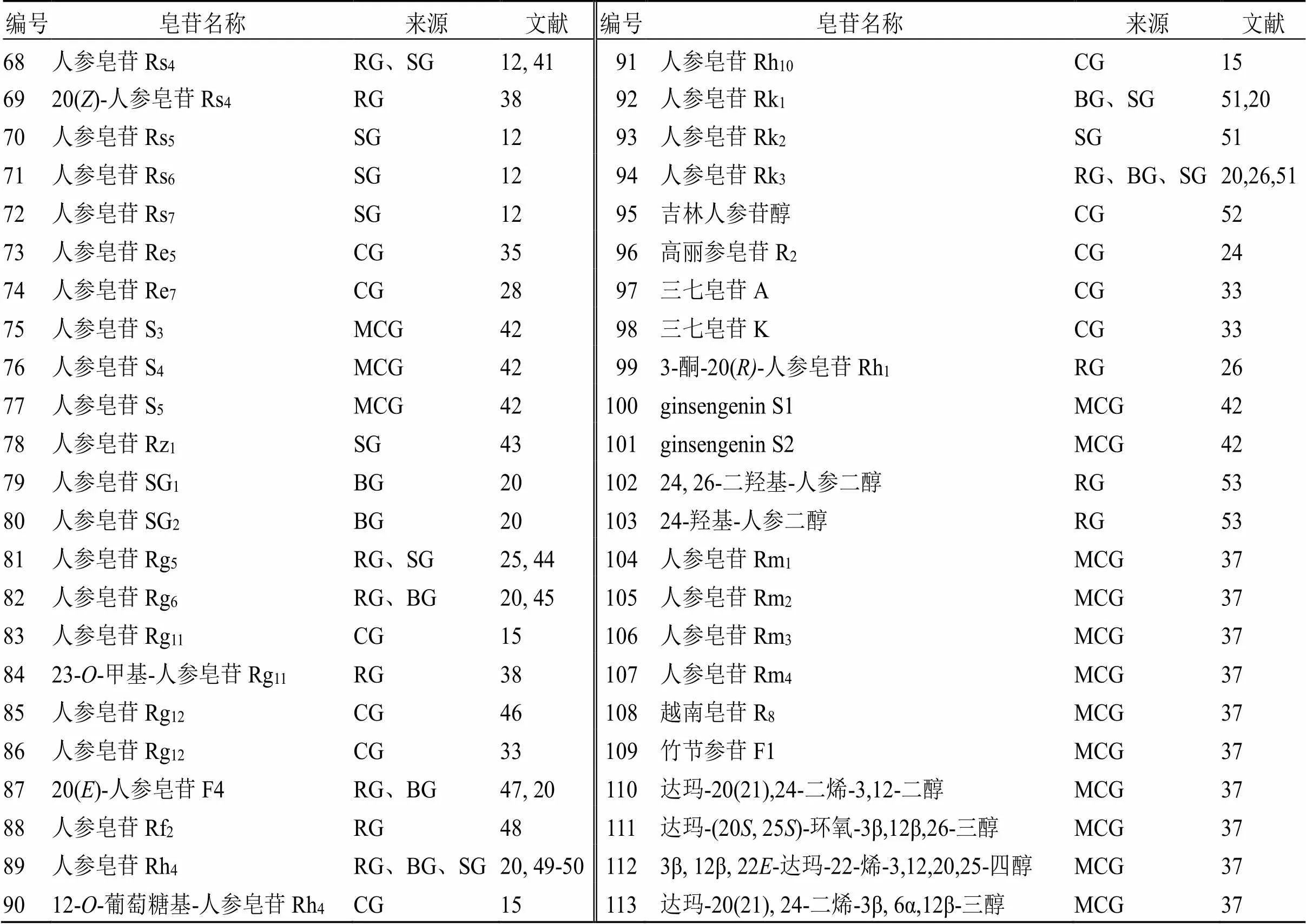
表3 商品人参中的其它达玛烷型人参皂苷

图4 商品人参中的其他达玛烷类型皂苷的结构
Fig. 4 The structures of the other type ginsenosides from different commercial ginseng
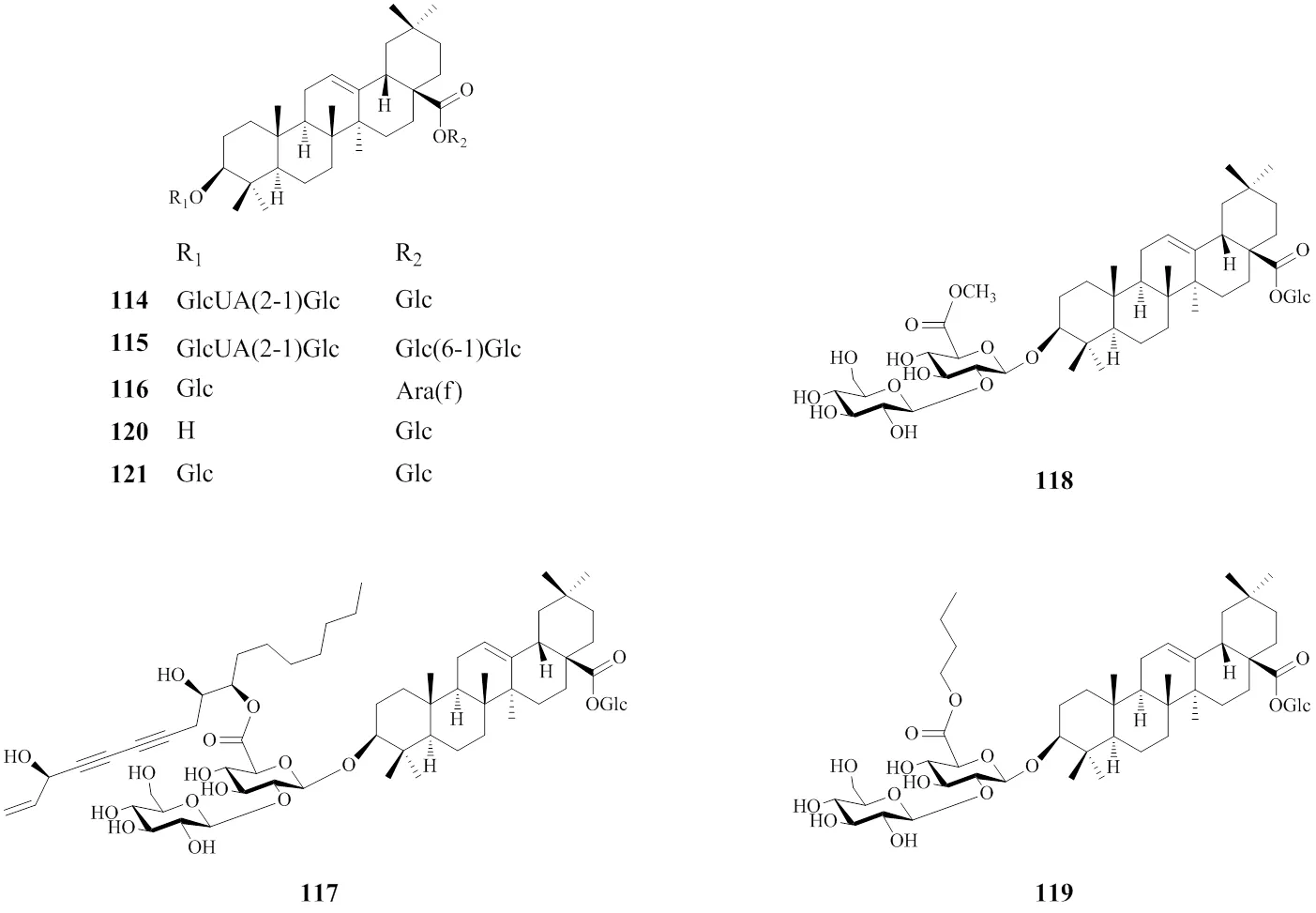
图5 商品人参中的齐墩果酸型皂苷的结构

图6 商品人参中的羊毛脂烷型人参皂苷的结构
4 乌苏烷型皂苷
化合物乌苏烷-3β, 19α, 22β-三醇-3--β--吡喃葡萄糖-(2-1)-β--吡喃葡萄糖苷(125)和乌苏烷-3, 11β-二醇-3--α--吡喃葡萄糖-(6-1)-α--吡喃葡萄糖-(6-1)-α--吡喃葡萄糖-(6-1)-α--吡喃葡萄糖苷(126)属于乌苏烷型五环三萜类化合物,二者目前仅从红参[57]中分离得到,结构图见图7。

图7 商品人参中的乌苏烷型人参皂苷的结构
5 讨论
人参皂苷种类之多,生物活性之广,药理活性的重要性和药理作用之独特,是其它中药无可比拟的,国内外学者对人参皂苷类成分的研究持续了一个多世纪,取得了巨大的成就。因此,深入挖掘不同商品人参的化学成分分布,对于了解它们药效的差异和独特的作用机制,具有重要意义。
通过综述不难发现:(1)同黑参、红参等相比,园参(生晒参)中分布有一定量的丙二酰基人参皂苷,而蒸煮后的红参和黑参中未见分布,推测可能是随着温度升高,该类成分不稳定导致发生基团降解。(2)PPD型人参皂苷主要以20()-PPD型为主,之前从园参和红参中仅仅分离得到了1个该类型的化合物20()-人参皂苷Rg3,但近年来才刚起步进行分离研究的林下山参中,已经分离得到20()-人参皂苷Rg3与20()-人参皂苷Rh22个。此外,值得注意的是,在红参中20()-人参皂苷Rg3比生晒参(园参)要高。同样,PPT型人参皂苷也存在相似的分布规律。(3)同园参(生晒参)相比,在红参和黑参中分布有更多种类的糖末端发生乙酰化的人参皂苷。(4)稀有人参皂苷,尤其是奥克梯隆型皂苷仅仅在红参和林下山参中有分布报道;乌苏烷型皂苷则仅仅在红参中有分布。(5)人参皂苷的PPD与PPT型皂苷的苷元母核与C-17侧链容易发生双键移位、水加成、氧化、环氧化、脱水等反应,从而形成的一系列皂苷,在本文的总结中发现,林下山参虽然研究刚刚起步,但是已经从其中分离得到了较大数量的C-17侧链高度氧化的皂苷,这有可能有助于研究年限和皂苷种类的关系,进而用于区分林下山参(野山参)和园参。(6)目前市场中的红参是由园参加工而成,同园参相比,红参中的人参皂苷母核种类更多,且明显可以看出因炮制过程的加热导致母核发生脱水反应。(7)根据前述文献总结,不同商品人参中的人参皂苷的糖单元部分组成没有差别,都主要以β--吡喃葡萄糖、α--吡喃葡萄糖、α--吡喃鼠李糖、β--吡喃木糖、α--吡喃阿拉伯糖、α--呋喃阿拉伯糖等几种类型组成;此外,不同商品来源人参的糖链组成也没有明显的差别和规律。
而实际上,除了上述主要特点之外,还仍有大量规律有待总结。比如,以往认为奥克梯隆型皂苷PF11仅仅存在于西洋参中,是区分园参和西洋参的一个重要标志物,而有文献报道从园参中通过HPLC-MS方法检测到了PF11[40],但目前仍未有文献报道从其中分离得到此化合物,但在本课题组的总结中发现,近几年刚刚起步研究的林下山参有文献报道分离得到奥克梯隆型皂苷,这和以往的认知人参中没有奥克梯隆型皂苷有所偏差,所以,是否生晒参(园参、林下山参)中也的确存在痕量的PF11有待进一步研究。因此,进一步结合化学结构特点,通过明晰不同商品人参生境、生长模式、生长年限、移栽次数、加工炮制和人参皂苷种类分布的差异关系,对于深入了解不同商品人参的功效、药理活性以及不同商品人参的药效物质基础和活差异会有较大帮助。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 8.
[2] Chen L X, Qi Y L, Qi Z,. A comparative study on the effects of different parts ofon the immune activity of cyclophosphamide-induced immunosuppressed mice [J]., 2019, 24(6): E1096.
[3] Yun T K.: A non-organ-specific cancer preventive? [J]., 2001, 2(1): 49-55.
[4] Lee C H, Kim J H. A review on the medicinal potentials of ginseng and ginsenosides on cardiovascular diseases [J]., 2014, 38(3): 161-166.
[5] Arring N M, Millstine D, Marks L A,. Ginseng as a treatment for fatigue: A systematic review [J]., 2018, 24(7): 624-633.
[6] 王喜军. 中药鉴定学[M]. 北京: 人民卫生出版社, 2012: 236.
[7] 野山参鉴定及分等质量 [S]. 2015: 20.
[8] Park I H, Han S B, Kim J M,. Four new acetylated ginsenosides from processed ginseng (Sun ginseng) [J]., 2002, 25(6): 837-841.
[9] 赵晋红. 人参的加工炮制及药理研究进展[J]. 山西中医, 2012, 28(3): 54-55.
[10] 徐世义, 李可欣, 史德武, 等. 野山参、林下山参、趴货、园参性状及显微特征的比较研究[J]. 中草药, 2013, 44(16): 2304-2307.
[11] 魏可欣. 人参药材及饮片的质量评价研究[D]. 长春: 长春中医药大学, 2019.
[12] 张淼, 秦昆明, 李伟东, 等. 人参炮制过程中化学成分变化及机制研究[J]. 中国中药杂志, 2014, 39(19): 3701-3706.
[13] 石婧婧, 陈舒妤, 邹立思, 等. 超快速液相色谱-三重四级杆-线性离子阱质谱法分析人参和红参中皂苷类成分 [J]. 中国药学杂志, 2018, 53(22): 1944-1951.
[14] Yang W Z, Hu Y, Wu W Y,. Saponins in the genusL. (Araliaceae): A systematic review of their chemical diversity [J]., 2014, 106: 7-24.
[15] Cho J G, Lee D Y, Shrestha S,. Three new ginsenosides from the heat-processed roots of[J]., 2013, 49(5): 882-887.
[16] Kasai R, Besso H, Tanaka O, et al. Saponins of red ginseng [J]. Chem Pharm Bull, 1983, 31(6): 2120-2125.
[17] Besso H, Kasai R, Saruwatari Y,. Ginsenoside-Ra1 and ginsenoside-Ra2, new dammarane-saponins of ginseng roots [J]., 1982, 30(7): 2380-2385.
[18] Matsuura H, Kasai R, Tanaka O,. Further studies on dammarane-saponins of ginseng roots [J]., 1984, 32(3): 1188-1192.
[19] Zhu G Y, Li Y W, Hau D K,. Acylated protopanaxadiol-type ginsenosides from the root of[J]., 2011, 8(10): 1853-1863.
[20] Tung N H, Yang S Y, Kim J A,. Dammarane-type saponins from the black ginseng [J]., 2010, 31(11): 3423-3426.
[21] 钟方丽. 林下参化学成分及其生物活性的研究[D] 长春: 吉林大学, 2008.
[22] Sanada S, Kondo N, Shoji J,. Studies on the saponins of ginseng. I. structures of ginsenoside-ro, -Rb1, -Rb2, -Rc and -Rd [J]., 1974, 22(2): 421-428.
[23] Sanada S, Shoji J. Studies on the saponins of ginseng. III. Structures of ginsenoside-Rb3and 20-glucoginsenoside- Rf [J]., 1978, 26(6): 1694-1697.
[24] Kim D S, Chang Y J, Zedk U,. Dammarane saponins from[J]., 1995, 40(5): 1493-1497.
[25] Lee J G, Lee Y Y, Kim S Y,. Platelet antiaggregating activity of ginsenosides isolated from processed ginseng [J]., 2009, 64(9): 602-604.
[26] Vinh L B, Lee Y, Han Y K,. Two new dammarane-type triterpene saponins from Korean red ginseng and their anti-inflammatory effects [J]., 2017, 27(23): 5149-5153.
[27] Baek N I, Kim J M, Park J H,. Ginsenoside Rs(3), a genuine dammarane-glycoside from Korean red ginseng [J]., 1997, 20(3): 280-282.
[28] Lee D G, Lee A Y, Kim K T,. Novel dammarane-type triterpene saponins fromroot [J]., 2015, 63(11): 927-934.
[29] Ruan C C, Liu Z, Li X,. Isolation and characterization of a new ginsenoside from the fresh root ofginseng [J]., 2010, 15(4): 2319-2325.
[30] Kitagawa I, Taniyama T, Hayashi T,. Malonyl-ginsenosides Rb1, Rb2, Rc, and Rd, four new malonylated dammarane-type triterpene oligoglycosides from ginseng[J]., 1983, 31(9): 3353-3356.
[31] 孙光芝, 李向高, 刘志, 等. 人参根中丙二酰基三七人参皂苷-R4的分离及其结构表征 [J]. 高等学校化学学报, 2007, 28(7): 1316-1318.
[32] 王洪平, 杨鑫宝, 杨秀伟, 等. 吉林人参根和根茎的化学成分研究 [J]. 中国中药杂志, 2013, 38(17): 2807-2817.
[33] Yang W Z, Ye M, Qiao X,. A strategy for efficient discovery of new natural compounds by integrating orthogonal column chromatography and liquid chromatography/mass spectrometry analysis: Its application in,andto characterize 437 potential new ginsenosides [J]., 2012, 739: 56-66.
[34] Yang M C, Seo D S, Hong J,. Ginsenosides from the roots of Korean cultivated-wild ginseng [J]., 2008, 14(3): 171-176.
[35] Zhu G Y, Li Y W, Hau D K,. Protopanaxatriol-type ginsenosides from the root of[J]., 2011, 59(1): 200-205.
[36] Yahara S, Kaji K, Tanaka O. Further study on dammarane-type saponins of roots, leaves, flower-buds, and fruits ofginseng C.A. Meyer [J]., 1979, 27(1): 88-92.
[37] 朱海林. 野山参化学成分及抗慢性阻塞性肺疾病活性的研究[D]. 长春: 吉林大学: 2020.
[38] Zhou Q L, Yang X W. Four new ginsenosides from red ginseng with inhibitory activity on melanogenesis in melanoma cells [J]., 2015, 25(16): 3112-3116.
[39] 张庆贺, 卢丹, 李平亚, 等. 奥克梯隆型皂苷的研究概况 [J]. 人参研究, 2011, 23(4): 47-51.
[40] Li W, Gu C, Zhang H,. Use of high-performance liquid chromatography-tandem mass spectrometry to distinguishC. A. Meyer (Asian ginseng) andL. (North American ginseng) [J]., 2000, 72(21): 5417-5422.
[41] Kim S E, Lee Y H, Park J H,. Ginsenoside-Rs4, a new type of ginseng saponin concurrently induces apoptosis and selectively elevates protein levels of p53 and p21WAF1in human hepatoma SK-HEP-1 cells [J]., 1999, 35(3): 507-511.
[42] Qi Z, Li Z, Guan X W,. Four novel dammarane-type triterpenoids from pearl knots ofMeyer cv. silvatica [J]., 2019, 24(6): 1159.
[43] Lee S M, Shon H J, Choi C S,. Ginsenosides from heat processed ginseng [J]., 2009, 57(1): 92-94.
[44] Baek N I, Kim J M, Park J H,. Ginsenoside Rs(3), a genuine dammarane-glycoside from Korean red ginseng [J]., 1997, 20(3): 280-282.
[45] Ryu J H, Park J H, Eun J H,. A dammarane glycoside from Korean red ginseng [J]., 1997, 44(5): 931-933.
[46] Lee D G, Lee J, Cho I H,. Ginsenoside Rg12, a new dammarane-type triterpene saponin fromroot [J]., 2017, 41(4): 531-533.
[47] Ryu J H, Park J H, Kim T H,. A genuine dammarane glycoside, (20E)-ginsenoside F4from Korean red ginseng [J]., 1996, 19(4): 335-336.
[48] Park J D, Lee Y H, Kim S I. Ginsenoside Rf2, a new dammarane glycoside from Korean red ginseng () [J]., 1998, 21(5): 615-617.
[49] Baek N I, Kim D S, Lee Y H,. Ginsenoside Rh4, a genuine dammarane glycoside from Korean red ginseng [J]., 1996, 62(1): 86-87.
[50] Baek S H, Piao X L, Lee U J,. Reduction of Cisplatin-induced nephrotoxicity by ginsenosides isolated from processed ginseng in cultured renal tubular cells [J]., 2006, 29(10): 2051-2055.
[51] Park I H, Kim N Y, Han S B,. Three new dammarane glycosides from heat processed ginseng [J]., 2002, 25(4): 428-432.
[52] Wang H P, Yang X B, Yang X W,. Ginsenjilinol, a new protopanaxatriol-type saponin with inhibitory activity on LPS-activated NO production in macrophage RAW 264.7 cells from the roots and rhizomes of[J]., 2013, 15(5): 579-587.
[53] Zheng Q, Li Z, Liu J P,. Two new dammarane-type triterpene sapogenins from Chinese red ginseng [J]., 2016, 30(1): 95-99.
[54] 左甜甜, 李威威, 李雪, 等. 人参中1个新的齐墩果酸型皂苷 [J]. 中草药, 2020, 51(14): 3623-3632.
[55] 富力, 李向高, 杨守仁. 人参中齐墩果酸型新皂甙的分离鉴定 [J]. 吉林农业大学学报, 1998, 20(2): 30-34.
[56] Zhang H J, Lu Z Z, Tan G T,. Polyacetyleneginsenoside-Ro, a novel triterpene saponin from[J]., 2002, 43(6): 973-977.
[57] Chung I M, Kim Y O, Ali M,. Triterpene glycosides from red ginseng marc and their anti-inflammatory activities [J]., 2014, 24(17): 4203-4208.
[58] Chung I M, Yang S X, Kim S H,. New chemical constituent fromroots [J]., 2014, 26(22): 7789-7791.
[59] Ali M, Sultana S. Phytochemical investigation of the roots ofC. A. Meyer [J]., 2016, 5(4): 1-5.
Research progress on the distribution of ginsenosides in different commercial ginseng
LV Chong-ning, LU Jin-cai
School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang, 110016, China
There are many kinds of commercial ginseng. A large number of studies have proved that commercial ginseng with different habitat, growth mode, harvest years, transplanting times and processing methods will have differences in characters. The embodiment of this difference in the pharmacodynamic substance basis is the difference in the type and content of ginsenosides. However, the relevant literatures mainly focused on the isolation, purification, identification, and content analysis of ginsenosides in garden ginseng, sundried ginseng and red ginseng so far. Therefore, in this paper, the main chemical components of ginsenosides in different ginseng, such as garden ginseng, mountain cultivated ginseng and red ginseng, were systematically reviewed, and the distribution of ginsenosides in various commercial ginseng was clarified, so as to provide help for the study of the pharmacodynamic substances basis and activity comparison between different commercial ginseng in the future.
Commercial ginseng; ginsenosides; distribution; different habitats; growth patterns; growth years; number of transplants
R282
A
0253 - 2670(2021)17 - 5329 - 10
10.7501/j.issn.0253-2670.2021.17.025
2021-08-01
国家重点研发计划项目:林下山参质量标准及药效物质基础研究(课题编号:2017YFC1702302)
吕重宁(1986—),男,博士,副教授,硕士生导师,主要从事道地药材资源和中药创新药物研究。E-mail: lcnmi@outlook.com
路金才(1971—),男,博士,沈阳药科大学57期中药制药本科专业,硕士和博士就读于生药学专业校友,教授,博士生导师,沈阳药科大学中药学院院长,主要从事道地药材资源和中药创新药物研究。E-mail: jincailu@126.com
[责任编辑 时圣明]
