大叶铁线莲乙醇提取物正丁醇部位的化学成分研究
2021-09-06陆云阳汤海峰
张 倩,陆云阳,刘 杨,汤海峰
大叶铁线莲乙醇提取物正丁醇部位的化学成分研究
张 倩,陆云阳,刘 杨,汤海峰*
空军军医大学 药学系,中药与天然药物学教研室,陕西 西安 710032
研究大叶铁线莲全草的化学成分。利用硅胶、Sephadex LH-20凝胶、ODS反相柱色谱和半制备高效液相色谱等分离方法进行分离纯化,结合核磁共振、质谱等波谱学技术鉴定其化学结构。从大叶铁线莲全草75%乙醇提取物的正丁醇萃取部位分离鉴定了10个化合物,包括三萜皂苷6个、黄酮苷1个、木栓烷型三萜2个和植物甾醇1个,分别为3,23-二羟基-齐墩果-18-烯-28-酸--α--吡喃鼠李糖基-(1→4)-β--吡喃葡萄糖基-(1→6)-β--吡喃葡萄糖苷(1)、刺楸皂苷B(2)、粗齿铁线莲皂苷B(3)、刺五加苷A1(4)、皂苷PJ3(5)、异株五加苷B(6)、金丝桃苷(7)、木栓酮(8)、表木栓醇(9)和β-谷甾醇(10)。化合物1是新化合物,命名为大叶铁线莲皂苷D;化合物2~9均为首次从大叶铁线莲中分离得到。
大叶铁线莲;3,23-二羟基-齐墩果-18-烯-28-酸--α--吡喃鼠李糖基-(1→4)-β--吡喃葡萄糖基-(1→6)-β--吡喃葡萄糖苷;大叶铁线莲皂苷D;刺楸皂苷B;粗齿铁线莲皂苷B;刺五加苷A1;木栓酮
毛茛科(Ranunculaceae)铁线莲属L.植物在全球分布广泛,有350多种,其中93种为我国特有,85种为药用植物[1-2]。该属植物自古因其利尿通淋、祛风止痛的药用价值而被广泛使用,如《证类本草》中记载的川木通和最早收录在《集验方》中的威灵仙[3-4]。《中国药典》2020年版也收载了川木通和威灵仙[5]。大叶铁线莲DC. 作为铁线莲属药用植物,主要分布于我国华中和西南地区,常见于山坡沟谷、林边及路旁的灌丛中[6],常以全草或根茎入药,用于治疗风湿关节痛风、皮肤炎症、瘘管等病[7]。国内外学者对大叶铁线莲的化学成分研究较少,活性研究也以粗提物为主[8]。基于课题组前期对大叶铁线莲全草化学成分的初步探究[9],为了进一步明确其药效物质基础,从而为大叶铁线莲的开发与利用提供理论依据,本实验继续对其75%乙醇水提取物的正丁醇层萃取部位进行化学成分研究,共分离得到10个化合物,分别鉴定为3,23-二羟基-齐墩果-18-烯-28-酸--α--吡喃鼠李糖基-(1→4)-β--吡喃葡萄糖基-(1→6)-β--吡喃葡萄糖苷[3,23-dihydroxyolean-18-en-28-oic acid--α--rhamnopyransyl-(1→4)-β--glucopyranosyl- (1→6)-β--glucopyranoside,1]、刺楸皂苷B(kalopanax saponin B,2)、粗齿铁线莲皂苷B(clemargenoside B,3)、刺五加苷A1(ciwujianoside A1,4)、皂苷PJ3(saponin PJ3,5)、异株五加苷B(sieboldianoside B,6)、金丝桃苷(hyperin,7)、木栓酮(friedelin,8)、表木栓醇(epifriedelinol,9)和β-谷甾醇(βsitosterol,10)。化合物1是新化合物,命名为大叶铁线莲皂苷D,化合物2~9均为首次从大叶铁线莲中分离鉴定。
1 仪器与材料
电子分析天平(赛多利斯科学仪器公司);XT5型显微熔点测定仪(北京科仪电光仪器厂);Quatrro 质谱仪(Micromass公司);PL343型旋光仪(Perkin-Elmer公司);AVANCE 500型超导核磁共振仪、AVANCE 800型超导核磁共振仪(Bruker公司);戴安P680高效液相色谱仪(戴安公司,P680系列单泵、UV-VS检测器、CHROMELON工作站);Agilent GC-6820气相色谱仪 [Agilent公司,配HP-5弹性石英毛细管柱(30 m×0.32 mm,0.25 μm),氢火焰离子化检测器];柱色谱硅胶(100~200、200~300目,青岛海洋化工厂);薄层色谱用硅胶H(青岛海洋化工厂);Rp-18高效薄层预制硅胶板G(Merck公司);ODS C18填料(Pharmacia公司);Sephadex LH-20柱(北京欧亚新技术公司);-(三甲基硅基)咪唑(Sigma公司);对照品-葡萄糖(-Glc)、-核糖(-Rib)、-鼠李糖(-Rha)、-阿拉伯糖(-Ara)和-木糖(-Xyl),Sigma公司;试剂均为分析纯;制备液相所用试剂均为色谱纯。
药材于2014年9月采自陕西省宝鸡市太白山,经陕西中医药大学王继涛教授鉴定为大叶铁线莲DC. 的全草,标本(20140909)存于空军军医大学药学系中药与天然药物学教研室。
2 提取与分离
取干燥大叶铁线莲全草6 kg,粉碎,用10倍体积的75%乙醇加热回流提取3次,每次2 h,合并滤液并减压蒸馏至无醇味,将得到的浸膏加水分散,水溶液用等体积石油醚萃取4次,回收石油醚层,再加入等体积的水饱和正丁醇萃取3次,合并正丁醇层溶液,减压蒸馏得到浸膏130 g。取100 g浸膏用硅胶拌样后进行硅胶柱色谱分离,用三氯甲烷-甲醇-水系统(50∶1∶0~65∶35∶10)梯度洗脱,得到12个组分(Fr. A~L)。Fr. A采用Sephadex LH-20柱色谱分离,流动相为三氯甲烷-甲醇(1∶1),得到化合物8(32 mg)、9(70 mg)和10(110 mg);Fr. F进行Sephadex LH-20柱色谱,三氯甲烷-甲醇(1∶1)洗脱除去杂质,再进行半制备高效液相色谱分离,流动相为85%甲醇,得到化合物7(R=10.3 min,32 mg);Fr. G进行硅胶柱色谱,用三氯甲烷-甲醇-水系统(10∶1∶0~8∶1∶0.1)梯度洗脱,再结合Sephadex LH-20柱色谱和半制备高效液相色谱(流动相为65%甲醇)分离,得到化合物5(R=12.9 min,18 mg);Fr. J利用Sephadex LH-20柱色谱和ODS反相柱色谱(依次以30%、50%和70%甲醇洗脱)分离,结合半制备高效液相色谱(流动相为35%甲醇)纯化,得到化合物2(R=18.7 min,3 mg)、3(R=16.2 min,8 mg)和4(R=14.5 min,16 mg);Fr. K通过硅胶柱色谱,以三氯甲烷-甲醇-水系统(8∶2∶0.2~7∶2.5∶0.25)梯度洗脱,再结合Sephadex LH-20柱色谱和半制备高效液相色谱(流动相为65%甲醇)分离,得到化合物6(R=20.6 min,34 mg);Fr. L利用Sephadex LH-20柱色谱、ODS反相柱色谱(依次以30%、50%、70%甲醇溶液洗脱)分离,结合半制备高效液相色谱(流动相为55%甲醇)纯化,得到化合物1(R=33.3 min,30 mg)。
3 皂苷类化合物酸水解
称取化合物1~6各1.5 mg分别加入2 mL三氟乙酸(2 mol/L)中,120 ℃加热2 h,蒸干溶剂,分别向反应物中加入二氯甲烷和水进行萃取。蒸干水层,向残留物中加入1 mL无水吡啶溶液和2 mL-半胱氨酸甲酯盐酸盐的无水吡啶溶液(0.1 mol/L),60 ℃加热2 h,氮气吹干;加入1 mL吡啶和0.5 mL-(三甲基硅基)咪唑,60 ℃加热1 h,蒸干溶液,以正己烷和水萃取,有机相层进行GC分析(气化室250 ℃;柱温180~250 ℃,5 ℃/min;检测器280 ℃;进样量1 µL;载气为氮气)[10]。通过比较标准糖衍生物和样品单糖衍生物的保留时间确定化合物中的单糖的种类。标准糖衍生物的保留时间分别为-Glc为16.78 min、-Ara为9.65 min、-Xyl为13.43 min、-Rha为12.31 min和-Rib为9.16 min。
4 结构鉴定
1H-NMR (500 MHz, pyridine-5) 数据(表1)高场区显示6个角甲基的信号峰H0.83、0.95、0.99、1.05、1.05和1.17,1个烯氢的宽单峰信号H5.25 (1H, brs, H-19)。在HSQC谱中可依次找到相应的6个角甲基碳信号C15.6、17.7、29.5、13.3、16.8和31.0。结合13C-NMR (125 MHz, pyridine-5) 谱C175.8 (C-28) 和C73.7 (C-3) 信号,提示C-28位形成酯苷键,C-3位未形成氧苷键。推测化合物1为齐墩果烷型皂苷。在HMBC谱(图1)中,H2.30 (H-21) 和1.42 (H-16) 信号与C138.2信号存在远程偶合关系,而H5.25信号与C41.6 (C-13)、49.1 (C-17)、33.9 (C-21)、32.6 (C-20)、29.5 (C-29) 和31.0 (C-30) 均存在相关峰,因此可以推测双键位置在C-18(19) 位。结合1H-1H COSY、HMBC、TOCSY、HSQC、NOESY谱,可归属苷元上的所有碳、氢信号(表1)。对照文献报道[11]的具有C-18(19) 双键的金盏花皂苷A(calendasaponin A),其碳谱数据基本一致,进一步验证了化合物1的苷元结构与该化合物相同,即黄莲木酸。对化合物1进行酸水解后制备衍生物[12-13],经GC分析,确定化合物1所含糖为-Glc、-Rha,比例为2∶1。1H-NMR谱中发现3个糖的端基氢信号H6.36 (1H, d,= 8.5 Hz, GlcI-H-1) 5.85 (1H, brs, Rha-H-1), 4.95 (1H, d,= 8.0 Hz, GlcII-H-1);HSQC谱匹配到相应糖基的端基碳信号:C96.2 (GlcI-C-1), 103.1 (Rha-C-1), 105.3 (GlcII-C-1)。由葡萄糖基端基氢偶合常数= 8.5 Hz可得糖苷键的相对构型为β;鼠李糖基的端基氢信号为宽单峰,3位和5位碳的化学位移值分别为:C73.1 (Rha-C-3) 和C70.6 (Rha-C-5),可判断出相应糖苷键为α构型[14]。结合TOCSY谱,可通过1H-1H COSY谱归属所有糖基的氢信号,再通过HSQC谱归属了所有糖基的碳信号。HMBC谱中,可观察到GlcI-H-1/C-28, GlcII-H-1/GlcI-C-6以及Rha-H-1/ GlcII-C-4相关,从而确定了糖基与苷元和各糖基之间的连接位点与顺序。这些信息可以通过NOESY谱得到进一步的验证,见图1。
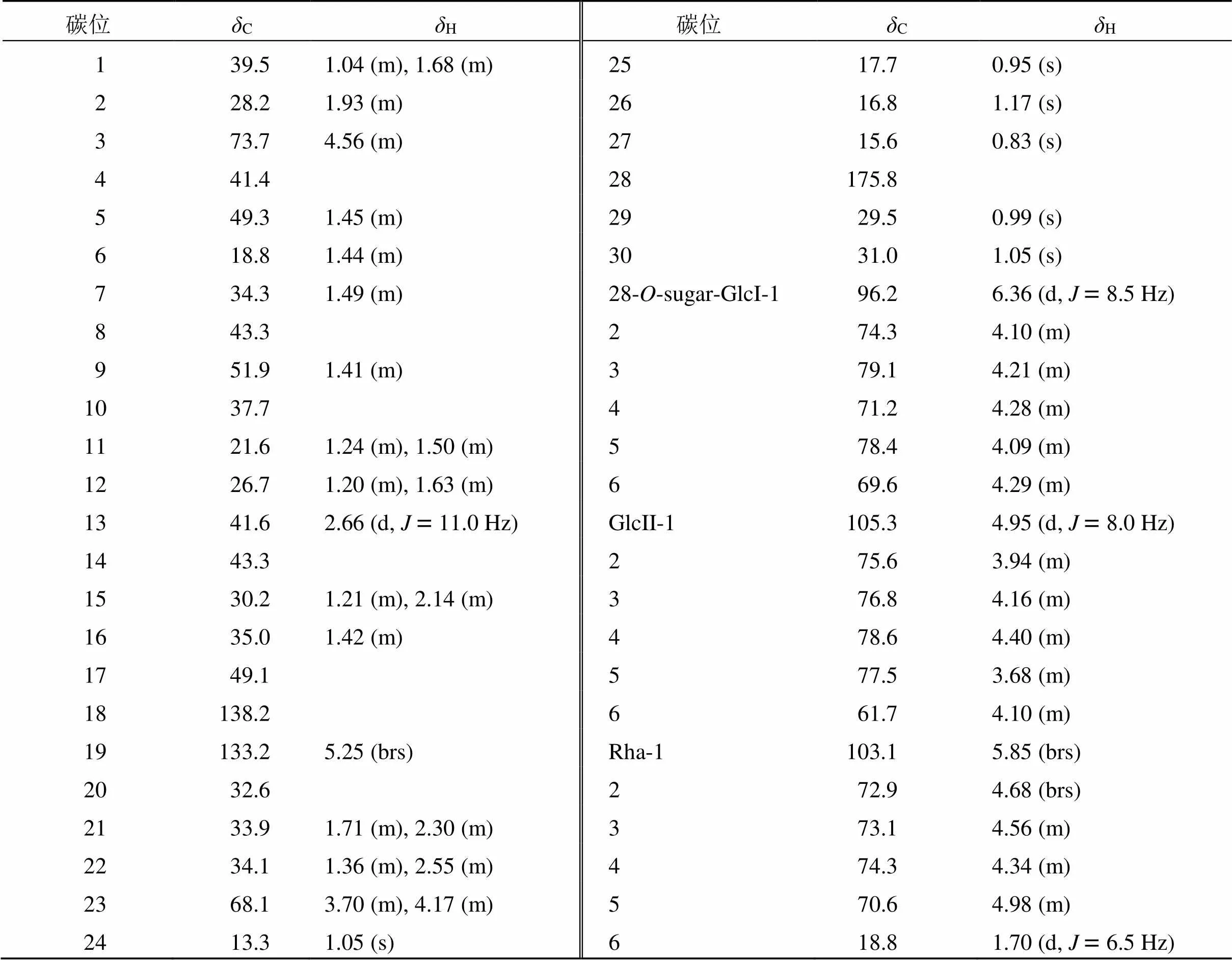
表1 化合物1的13C-NMR (125 MHz) 和1H-NMR (500 MHz) 数据

图1 化合物1的结构式及主要HMBC和NOESY相关
综上,化合物1结构鉴定为3,23-二羟基-齐墩果-18-烯-28-酸--α--吡喃鼠李糖基-(1→4)-β--吡喃葡萄糖基-(1→6)-β--吡喃葡萄糖苷,经SciFinder数据库查询,确定其为新化合物,命名为大叶铁线莲D(clemahergenoside D)。
化合物5:白色无定形粉末,易溶于吡啶和甲醇;Lieberman-Buchard反应与Molish反应均呈阳性,与10%硫酸显色剂呈紫红色;ESI-MS/: 1203 [M-H]−。采用与化合物1相同方法进行酸水解,检出Glc、Rha和Ara,经过GC分析确定它们的比例为2∶2∶1。1H-NMR (800 MHz, pyridine-5): 0.91 (3H, s, H-25), 0.92 (3H, s, H-29), 0.93 (3H, s, H-30), 0.98 (3H, s, H-26), 1.11 (3H, s, H-24), 1.26 (3H, s, H-27), 1.29 (3H, s, H-23), 5.40 (1H, brs, H-12), 5.80 (1H, brs, 3--Ara-H-1), 6.27 (1H, brs, 3--Rha-H-1), 6.18 (1H, d,= 8.0 Hz, 28-- GlcI-H-1), 5.02 (1H, d,=7.4 Hz, 28--GlcII-H-1), 4.80 (1H, d,= 6.0 Hz, 28--Rha-H-1);13C-NMR (200 MHz, pyridine-5): 38.8 (C-1), 26.5 (C-2), 88.5 (C-3), 39.3 (C-4), 55.6 (C-5), 18.3 (C-6), 33.0 (C-7), 39.8 (C-8), 48.0 (C-9), 36.8 (C-10), 23.6 (C-11), 123.0 (C-12), 144.0 (C-13), 41.9 (C-14), 28.1 (C-15), 23.2 (C-16), 46.8 (C-17), 41.5 (C-18), 46.0 (C-19), 30.5 (C-20), 33.8 (C-21), 32.3 (C-22), 28.0 (C-23), 16.8 (C-24), 15.3 (C-25), 17.3 (C-26), 25.8 (C-27), 176.3 (C-28), 33.0 (C-29), 23.5 (C-30)。由HMBC谱发现糖链连接顺序为C-3位Rha(1→2)Ara-和C-28位Rha(1→4)GlcII(1→6)GlcI-, 104.3 (3--Ara-C-1), 75.3 (3--Ara-C-2), 73.9 (3--Ara-C-3), 68.6 (3--Ara-C-4), 64.5 (3--Ara-C-5), 101.3 (3--Rha-C-1), 72.6 (3--Rha-C-2), 72.4 (3--Rha-C-3), 73.8 (3-Rha-C-4), 70.0 (3--Rha-C-5), 18.3 (3--Rha-C-6), 95.8 (28--GlcI-C-1), 73.5 (28--GlcI-C-2), 78.3 (28--GlcI-C-3), 70.7 (28--GlcI-C-4), 78.0 (28--GlcI-C-5), 69.0 (28--GlcI-C-6), 104.7 (28--GlcII-C-1), 75.3 (28--GlcII-C-2), 76.4 (28--GlcII-C-3), 78.0 (28--GlcII-C-4), 76.9 (28--GlcII-C-5), 61.0 (28--GlcII-C-6), 102.6 (28--Rha-C-1), 72.4 (28--Rha-C-2), 72.3 (28--Rha-C-3), 73.8 (28--Rha-C-4), 69.7 (28--Rha-C-5), 18.3 (28--Rha-C-6)。以上波谱数据与文献数据基本一致[18],故鉴定化合物5为皂苷PJ3。
化合物6:白色无定形粉末,易溶于吡啶和甲醇,Lieberman-Buchard反应与Molish反应均呈阳性,与10%硫酸显色剂呈紫红色,ESI-MS/: 1335 [M-H]−。采用与化合物1相同方法进行酸水解,检出Glc、Rha、Xyl和Ara,经过GC分析确定它们的比例为2∶2∶1∶1。1H-NMR (800 MHz, pyridine-5): 0.90 (3H, s, H-25), 0.91 (3H, s, H-29), 0.93 (3H, s, H-30), 0.97 (3H, s, H-26), 1.12 (3H, s, H-24), 1.27 (3H, s, H-27), 1.28 (3H, s, H-23), 5.42 (1H, brs, H-12), 5.87 (1H, brs, 3--Ara-H-1), 6.32 (1H, brs, 3--Rha-H-1), 6.25 (1H, brs, 3--Xyl-H-1), 5.01 (1H, d,= 8.0 Hz, 28--GlcI-H-1), 4.85 (1H, d,= 6.4 Hz, 28--GlcII-H-1), 5.37 (1H, d,= 7.6 Hz, 28--Rha-H-1);13C-NMR (200 MHz, pyridine-5): 39.2 (C-1), 27.0 (C-2), 89.1 (C-3), 39.9 (C-4), 56.3 (C-5), 18.8 (C-6), 33.4 (C-7), 40.2 (C-8), 48.3 (C-9), 37.3 (C-10), 24.1 (C-11), 123.2 (C-12), 144.4 (C-13), 42.4 (C-14), 28.6 (C-15), 23.6 (C-16), 47.3 (C-17), 41.9 (C-18), 46.5 (C-19), 31.0 (C-20), 34.3 (C-21), 32.8 (C-22), 28.5 (C-23), 17.5 (C-24), 16.0 (C-25), 17.8 (C-26), 26.4 (C-27), 176.9 (C-28), 33.4 (C-29), 24.0 (C-30)。经过HMBC谱发现糖链连接顺序为:C-3位Xyl(1→3)Rha(1→2)Ara-和C-28 Rha(1→4)GlcII(1→6)GlcI-, 105.6 (3--Ara-C-1), 75.6 (3--Ara-C-2), 75.2 (3--Ara-C-3), 69.8 (3--Ara-C-4), 65.5 (3--Ara-C-5), 101.7 (3--Rha-C-1),72.4 (3--Rha-C-2), 81.5 (3-Rha-C-3), 73.1 (3--Rha-C-4), 70.2 (3--Rha-C-5), 18.8 (3--Rha-C-6), 106.7 (3--Xyl-C-1), 75.3 (3--Xyl-C-2), 78.4 (3--Xyl-C-3), 70.9 (3--Xyl-C-4), 66.1 (3--Xyl-C-5), 95.9 (28--GlcI-C-1), 74.2 (28--GlcI-C-2), 79.0 (28--GlcI-C-3), 71.1 (28--GlcI-C-4), 78.3 (28--GlcI-C-5), 69.4 (28--GlcI-C-6), 105.1 (28--GlcII-C-1), 75.6 (28--GlcII-C-2), 76.8 (28--GlcII-C-3), 78.5 (28--GlcII-C-4), 77.4 (28--GlcII-C-5), 61.5 (28--GlcII-C-6), 103.0 (28--Rha-C-1), 72.9 (28--Rha-C-2), 73.0 (28--Rha-C-3), 74.3 (28--Rha-C-4), 70.6 (28--Rha- C-5), 18.8 (28--Rha-C-6)。以上波谱数据与文献数据基本一致[19],故鉴定化合物6为异株五加苷B。
化合物7:淡黄色晶体(氯仿-甲醇),易溶于二甲基亚砜,mp 225~226 ℃;Molish反应呈阳性;ESI-MS/487 [M+Na]+, 463 [M-H]−,推测分子式为C21H20O12。1H-NMR (500 MHz, DMSO-6): 12.63 (1H, s, 5-OH), 10.88 (1H, s, 7-OH), 9.76 (1H, s, 4′-OH), 9.10 (1H, s, 3′-OH), 7.64 (1H, dd,= 8.2, 1.6 Hz, H-6′), 7.51 (1H, d,= 1.6 Hz, H-2′), 6.80 (1H, d,= 8.3 Hz, H-5′), 6.44 (1H, d,= 2.0 Hz, H-6), 6.24 (1H, d,= 2.0 Hz, H-8), 5.43 (1H, d,= 7.8 Hz, H-1′′), 5.20 (1H, d,= 4.5 Hz, 4′′-OH), 4.88 (1H, d,= 5.5 Hz, 2′′-OH), 4.43 (2H, m, 3′′, 6′′-OH), 3.64 (1H, m, H-6′′b), 3.62 (1H, m, H-6′′a), 3.50 (1H, m, H-5′′), 3.39 (1H, m, H-4′′), 3.37 (1H, m, H-2′′), 3.30 (1H, m, H-3′′);13C-NMR (125 MHz, DMSO-6): 156.4 (C-2), 133.7 (C-3), 177.9 (C-4), 161.4 (C-5), 98.9 (C-6), 164.2 (C-7), 93.7 (C-8), 156.4 (C-9), 103.9 (C-10), 122.0 (C-1′), 115.2 (C-2′), 144.9 (C-3′), 148.5 (C-4′), 115.9 (C-5′), 120.9 (C-6′), 101.7 (C-1′′), 71.1 (C-2′′), 73.1 (C-3′′) , 67.9 (C-4′′), 75.8 (C-5′′), 60.1 (C-6′′)。以上波谱数据与文献数据基本一致[20],故鉴定化合物7为金丝桃苷。
化合物8:白色针状结晶(石油醚-丙酮),易溶于石油醚和氯仿,mp 257~258 ℃;与10%硫酸甲醇显色剂反应呈紫红色。ESI-MS/449 [M+Na]+,推测分子式为C30H50O。1H-NMR (500 MHz, CDCl3): 0.70 (3H, s, H-24), 0.83 (3H, s, H-25), 0.84 (3H, d,= 6.2 Hz, H-23), 0.94 (3H, s, H-26), 0.97 (3H, s, H-27), 0.98 (3H, s, H-28);13C-NMR (125 MHz, CDCl3): 22.2 (C-1), 41.6 (C-2), 213.1 (C-3), 58.1 (C-4), 42.2 (C-5), 41.2 (C-6), 18.3 (C-7), 53.0 (C-8), 37.4 (C-9), 59.4 (C-10), 35.7 (C-11), 30.4 (C-12), 39.6 (C-13), 38.2 (C-14), 32.4 (C-15), 35.9 (C-16), 29.8 (C-17), 42.7 (C-18), 35.2 (C-19), 28.3 (C-20), 32.7 (C-21), 39.3 (C-22), 6.8 (C-23), 14.5 (C-24), 17.8 (C-25), 20.3 (C-26), 18.7 (C-27), 32.0 (C-28), 35.1 (C-29), 31.8 (C-30)。以上波谱数据与文献数据基本一致[21],故鉴定化合物8为木栓酮。
化合物9:白色针状晶体(甲醇),易溶于三氯甲烷,mp 284~286 ℃;与10%硫酸甲醇显色剂反应呈紫红色。ESI-MS正离子模式下/451 [M+Na]+,推测分子式为C30H52O。1H-NMR (500 MHz, CDCl3) 谱可观察到8个甲基峰1.19 (3H, s, H-28), 1.02 (3H, s, H-27), 1.01 (3H, s, H-26), 0.99 (3H, s, H-29), 0.98 (3H, s, H-30), 0.93 (3H, s, H-23), 0.92 (3H, s, H-25)和0.87 (3H, s, H-24),3.73是C-3位的氢;13C-NMR (125 MHz, CDCl3): 22.2 (C-1), 35.3 (C-2), 72.6 (C-3), 49.3 (C-4), 37.3 (C-5), 41.7 (C-6), 17.6 (C-7), 53.4 (C-8), 37.9 (C-9), 61.0 (C-10), 35.5 (C-11), 30.4 (C-12), 38.3 (C-13), 39.6 (C-14), 32.2 (C-15), 36.0 (C-16), 30.0 (C-17), 42.7 (C-18), 35.2 (C-19), 28.0 (C-20), 32.7 (C-21), 39.3 (C-22), 11.5 (C-23), 16.3 (C-24), 18.0 (C-25), 18.5 (C-26), 20.0 (C-27), 31.9 (C-28), 35.2 (C-29), 32.3 (C-30)。以上波谱数据与文献数据基本一致[22],故鉴定化合物9为表木栓醇。
化合物10:无色针状结晶(氯仿),易溶于甲醇;mp 136~139 ℃,Lieberman-Buchard反应呈阳性,与10%硫酸显色剂呈紫红色反应;经与对照品β-谷甾醇共薄层,在3种溶剂系统中与对照品Rf值相同,且混合熔点不下降,故鉴定化合物10为β-谷甾醇。
利益冲突 所有作者均声明不存在利益冲突
[1] 李杨, 张伟, 赫雪锋, 等. 铁线莲属植物的化学成分及药理作用研究进展 [J]. 中南药学, 2018, 16(3): 355-362.
[2] 刘慧, 张钦德. 铁线莲属药用植物的研究进展 [J]. 安徽农业科学, 2012, 40(27): 13324-13327.
[3] 乌兰其其格, 白玉华. 川木通的研究进展 [J]. 中国民族医药杂志, 2015, 21(1): 30-32.
[4] 徐涛, 万德光. 威灵仙本草新考 [J]. 中药材, 2001, 24(4): 293-294.
[5] 中国药典[S]. 一部. 2020: 38, 262
[6] 李璟琦, 马倩, 李濮. 秦岭铁线莲属植物资源及其利用研究 [J]. 陕西农业科学, 2016, 62(12): 1-5.
[7] 王文采. 铁线莲属研究随记 (I) [J]. 植物分类学报, 2000, 38(4): 305-336.
[8] 邢天天, 李春磊, 王义坤, 等. 大叶铁线莲提取物抗炎作用实验研究 [J]. 山东中医药大学学报, 2014, 38(5): 480-481.
[9] 张倩, 王玉梅, 邱瑞桂, 等. 大叶铁线莲全草中的化学成分研究 [J]. 中南药学, 2016, 14(1): 5-8.
[10] 樊培, 陆云阳, 刘杨, 等. 巴山重楼的皂苷类化学成分研究 [J]. 中南药学, 2021, 19(5): 794-800.
[11] Yoshikawa M, Murakami T, Kishi A,. Medicinal flowers. III. Marigold. (1): Hypoglycemic, gastric emptying inhibitory, and gastroprotective principles and new oleanane-type triterpene oligoglycosides, calendasaponins A, B, C, and D, from Egyptian[J]., 2001, 49(7): 863-870.
[12] 刘杨. 南重楼和毛重楼的化学成分研究 [D]. 西安: 中国人民解放军空军军医大学, 2018.
[13] 陆云阳. 面包海星中的甾体苷成分及其抗胶质瘤机制研究 [D]. 西安: 中国人民解放军空军军医大学, 2018.
[14] Zheng Q, Koike K, Han L K,. New biologically active triterpenoid saponins from[J]., 2004, 67(4): 604-613.
[15] 卢旭然, 刘烁, 王满元, 等. 五指那藤三萜类化学成分研究 [J]. 中国中药杂志, 2014, 39(23): 4629-4636.
[16] 赵美. 粗齿铁线莲的化学成分研究[D]. 沈阳: 沈阳药科大学, 2011.
[17] 王啸洋. 三种太白山药用植物的活性成分研究 [D]. 西安: 第四军医大学, 2014.
[18] 海文利. 九管血和粗齿铁线莲活性成分的研究 [D]. 西安: 第四军医大学, 2012.
[19] Kizu H, Shimana H, Tomimori T. Studies on the constituents ofspecies. VI. The constituents ofSieb. et Zucc [J]., 1995, 43(12): 2187-2194.
[20] 苑祥, 李震源, 梅丽娟, 等. 醉马草中黄酮类化学成分研究 [J]. 中草药, 2021, 52(4): 937-942.
[21] 陈君, 韦建华, 蔡少芳, 等. 白花鬼针草化学成分研究 [J]. 中药材, 2013, 36(3): 410-413.
[22] 赵明, 黄淑蕾, 徐阳宏, 等. 东北岩高兰中三萜类化学成分研究 [J]. 中草药, 2018, 49(1): 69-74.
Chemical constituents of-BuOH fraction from ethanolic extract of
ZHANG Qian, LU Yun-yang, LIU Yang, TANG Hai-feng
Department of Chinese Materia Medica and Natural Medicines, Pharmacy School, Air Force Medical University, Xi’an 710032, China
To investigate the chemical constituents from the whole plants of.The-BuOH part of 75% ethanol extraction of the whole plants was isolated by slilica gel, Sephadex LH-20, ODS column chromatographies and semi-preparative HPLC. The structures of compounds were identified by NMR, MS, and other spectroscopic techniques.Ten compounds, including 3,23-dihydroxyolean-18-en-28-oic acid--α--rhamnopyransyl-(1→4)-β-- glucopyranosyl-(1→6)-β--glucopyranoside (1), kalopanax saponin B (2), clemargenoside B (3), ciwujianoside A1(4), saponin PJ3(5), sieboldianoside B (6), hyperin (7), friedelin (8), epifriedelinol (9), and βsitosterol (10) were isolated and identified.Compound 1 is a new compound named clemahergenoside D, and compounds 2—9 are isolated from the whole plants offor the first time.
DC.; 3,23-dihydroxyolean-18-en-28-oic acid--α--rhamnopyranosyl-(1→4)-β--glucopyranosyl-(1→6)-β--glucopyranoside; clemahergenoside D; kalopanax saponin B; clemargenoside B; ciwujianoside A1; friedelin
R284.1
A
0253 - 2670(2021)17 - 5185 - 07
10.7501/j.issn.0253-2670.2021.17.008
2021-07-16
国家自然科学基金资助项目(81274029)
张 倩(1990—),女,博士,主要从事天然药化研究。Tel: 17791539129 E-mail: qianqiangoodok@163.com
汤海峰(1971—),男,沈阳药科大学1998级博士研究生药物化学专业校友。主任药师、教授,博士生导师,空军军医大学药物研究所所长、药学系中药与天然药物学教研室主任,空军军医大学中药学一级学科学科带头人,空军高层次科技人才;主要从事天然药化研究和中药、海洋药物开发,曾获得军队和省级科技奖励6项、社会力量办奖6项。Tel: (029)84711551 E-mail: tanghaifeng71@163.com
[责任编辑 王文倩]
