豫西地区猪伪狂犬病的分子流行病学调查与病毒分离鉴定
2021-09-06汪一平游一李天宇路海君李海利许保疆
汪一平,游一,李天宇,路海君,李海利,许保疆
(1. 河南省洛阳市嵩县动物卫生监督所,河南 洛阳 471400;2. 河南省农业科学院畜牧兽医研究所,河南 郑州 450002)
伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(pseudorabies virus,PRV)引起的以发热、脑脊髓炎、呼吸和神经系统障碍为主要特征的一种急性、热性、高度接触性传染病[1-2]。PRV可感染包括猪、牛、羊在内的40多种家畜和野生动物[3]。Ai等[4]研究表明PRV可感染人,并引起人的眼内炎;Liu等[5]从人的脑脊液中成功分离到首株人源PRV毒株(hSD-1/2019),为PRV向人群的跨物种传播提供了一定依据。猪是PRV的天然宿主、贮存宿主和传染源,PRV最早于1902年在匈牙利猪群中被发现,1947年传入我国,20世纪70年代我国引进了PRV弱毒活疫苗Bartha-K61株,经过疫苗免疫接种、扑杀等措施有效控制了PR的流行,但自2011年我国华北地区PRV弱毒活疫苗免疫猪场发生PRV感染疫情后,PRV变异毒株开始在全国范围内迅速流行,给我国养猪业造成了巨大的经济损失,其防控与净化形势非常严峻[6-9]。为了解豫西地区近年来PRV的分子流行病学、致病性和遗传变异情况,本研究通过PCR方法对2016—2020年采集于豫西地区的152份临床病料进行了PRV病原学检测与分析、病毒分离与鉴定、gE基因遗传变异分析等研究,丰富了豫西地区流行病学和流行毒株数据,为深入开展PRV流行规律、致病机制和防控研究奠定了基础。
1 材料与方法
1.1 样品来源
2016—2020年共收集豫西地区流产胎儿、病死猪组织病料(脑组织、淋巴结、扁桃体、肝脏、脾脏)样品共计152份(表1),经调查所有采集样品的猪场均免疫过PRVgE基因缺失疫苗。豫西地区2019年以前PRV的免疫程序一般为仔猪70日龄首免Bartha-K61株疫苗1头份,4周后加强免疫1头份;2019年以来PRV的免疫程序一般为仔猪断奶时首免变异毒株灭活疫苗1头份,4周后加强免疫1头份。

表1 豫西地区临床样品来源 份
1.2 菌株、细胞与试验动物
大肠杆菌DH5α、BHK-21细胞系,均由河南省嵩县动物疫病控制中心实验室保存;36只健康清洁级新西兰白兔,体重(2.54±0.14)kg,购自郑州大学实验动物中心。
1.3 主要试剂与试剂盒
pMD18-T载体、LATaq聚合酶、2×GC Buffer、dNTP Mixture、EcoRⅠ和Hind Ⅲ内切酶、DL2000 Marker,均购自宝生物工程(大连)有限公司;病毒基因组DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒,均购自北京百泰克生物科技有限公司。
1.4 引物设计与合成
根据参考文献[10]设计1对针对PRV疫苗中gE基因缺失的鉴别检测引物,根据参考文献[11]设计1对针对PRVgE全长扩增引物,引物序列见表2,引物由宝生物工程(大连)有限公司合成。
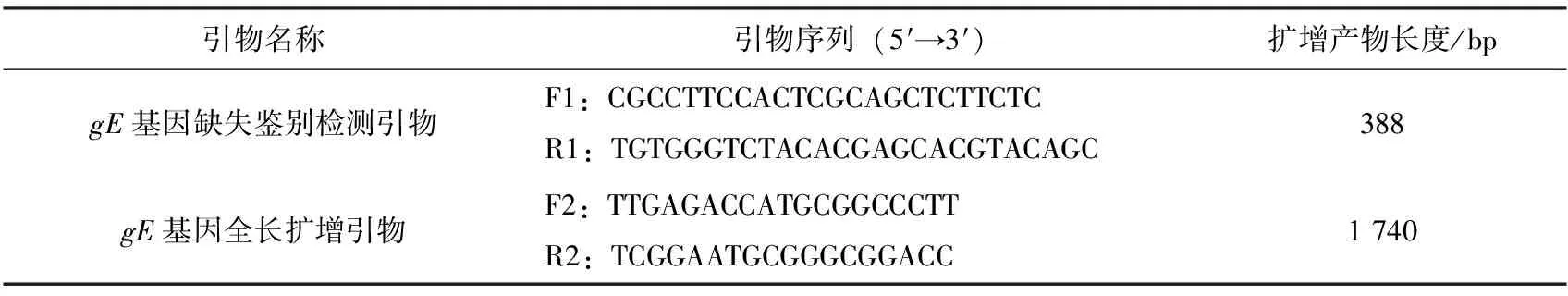
表2 引物信息
1.5 临床病料样品的处理
将采集的临床病料样品溶解于5倍体积灭菌PBS中,研磨成匀浆,反复冻融3次后,12 000 r/min离心5 min,取上清液经0.22 μm滤膜过滤除菌后即得处理后的临床样品。
1.6 临床样品的PCR扩增
利用病毒基因组DNA提取试剂盒依次提取152份临床样品的病毒基因组DNA,利用设计合成的gE基因缺失鉴别检测引物依次对152份DNA进行PCR扩增。PCR扩增体系为:2×GC Buffer 12.5 μL、LATaq聚合酶0.5 μL、dNTP Mixture 2.0 μL、引物F1/R1(终浓度为20 μmol/L)各0.5 μL、DNA 3.0 μL、H2O 6.0 μL。PCR扩增程序为:95 ℃ 5 min;95 ℃ 40 s,58 ℃ 40 s,72 ℃ 40 s,30个循环;72 ℃ 10 min。PCR扩增产物经10 g/L琼脂糖凝胶电泳检测分析。
1.7 PRV流行情况分析
根据PCR扩增结果,统计不同地区、不同年份PRV阳性感染率,分析不同地区、不同年份PRV的流行情况。
1.8 病毒分离与细胞病变观察
将PCR扩增为阳性的临床样品接种单层BHK-21细胞,以含2%胎牛血清的DMEM为培养维持液、置于37 ℃恒温培养箱中培养,每天观察细胞病变(CPE),待70%以上细胞出现CPE时,收获病毒液。如无CPE出现,则观察至120 h后收获病毒,连续盲传5代。
1.9 病毒含量测定
将收获的病毒液依次做10倍倍比稀释,每个稀释度分别接种96孔细胞培养板中的单层BHK-21细胞,每个稀释度接种8孔,每日观察细胞病变,按照Reed-Muench法计算TCID50。
1.10 致病性试验
将36只新西兰白兔随机分为9组,每组4只,试验1~8组分别经腿部肌肉注射分离毒株0.1 mL(含103TCID50);试验9组为对照组,腿部肌肉注射灭菌生理盐水0.1 mL。各试验组彼此间隔离饲养,观察至注射后14 d,每日记录各试验组兔的发病和死亡情况。采集死亡兔的脑、肝脏、脾脏等组织病料,采用1.6的方法对病料样品进行PCR检测。
1.11 gE基因序列分析
1.11.1 PCR扩增
利用病毒基因组DNA提取试剂盒依次提取分离毒株的病毒基因组DNA,利用gE基因全长扩增引物依次对8份DNA进行PCR扩增。PCR扩增体系为:2×GC Buffer 25.0 μL、LATaq聚合酶1.0 μL、dNTP Mixture 4.0 μL、引物F2/R2(终浓度为20 μmol/L)各1.0 μL、DNA 5.0 μL、H2O 13.0 μL。PCR扩增程序为:95 ℃ 5 min;95 ℃ 45 s,60 ℃ 45 s,72 ℃ 45 s,30个循环;72 ℃ 10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测分析。
1.11.2 克隆载体的构建与鉴定
将片段大小正确的分离毒株PCR扩增产物利用胶回收试剂盒回收纯化,将回收产物连接至大肠杆菌pMD18-T载体,连接产物转化至大肠杆菌DH5α感受态细胞,质粒提取试剂盒提取重组质粒,经EcoRⅠ和HindⅢ双酶切鉴定正确后,送宝生物(大连)工程有限公司进行序列测定。
1.11.3 遗传进化分析
利用DNAStar生物学分析软件对分离株gE基因序列与GenBank中登录的17株国内外PRV毒株(详见表3)gE基因序列进行同源性比较,构建遗传进化树,分析2016—2020年豫西地区PRV遗传变异特征。

表3 遗传进化分析所用毒株的信息
2 结果与分析
2.1 临床样品的PCR扩增
采用PCR方法对2016—2020年收集豫西地区的152份临床样品进行PRV野毒株感染的病原学检测,共计检测出阳性样品21份,部分样品电泳图如图1所示。
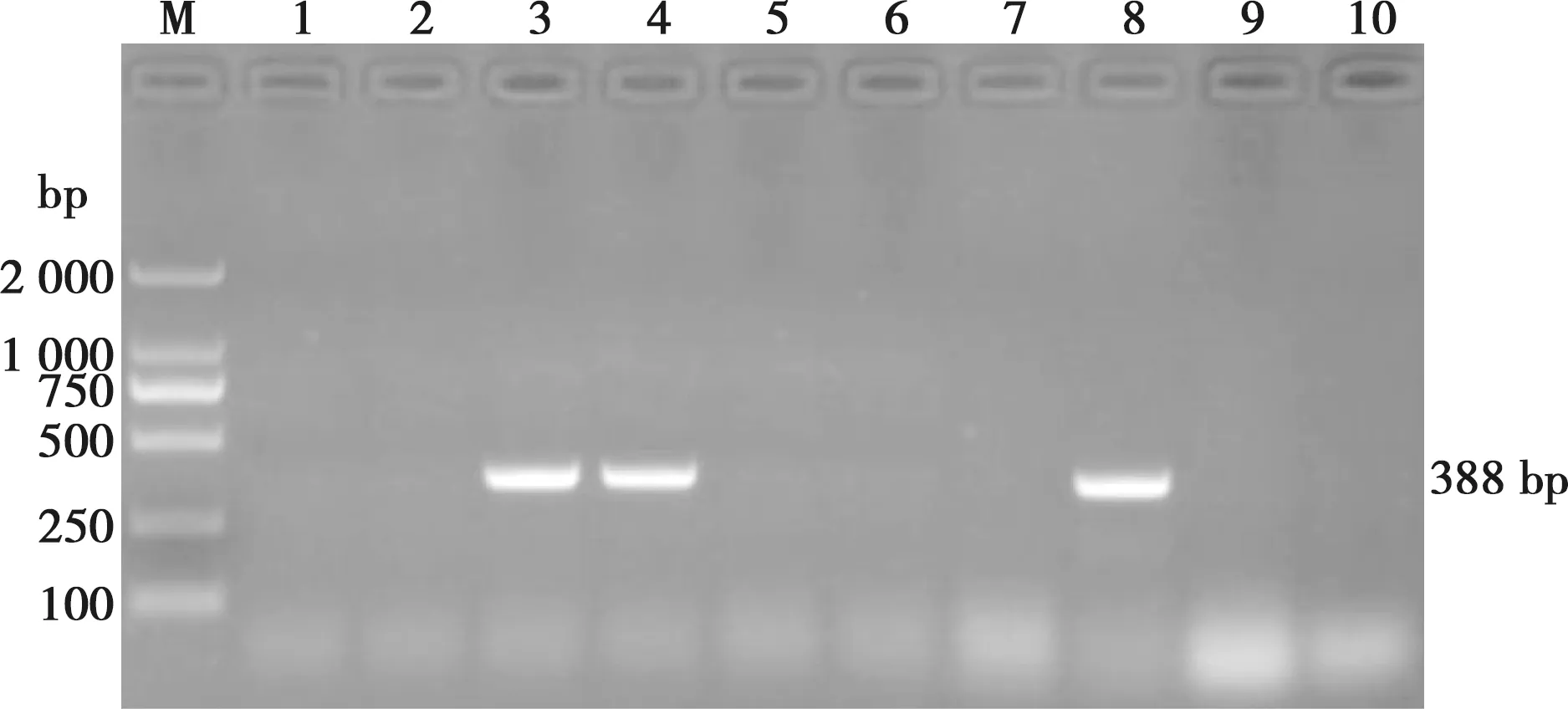
M.DL2000 Marker;1~10.临床样品
2.2 不同地区PRV流行情况分析
对不同地区猪群的PRV野毒株感染情况进行统计分析,结果如表4所示,豫西地区PRV野毒株平均阳性感染率为13.82%。其中嵩县和栾川县的阳性感染率较高,分别为21.05%和20.0%;新安县和洛宁县的阳性感染率较低,分别为7.14%和7.69%。表明豫西的不同地区均存在PRV野毒株的流行,表现散发性流行的特点。

表4 不同地区的检测结果
2.3 不同年份PRV流行情况分析
对不同年份猪群的PRV野毒株阳性感染情况进行统计分析,结果如表5所示,豫西地区PRV野毒株阳性感染率在2017年和2018年达到高峰,分别为19.05%和20.69%,2019年阳性感染率开始下降,2019年和2020年分别为12.50%和8.00%,表明这2年豫西地区PRV野毒株的流行呈现出下降趋势。

表5 不同年份的检测结果
2.4 病毒分离与细胞病变观察
21份PRV野毒株阳性病料样品分别接种单层BHK-21细胞后,有8份样品在接种48 h后出现细胞变圆变大、聚集拉网、脱落等典型CPE(图2),而其他13份样品接种的单层BHK-21细胞未出现CPE。能够引起单层BHK-21细胞发生CPE的8个分离毒株的命名情况见表6,8株分离毒株有6株来源于发病猪的脑组织样品,脑组织为PRV分离的首选病料。
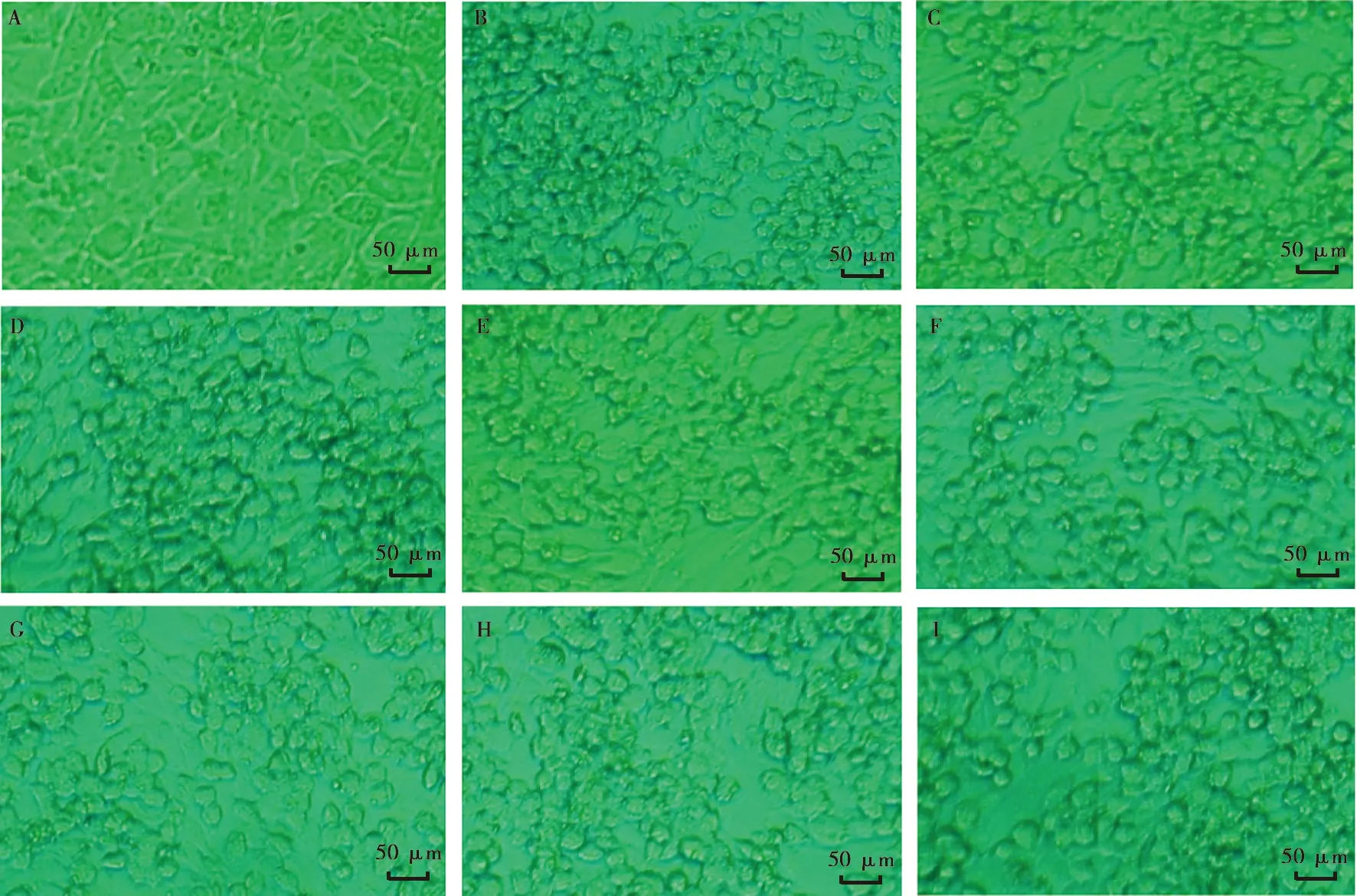
A.正常BHK-21细胞;B.RY2017;C. SX2018;D. YY2018;E. LC2019;F. LS2019;G. YS2020;H. SX2020;I. LN2020
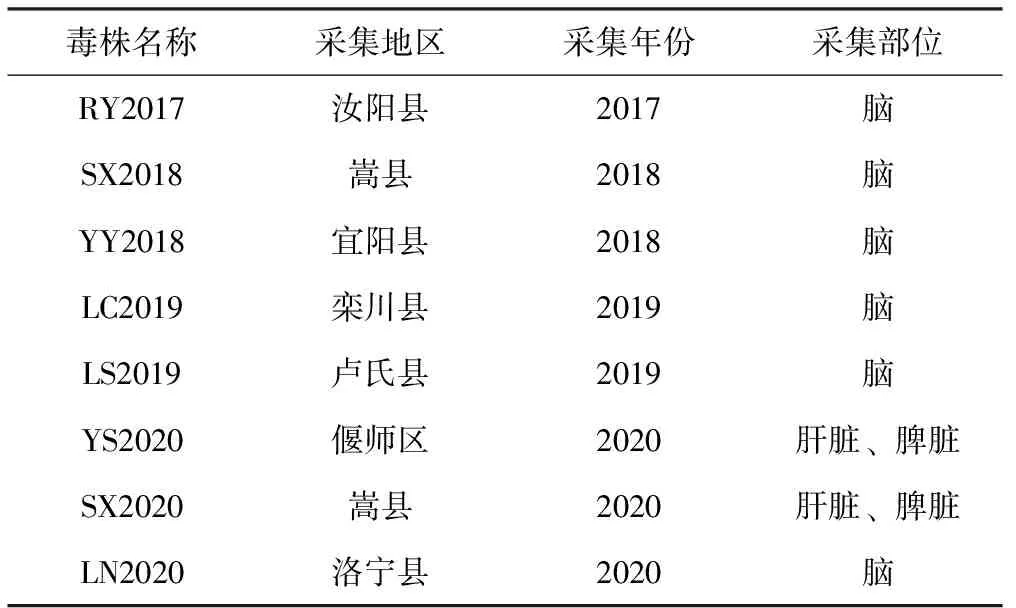
表6 分离毒株名称及来源
2.5 病毒含量测定
按照Reed-Muench法计算8个分离毒株每毫升TCID50分别为10-6.50、10-6.12、10-6.61、10-6.33、10-6.50、10-6.12、10-6.77和10-5.88。
2.6 致病性试验
8株分离毒株攻毒新西兰白兔后24 h开始出现厌食、奇痒、撕咬接种部位等典型症状,随后表现出兴奋、呼吸急促、全身阵发性痉挛,最后抽搐而死,死后身体呈现“角弓反张”姿势。至攻毒后96 h,8个分离毒株攻击的32只新西兰白兔全部死亡,剖检可见肺脏大面积出血、肝脏和脾脏淤血明显、淋巴结出血;采集死亡兔的脑、淋巴结、肝脏、脾脏等组织病料经PCR检测均为PRV野毒株阳性。对照组的4只新西兰白兔未表现出任何临床症状,精神状态、食欲等良好,至试验结束后扑杀,采集脑、肝脏、脾脏等组织进行PCR检测,结果均为PRV野毒株阴性。表明8个分离毒株对新西兰白兔均具有较高的致病性,均为高致病性毒株。
2.7 gE基因序列分析
8个分离毒株gE基因的PCR扩增结果如图3所示,PCR扩增产物在1 740 bp处均有特异性扩增条带,片段大小与预期一致。gE基因重组质粒的双酶切鉴定结果如图4所示,均在1 740 bp处有特异性条带。将8个分离毒株gE基因序列与GenBank中登录的序列进行同源性比较,结果如图5所示,8个分离毒株gE基因与GenBank中登录PRV流行毒株gE基因核苷酸序列同源性在97.4%~100%之间,其中SX2020、LN2020、YS2020毒株与GenBank中登录号为MT274422.1的同源性达100%。构建的遗传进化树如图6所示,8个分离株与国内2012年以来的PRV毒株属于一个大分支,与Kaplan株、Becker株等国外分离株亲缘关系较远,后者处于进化树的另一大分支。8个分离株与Ea株、LA株、Min-A株等经典毒株亲缘关系较远,处于进化树的不同小分支中;与HN1201株、HB-LF/2020株等国内流行的变异毒株亲缘关系较近,处于进化树的同一个小分支中。分析8个分离毒株与国外经典株Kaplan株、国内经典株Ea株差异氨基酸信息,发现8个分离株与国外经典株Kaplan株的同源性在94.82%~96.02%之间,与国内经典株Ea株的氨基酸同源性在98.10%~99.14%之间,与国内经典株Ea株氨基酸同源性较高。8个分离株、国内经典株Ea株与国外分离株Kaplan株相比,均在59位、63位、106位、122位、149位、179位、181位、215位、216位、300位、471位、473位、510位分别具有N→D、D→N、V→L、A→S、R→M、T→S、Q→L、L→A、A→D、T→A、G→R、R→H、G→S的变异,均在48位存在D氨基酸的插入。8个分离株与国内经典株Ea株、国外经典株Kaplan株相比,共同存在54位G→D、448位V→I的变异,496位存在D氨基酸的插入。gE基因核苷酸同源性比较和遗传进化分析表明8个分离毒株均为国内近几年流行的变异型PRV。

M. DL2000 Marker;1~8. 分离毒株;9. 阴性对照

M. DL2000 Marker;1~8. 分离毒株
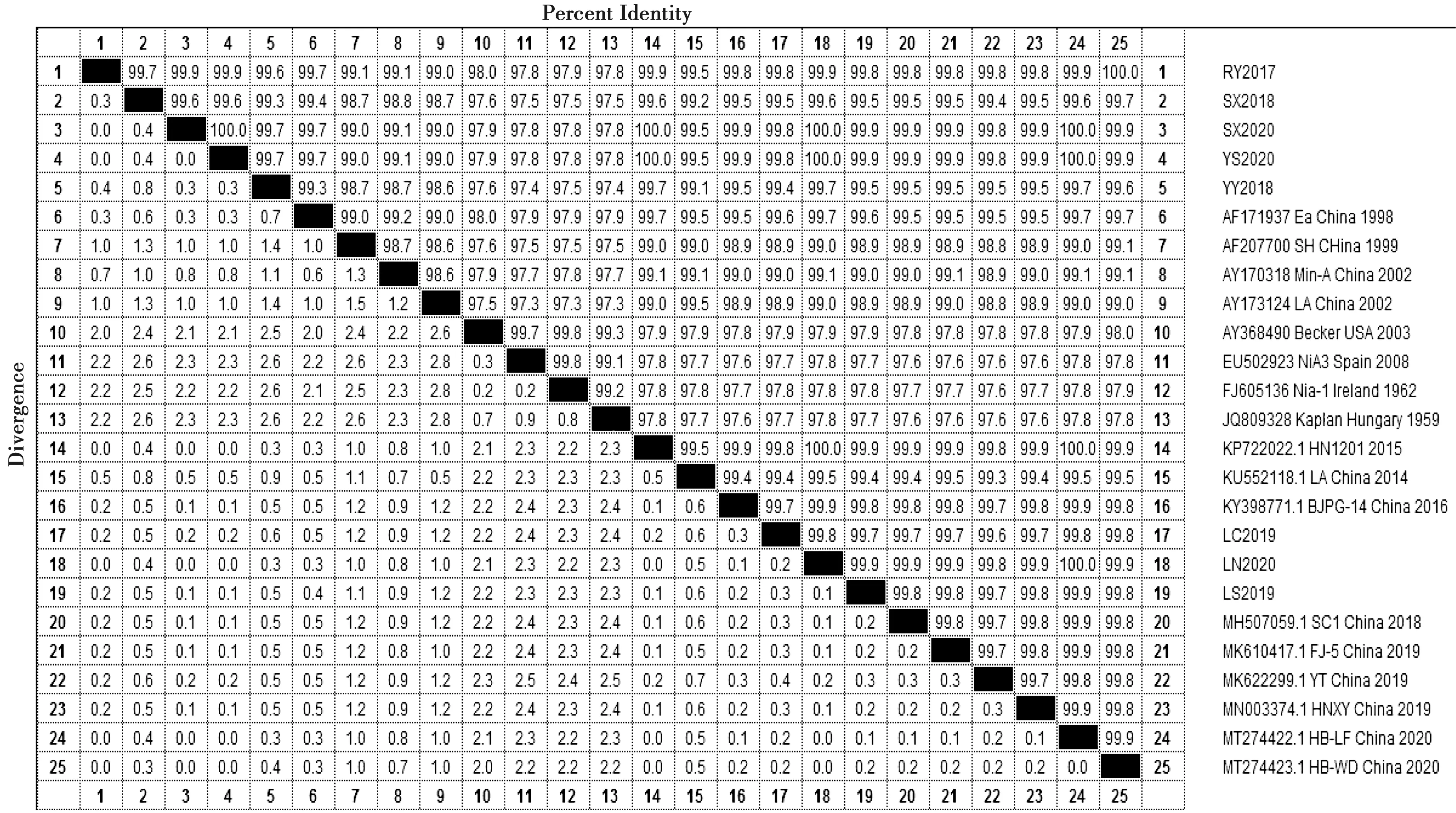
图5 分离毒株gE基因核苷酸同源性比较

注:▲为本试验分离株
3 讨论
自2011年以来,PRV变异毒株的流行导致已经免疫PR疫苗猪群发生PRV感染,我国养猪业比较发达的地区均存在不同程度的PRV野毒感染阳性率。党佳佳等[12]采用PCR方法对2017—2019年广西地区采集的284份临床病料样品进行PRV病原学检测,PRV野毒感染率为29.9%。赵硕等[13]采用PCR方法对2013—2018年广西地区采集的714份组织样品进行PRV病原学检测,PRV野毒感染率为24.5%。陈驰等[14]采用gE-ELISA抗体检测方法对2018—2019年采集于江苏、河南和江西3省111家规模猪场3 804份猪血清样品进行PRV野毒抗体检测,检测出阳性样品1 398份,PRV野毒抗体阳性率为36.75%。胡玲玲等[15]采用gE-ELISA抗体检测方法对2016—2017年采集于贵州省16个规模化猪场1 430份猪血清样品进行PRV野毒抗体检测,检测出阳性样品27份,PRV野毒抗体阳性率为1.89%。李海琴等[16]采用PCR方法对2017—2018年江西省采集的472份组织样品进行PRV病原学检测,PRV野毒阳性感染率为5.93%。本研究采用PCR方法对2016—2020年收集于豫西地区的152份临床病料样品进行PRV病原学检测,共计检测出阳性样品21份,PRV野毒平均阳性感染率为13.82%。本研究的流行病学调查结果低于党佳佳等[12]、赵硕等[13]、陈驰等[14]的流行病学调查结果,高于胡玲玲等[15]、李海琴等[16]的流行病学调查结果。说明不同地区PRV野毒株感染程度差异较大,这可能与不同地区的日常饲养管理水平和综合防控力度有关,豫西地区当前PRV的综合防控工作相对于国内其他部分地区仍具有较大的提升空间。值得注意的是,本研究发现2016—2020年期间的豫西地区PRV野毒株阳性感染率在2017年和2018年达到高峰,2019年阳性感染率开始下降,近2年(2019年和2020年)豫西地区PRV野毒株的流行呈现出大幅下降趋势,其主要原因可能有2个:一个可能是随着PRV变异毒株的危害逐步增加,规模化猪场免疫了针对变异毒株的灭活疫苗,国内首个猪伪狂犬病变异毒株灭活疫苗于2019年4月获得了中国兽医药品监察所的批签发,经调查2019年以来豫西地区规模化猪场PRV的免疫程序一般为仔猪断奶时首免猪伪狂犬病变异毒株灭活疫苗1头份,4周后加强免疫1头份,母猪产前4周加强免疫猪伪狂犬病变异毒株灭活疫苗1头份,PRV变异毒株灭活疫苗在河南地区的免疫接种有效保护了PRV变异毒株的感染;另一个可能是非洲猪瘟疫情发生后,豫西地区整体上加强了生物安全管理措施。
PRV可在BHK-21细胞系上能够稳定生长繁殖,并能够引起BHK-21细胞产生变圆变大、聚集拉网、脱落等典型细胞病变[11],故本研究利用BHK-21细胞系对21份PCR检测为PRV野毒株阳性的临床病料样品进行了病毒分离培养,结果成功分离到了8株PRV流行毒株,病毒分离率38.10%。分析病毒分离成功率比较低的原因主要有2个:一个主要原因可能是本研究收集的临床病料样品为2016—2020年的保存样品,部分样品的保存时间较长,病料样品在长期保存、运输过程中有可能导致PRV失活;另一个主要原因可能是PCR方法检测临床病料样品具有非常高的灵敏度,PCR检测为PRV野毒株阳性的病料样品有可能其病毒含量较低,无法达到能够在细胞中生长繁殖的含量要求,导致无法成功分离到病毒。
PRV对兔、鼠、犬等多种动物均易感,故可用小鼠、家兔等实验动物评价PRV的致病力和毒力。早在2001年,田晶华等[17]就曾对家兔人工感染疑似PRV感染的猪脑组织,通过观察家兔是否具有不可忍受的奇痒、撕咬等临床表现诊断PRV。崔欢等[18]、徐宁等[19]均利用家兔进行了PRV分离毒株的致病性试验,结果显示高致病性PRV分离毒株均能引起家兔出现发热、奇痒、撕咬注射部位等临床特征,且家兔于病毒感染后3~4 d内全部死亡。鉴于此,本研究参照崔欢等[18]、徐宁等[19]的方法,利用新西兰白兔作为实验动物模型分析了8个分离毒株的致病性,结果表明8个分离毒株攻击的新西兰白兔均陆续出现厌食、奇痒、撕咬接种部位、兴奋、呼吸急促、全身阵发性痉挛等临床症状,且8个分离毒株攻击的32只新西兰白兔在攻毒后96 h内全部死亡,死亡兔的组织病料经PCR检测均为PRV野毒株阳性,表明8个分离毒株对新西兰白兔均具有较高的致病性,均为高致病性毒株,本实验室下一步将选择合适的试验场地进一步分析8株分离毒株对猪的致病性。
PRV长期流行过程中,在疫苗免疫选择的压力下,临床流行毒株通过突变、缺失等多种机制不断发生变异,随着抗原变异的不断积累,出现了病毒毒力和致病力增强的变异毒株。PRV变异毒株的流行大大降低了传统疫苗的免疫效果,严伟东等[20]分析了Bartha-K61株活疫苗对PRV流行毒株的保护效力,结果表明Bartha-K61株活疫苗对传统流行毒株(PRV-Ea株)具有良好保护效果,而对变异毒株(PRV-XT株)不能提供完全保护。王玉宙等[21]评估了PRV变异毒株(HN1201株)灭活疫苗对PRV流行毒株的保护效力,结果表明HN1201株灭活疫苗对传统流行毒株(闽A株)和变异毒株(HN1201株)均可提供完全保护。故掌握不同地区不同时间的流行毒株,对不同地区选择合适疫苗采取针对性的PRV综合防控至关重要。gE基因是PRV主要毒力基因和病毒复制非必需基因,也是PRV基因缺失疫苗和野毒株鉴别诊断的标记基因,是研究分析PRV遗传变异情况的首选基因。鉴于此,本研究对8株分离毒株的gE基因进行了遗传变异分析,结果表明8株分离毒株与Kaplan株、Becker株等国外分离株亲缘关系较远,处于进化树的不同大分支。而与国内所分离毒株处于进化树的同一个大分支中,但与Ea株、LA株、Min-A株等传统流行毒株亲缘关系较远,处于进化树的不同小分支中;与HN1201株、HB-LF/2020株等国内2012年以来流行的变异毒株亲缘关系较近,处于进化树的同一个小分支中。本研究从分子水平揭示了2016—2020年豫西地区的PRV流行特征,为豫西地区PRV的综合防控提供了参考依据。
