苜蓿叶绿素合成酶(CHLG)编码基因的表达及对生物量的影响
2021-09-04刘文文蒋学乾康俊梅
孔 杰,刘文文,蒋学乾,何 飞,康俊梅,王 珍
(中国农业科学院 北京畜牧兽医研究所,北京 100193)
叶绿素是绿色植物进行光合作用的重要色素,在光能吸收、转移和光化学电荷分离等方面发挥作用,叶绿素分子受光的激发,将电子转移到NADP+并通过质子驱动合成ATP[1]。拟南芥(Arabidopsisthaliana)中叶绿素的生物合成有15种酶参与,这些酶共由27个基因编码[2]。其中,CHLG是定位于类囊体膜上的酯化酶,它催化叶绿素合成的最后一步,即由叶绿素酸酯a(chlorophyllide a, Chlide a)生成叶绿素a和由叶绿素酸酯b(chlorophyllide b, Chlide b)生成叶绿素b。该酶对形成色素蛋白复合体和稳定叶绿素结合蛋白必不可少[3]。此外,CHLG参与叶绿素生物合成途径的反馈调控,并对叶绿素结合蛋白和其他类囊体膜成分的稳定组装起重要作用[1, 4]。
叶绿素合成途径中某些酶的编码基因发生突变会引起叶绿素含量改变,引起叶色变化。水稻(Oryzasativa)中镁原卟啉IX甲基转移酶(Mg-protoporphyrin IX methyltransferase, MgPMT)催化镁原卟啉IX(Mg-protoporphyrin IX, Mg-Proto IX)生成镁原卟啉IX单甲酯(Mg-protoporphyrin IX monomethyl ester, Mg-PME),其编码基因发生突变叶片呈现黄绿表型[5]。绿色植物CHLG基因的表达水平影响叶绿素的合成,进而影响植株的叶色、生长发育和生物量。研究发现,水稻OsCHLG基因突变体ygl80中的叶绿素和类胡萝卜素含量降低,叶色黄绿,产量降低[6]。抑制烟草(Nicotianatabacum)NtCHLG基因的表达导致叶绿素含量显著降低,叶片呈淡绿色且植株发育迟缓。相反的,烟草中过表达该基因引起叶绿素含量增加[1]。苜蓿秋眠性是苜蓿的一种生长特性,它是指苜蓿在秋季光照时间变短和气温降低时所表现出来的一种综合性反应,它与苜蓿的抗寒性和生产潜力相关[7]。秋眠级低的苜蓿抗寒性强,高秋眠级的苜蓿生产潜力大,因此,秋眠性是苜蓿选育栽培的一项重要参考指标。光照和温度等环境因素影响叶绿素的合成,CHLG的表达也受到影响。探究CHLG的表达对于苜蓿产量的影响具有重要意义。
豆科植物蒺藜苜蓿因生长周期短、倍性简单、基因组小且序列已知等特点被作为模式植物应用于豆科饲草的基础研究中。本实验在对蒺藜苜蓿叶绿素合成酶的进化关系和基因结构分析的基础上,克隆并研究了蒺藜苜蓿MtCHLG对光照/黑暗、脱落酸(abscisic acid, ABA)及聚乙二醇(polyethylene glycol, PEG)的响应。同时,利用mtcao突变体确定了MtCAO与MtCHLG的上下游关系。对两种秋眠级紫花苜蓿材料的分析发现,MsCHLG表达量与株高和单株产量成正相关。本研究结果暗示CHLG可以作为培育高产豆科饲草的备选基因。
1 材料与方法
1.1 植物材料与培养
1.1.1 植物材料蒺藜苜蓿生态型R108及本氏烟草种子由本实验室保存。蒺藜苜蓿突变体种子(NF11809)购自美国诺贝研究所(Noble Research Institute)。紫花苜蓿种子来自美国国家植物种质资源数据库(The database of U.S. National Plant Germplasm System)。
1.1.2 材料培养与处理用砂纸将蒺藜苜蓿种子破除硬实后,放于浸湿的滤纸上,在4 ℃避光春化2 d后,转入人工气候培养箱。待其子叶张开后,一部分幼苗移至营养土(营养土∶蛭石=1∶1)中,放于人工气候室。另一部分R108幼苗移至1/2 Hoagland营养液(西美杰)中,每7 d更换1次营养液。烟草种子在营养土中发芽,子叶张开后单株种植,在人工气候室培养4周。培养条件为16 h光照/8 h黑暗,26 ℃/22 ℃,相对湿度为60%。紫花苜蓿于2016年种植于中国农业科学院廊坊实验基地。试验为随机完全区组设计,3个重复,每个重复包含5个单株,行距和株距均为65 cm,重复间单株间距30 cm,约10%单株处于开花期时测定株高和单株产量(第一茬)。
两月龄蒺藜苜蓿R108的根、茎、叶、花、果荚用于MtCHLG组织差异性表达分析。一月龄的蒺藜苜蓿进行以下处理:1)在光照(黑暗)生长4 h后,转入无光(连续光照)条件下2、4、8、12、24、36、48 h后收集叶片;2)ABA(100 μmol·L-1)或PEG(5%)在处理2、4、8、12、24 h后收集叶片。同时,从8点开始至次日8点,每隔4 h收集正常光照条件下的蒺藜苜蓿叶片,用于光周期分析。
1.2 方 法
1.2.1MtCHLG基因的克隆与载体构建根据EnsemblPlants数据库(https://plants.ensembl.org/index.html)中蒺藜苜蓿A17生态型MtCHLG基因序列(CDS),通过Primer Premier 5.0软件设计引物MtCHLG-F/R(表1)。按照植物总RNA提取试剂盒(Promega)说明提取蒺藜苜蓿R108的RNA,反转录为cDNA(TaKaRa),以cDNA为模板、使用ExTaq DNA聚合酶(TaKaRa)扩增目的片段。PCR产物经0.8%琼脂糖凝胶电泳,切胶回收(TransGen),连接pEASY-T5载体(TransGen),转化大肠杆菌感受态(Trans-T1,TransGen),挑取单菌落进行PCR鉴定并测序(北京天一辉远生物技术有限公司),保存序列正确的克隆(pEASY-T5-MtCHLG)。参照无缝克隆试剂盒(CloneSmarter)说明书克隆至载体pCAMBIA1302,以pEASY-T5-MtCHLG质粒为模板,两端带有接头的1302-MtCHLG-F/R为引物扩增的MtCHLG基因(表1)。使用限制性内切酶NcoⅠ和BglⅡ(QuickCut,TaKaRa)酶切pCAMBIA1302质粒,通过无缝克隆酶(50 ℃,15 min)将线性化载体和两端带有与载体同源序列的MtCHLG基因进行同源重组,转化大肠杆菌感受态并测序,获得35S∷MtCHLG-GFP融合表达载体。

表1 本试验所用引物
1.2.2 突变体基因型鉴定及基因表达分析参照植物基因组DNA试剂盒(康为世纪)说明书提取蒺藜苜蓿突变体的基因组DNA,利用Tnt1上的引物Tnt 1-F和基因特异引物qRT-MtCAO-F/R(表1)鉴定突变体。利用基因特异引物,参照TB Green®Premix Ex TaqTMⅡ(TaKaRa)进行实时荧光定量PCR(ABI 7300 Real Time PCR System)。Actin基因作加样量对照,每个样品设置3个生物学重复,通过2-ΔΔCt计算[8]表达差异量。
1.2.3 亚细胞定位参照段梅[9]的方法进行烟草转化。将含有对照、重组质粒及基因沉默抑制子P19的农杆菌液,按照1∶100的比例接种至含有抗生素(25 mg·L-1利福平,50 mg·L-1卡那霉素)的YEB液体培养基中,28 ℃振荡培养至OD600为0.8,以相同比例再次接菌培养至OD600为0.8~1.0。室温离心菌液(5 000 r/min 10 min),去除上清液后用悬浮缓冲液(10 mmol·L-1MgCl2、5 mmol·L-1MES、150 μmol·L-1乙酰丁香酮)重悬菌体到OD600为0.8~1.0,黑暗室温静置3 h后,按1∶1体积混合含目的载体和P19的菌液。通过注射器(去除针头)注射烟草下表皮,标记注射位置,培养2~3 d,使用激光共聚焦显微镜(Leica TCS SP8)进行荧光检测。
1.2.4 叶绿素的提取及含量测定将蒺藜苜蓿叶片0.1 g剪碎后置于10 mL乙醇(96%)中,黑暗条件下放置48 h使叶片完全脱色,使用超微量分光光度计分别测定在649和665 nm处的吸光值,计算叶绿素a和叶绿素b的含量[10]。
1.3 数据处理与分析
通过ExPASy(https://www.expasy.org/)预测蛋白等电点、分子量以及亲疏水性;SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白二级结构;TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白跨膜结构;TargetP-2.0(http://www.cbs.dtu.dk/services/TargetP/)预测叶绿体定位信号;Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测蛋白三级结构;MEGA7.0软件通过邻接法构建系统进化树;DNAMAN软件进行氨基酸序列比对;PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子区域(起始密码子ATG上游2 kb)的顺式作用元件。采用SPSS 26.0进行数据分析,结果以平均值±标准差表示,使用TB tools、Excel 2016等作图。通过TB tools进行相对表达量与株高和单株产量间的相关性分析。
2 结果与分析
2.1 植物CHLG的进化关系及基因结构分析
用拟南芥CHLG(At3g51820)序列搜索植物数据库EnsemblPlants(http://plants.ensembl.org/index.html),选取水生植物、低等陆生植物和高等植物中的16个代表物种,分析其CHLG的进化关系。结果显示,单细胞水生植物莱茵衣藻与低等陆生植物苔藓中的CHLG各自属于不同的分支,高等植物的CHLG属于同一个分支。其中,单子叶植物和双子叶植物的CHLG分为两个独立的亚支(图1,A)。除水生植物外,个别陆生植物中有2个CHLG蛋白,暗示植物在向陆生演变的过程中CHLG的数目有所增加。基因结构分析发现,与低等植物相比,高等植物中除拟南芥CHLG基因含14个外显子外,其余CHLG均由15个外显子组成(图1,B)。就长度来说,除首、尾两个外显子在不同物种中差异较大外,其余外显子的长度基本保持不变(表2),这可能是由于非编码区(untranslated region, UTR)的长度各异造成的。另外,高等植物CHLG的内含子明显长于低等植物(图1,B)。可见,CHLG在植物进化过程中,基因数目稍有增加,基因结构相对一致,内含子增长。该现象或许与绿色植物适应陆地上更加复杂多样的光照环境有关。

表2 代表性物种中CHLG基因的外显子长度
2.2 蒺藜苜蓿MtCHLG的克隆及该蛋白亚细胞定位分析
类似于大多数植物,蒺藜苜蓿的MtCHLG由单基因(Mt7g069210)编码(图1)。从R108中扩增到MtCHLG的CDS为1 137 bp,编码378个氨基酸。预测MtCHLG蛋白的分子量为40.82 kD,氨基酸的平均亲水系数为0.343,为疏水性蛋白质。该蛋白二级结构主要以α-螺旋(41.27%)和无规卷曲(40.74%)为主,组成5个跨膜结构域,主要集中在180~300个氨基酸之间(图2,A)。三级结构显示,跨膜螺旋间基本保持相互平行围成一个类似桶状的结构(图2,B)。高等植物CHLG中,MtCHLG与其它豆科植物CHLG的相似性较高,与紫花苜蓿和大豆CHLG的相似性分别为99.2%和93.9%;与单子叶植物CHLG的相似性相对较低,与水稻和小麦CHLG的相似性分别为84.5%和82.6%。
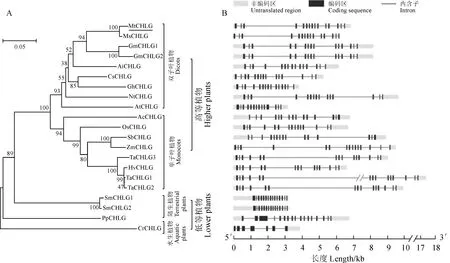
MtCHLG.蒺藜苜蓿;MsCHLG.紫花苜蓿;GmCHLG.大豆;AiCHLG.落花生;CsCHLG.黄瓜;GhCHLG.陆地棉;NtCHLG.烟草;AtCHLG.拟南芥;AcCHLG.凤梨;OsCHLG.水稻;SbCHLG.高粱;ZmCHLG.玉米;TaCHLG.小麦;HvCHLG.大麦;SmCHLG.江南卷柏;PpCHLG.小立碗藓;CrCHLG.莱茵衣藻图1 植物CHLG的进化树及其基因结构分析MtCHLG. Medicago truncatula; MsCHLG. Medicago sativa; GmCHLG. Glycine max; AiCHLG. Arachis ipaensis; CsCHLG. Cucumis sativus; GhCHLG. Gossypium hirsutum; NtCHLG. Nicotiana attenuate; AtCHLG. Arabidopsis thaliana; AcCHLG. Ananas comosus; OsCHLG. Oryza sativa; SbCHLG. Sorghum bicolor; ZmCHLG. Zea mays; TaCHLG. Triticum aestivum; HvCHLG. Hordeum vulgare; SmCHLG. Selaginella moellendorffii; PpCHLG. Physcomitrium patens; CrCHLG. Chlamydomonas reinhardtiiFig.1 Phylogenetic tree and gene structure analysis of CHLG in plants
利用TargetP2.0分析蛋白亚细胞定位情况,发现以上CHLG都含有叶绿体定位信号RAA/TE(图2,C)。为了验证MtCHLG的定位情况,分别将表达融合质粒35S∷MtCHLG-GFP或对照质粒35S∷GFP的农杆菌在烟草叶片中瞬时表达。荧光显微镜观察发现,对照蛋白在烟草表皮细胞的细胞膜、细胞核以及叶绿体中均有绿色荧光信号。重组蛋白MtCHLG-GFP主要在烟草表皮细胞的叶绿体中有绿色信号(图3),表明MtCHLG是一个叶绿体定位蛋白。该结果与MtCHLG参与叶绿素合成相吻合。

A. MtCHLG跨膜结构预测;B. MtCHLG三级结构预测;C. 高等植物CHLG氨基酸序列保守性分析:MtCHLG.蒺藜苜蓿;MsCHLG.紫花苜蓿;GmCHLG.大豆;NtCHLG.烟草;ZmCHLG.玉米; AtCHLG.拟南芥;OsCHLG.水稻;TaCHLG.小麦。星号表示叶绿体定位信号,方框表示保守基序,横线表示跨膜结构域(Ⅰ—Ⅴ)图2 MtCHLG的生物信息学分析A. Prediction of the transmembrane structure of MtCHLG; B. Prediction of the tertiary structure of MtCHLG; C. Sequence alignment of CHLGs in the indicated higher plants. MtCHLG. Medicago truncatula; MsCHLG. Medicago sativa; GmCHLG. Glycine max; NtCHLG. Nicotiana attenuate; ZmCHLG. Zea mays; AtCHLG. Arabidopsis thaliana; OsCHLG. Oryza sativa; TaCHLG. Triticum aestivum. Homology was highlighted by shading in color: dark bule for 100%, pink for 75%, and light blue for 50%. The asterisks indicate the predicted peptides for chloroplast localization, the conserved motifs were boxed, and the five transmembrane domains (Ⅰ-Ⅴ) were indicated by linesFig.2 Bioinformatic analysis of MtCHLG

图3 MtCHLG-GFP融合蛋白在烟草中的亚细胞定位Fig.3 Subcellular localization of the MtCHLG-GFP recombinant protein in Nicotiana benthamiana
2.3 MtCHLG的表达模式分析
利用qRT-PCR对蒺藜苜蓿根、茎、叶、花和果荚中MtCHLG的表达量分析显示,该基因在所检测的组织中均有表达。其中,幼嫩叶片中表达量最高(图4,A)。在24 h内,MtCHLG的表达呈现出黑暗中下降,光照后逐渐升高的趋势(图4,B)。以上结果表明,MtCHLG主要在幼嫩绿色组织中表达,且表达水平受昼夜节律的影响。
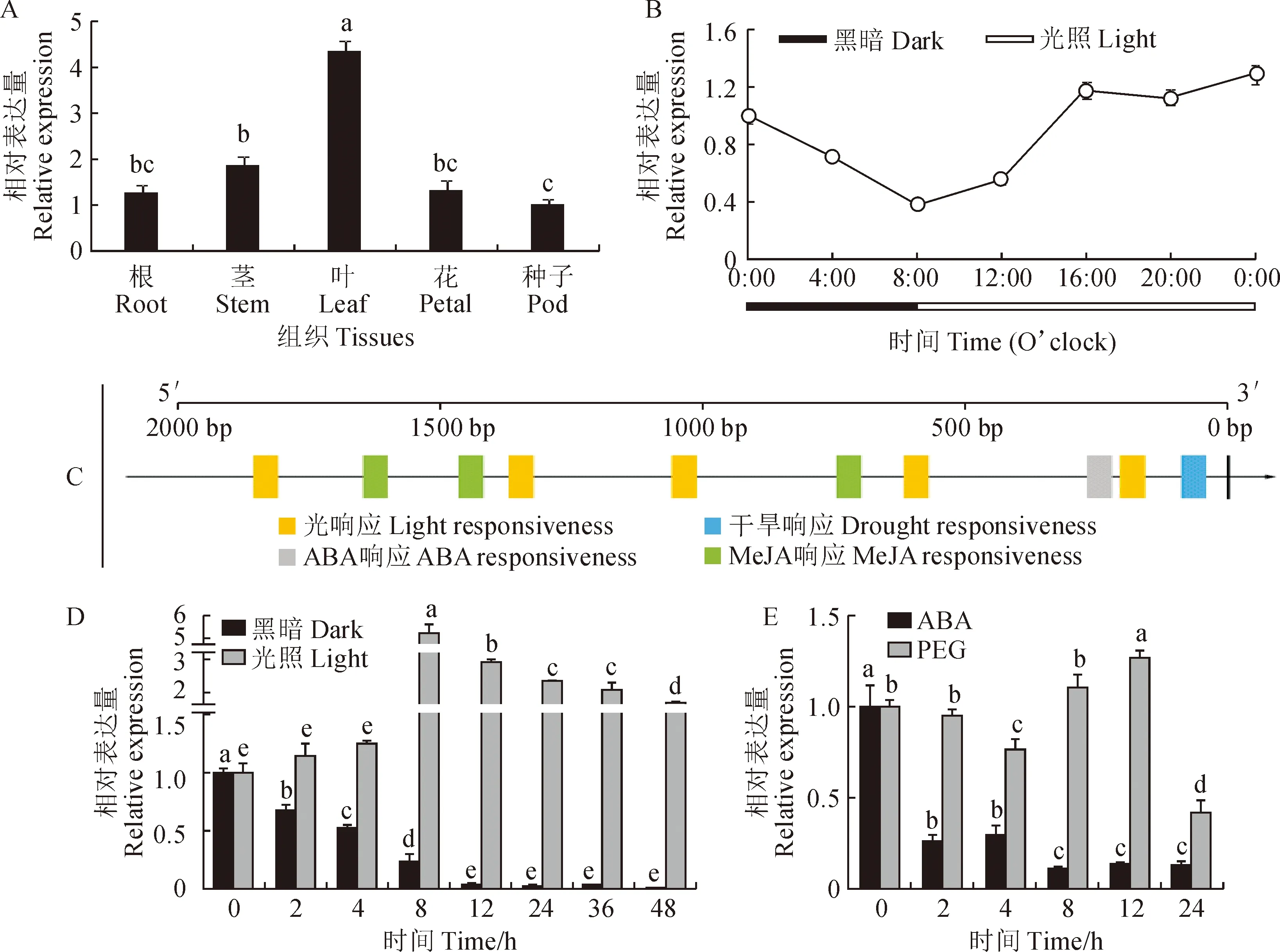
A. MtCHLG组织表达分析;B. 叶片中MtCHLG的昼夜表达模式;C. MtCHLG 启动子区域的顺式作用元件预测;D. 光照/黑暗处理下叶片中MtCHLG的表达分析;E. 脱落酸/聚乙二醇处理下叶片中MtCHLG的表达分析。标准差来自3个生物学重复,同一处理间不同小写字母代表差异显著(P<0.05)图4 蒺藜苜蓿MtCHLG的表达分析A. Expression of MtCHLG in the indicated tissues of Medicago truncatula; B. Expression of MtCHLG during 24 h; C. Prediction of the cis-acting elements in the promoter (2 kb) of MtCHLG; D. Expression of MtCHLG in leaves under light or darkness; E. Expression of MtCHLG in leaves by ABA or PEG treatment. Bars represent mean ± SD of the three biological replicates and different letters in lowercase between the same treatment indicate significant difference (P<0.05)Fig.4 The expression profile of MtCHLG
通过PlantCARE对MtCHLG启动子(2 kb)区域顺式作用元件的预测分析显示,该区域含有光响应元件,如GATA、GT1、GTGGC和TCT等,以及ABA响应、茉莉酸甲酯(methyl jasmonate, MeJA)响应和干旱响应等顺式作用元件(图4,C)。对黑暗处理后蒺藜苜蓿中MtCHLG的表达量检测发现,处理2 h其相对表达量降低了33%(P<0.05),随着黑暗处理的延长,MtCHLG的表达急剧下降,在12 h降为对照的3.4%;处理2 d之内其表达量基本维持在该水平(图4,D)。可见,黑暗处理抑制MtCHLG的表达。相反的,在光照处理下,MtCHLG表达量缓慢增加,8 h时达到顶峰(约为对照的5.23倍,P<0.05);光照时间延长到12 h时表达量为对照的2.90倍;光处理24~48 h间,表达水平维持在对照的1.66~2.32倍(图4,D)。因此,MtCHLG的表达受光诱导。另外,ABA(100 μmol·L-1)处理2 h,MtCHLG急速降低为对照的26%(P<0.05),此后缓慢下降,24 h内维持在处理前的13%(图4,E)。即,ABA处理快速降低MtCHLG的表达水平。在用PEG(5%)处理模拟干旱试验中,MtCHLG表达量缓慢减少后又稍有回升,处理12 h时约为对照的1.26倍;增加处理时间至24 h,其表达量降低到对照的42%(图4,E)。由此,PEG处理影响MtCHLG的表达,24 h连续处理有显著的抑制作用。
2.4 MtCHLG与叶绿素酸酯a加氧酶基因(MtCAO)的关系
研究表明植物CHLG能分别催化叶绿素酸酯a和叶绿素酸酯b生成叶绿素a和叶绿素b[11-12]。该反应是叶绿素生物合成的最后一步(图5,A)。对蒺藜苜蓿叶绿素酸酯a加氧酶基因突变体mtcao(NF11809)进行基因型鉴定发现,Tnt1反向插入Mt1g030480(MtCAO)的第二个外显子(图5,B、C),且为纯合突变体。该突变体植株矮小,叶色发黄(图5,D)。与野生型相比,突变体在转录水平上几乎检测不到MtCAO的表达(图5,E),说明该纯合体为MtCAO功能缺失突变体。叶绿素含量测定结果显示,突变体叶片中叶绿素a及叶绿素b分别降低43%和97%(图5,F),导致其叶绿素a/b的比值升为野生型的12倍左右(30.29 vs 2.56)(图5,G)。定量分析发现,该突变体中MtCHLG的表达量约为野生型的44.4%(图5,H)。以上结果表明,在叶绿素生物合成途径中MtCHLG位于MtCAO的下游。

A. 叶绿素生物合成途径简要示意图[2];B. 突变体MtCAO基因结构及Tnt1插入位点示意图;C. 突变体基因型PCR鉴定;D. 两月龄野生型蒺藜苜蓿(WT)和突变体(mtcao)植株;E. MtCAO的表达分析;F. 叶片中叶绿素含量比较;G. 野生型蒺藜苜蓿(WT)和突变体(mtcao)叶绿素a/b比值比较;H. 野生型蒺藜苜蓿(WT)和突变体(mtcao)MtCHLG的表达分析。E-H中不同小写字母代表差异显著(P<0.05)图5 蒺藜苜蓿MtCHLG 在叶绿素生物合成途径中位于MtCAO基因的下游A. Brief schematic diagram of the chlorophyll biosynthesis pathway showing the steps of the three rate-limiting enzymes and CHLG; B. Schematic diagram of MtCAO gene structure and Tnt1 insertion site of mtcao; C. Genotyping of the mtcao mutant; D. Image of two-month-old wild type and mtcao; E. Expression of MtCAO by RT-qPCR; F. Comparison of Chlorophyll content in the two genotypes; G. Comparison of chlorophyll a/b between wild type and mutant; H. Comparison of expression of MtCHLG by RT-qPCR between wild type and mutant. Bars represent the mean ± SD of three biological replicates and different letters in lowercase in E to H indicate significant difference (P<0.05)Fig.5 MtCHLG is downstream of MtCAO in chlorophyll biosynthesis pathway
2.5 紫花苜蓿MsCHLG的表达水平与株高正相关
先前的研究表明多数叶绿素合成基因表达水平影响植物地上生物量[13-14]。目前,蒺藜苜蓿是基因组序列已知、基因功能注释较完整,且与豆科饲草紫花苜蓿亲缘关系最近的模式植物。序列同源性分析表明,紫花苜蓿MsCHLG与MtCHLG的氨基酸序列高度相似(99.2%)。对随机选取的两种秋眠级(FD4和FD8)的紫花苜蓿材料(各5份)测定株高,结果显示,高秋眠级材料的株高约为低秋眠级材料的2.5~3.5倍。同时,高秋眠级材料的平均产量约为低秋眠级材料的2.1倍(P<0.05,表3)。对紫花苜蓿叶片中MsCHLG的表达量分析发现,该基因在高秋眠级紫花苜蓿中的转录水平略高于低秋眠级材料(1.2~1.5倍,表3)。相关性分析显示,MsCHLG的表达量与株高和产量的相关系数分别为0.68(P<0.05)和0.72(P<0.05)(表4),表明该基因的转录水平与株高和产量均成正相关。以上结果暗示,叶绿素合成酶基因MsCHLG的表达量或许可以作为苜蓿产量早期预测的参考指标。
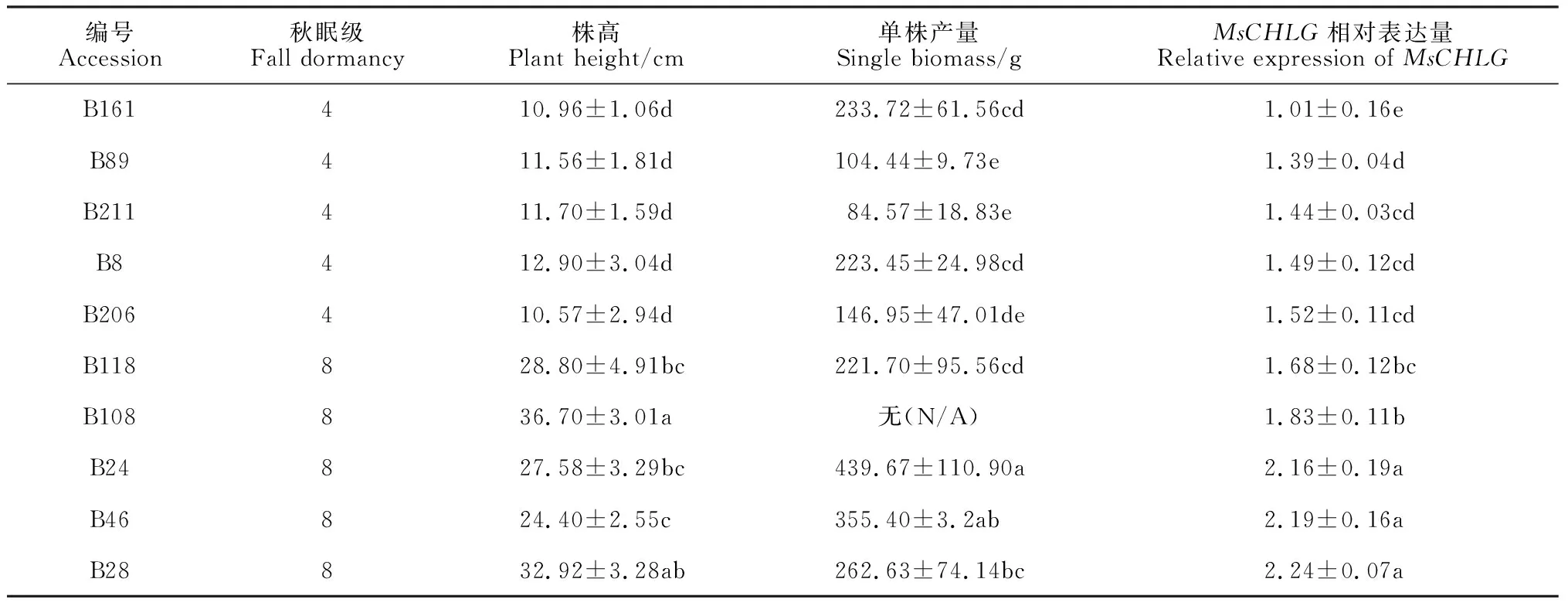
表3 紫花苜蓿两种秋眠级材料的株高、单株产量和MsCHLG的相对表达量分析

表4 MsCHLG相对表达量与株高和单株产量间的相关性分析
3 讨 论
高等植物叶绿素的合成是由15种酶催化完成的[2]。其中,叶绿素合成酶CHLG负责叶绿素生物合成的最后一步,即催化叶绿素酸酯a和叶绿素酸酯b分别生成叶绿素a和叶绿素b[15-16]。缺失该基因的植物通常表现为叶色浅绿或黄化[1, 4]。同时,叶绿素含量降低在一定程度上能抑制叶绿体发育,降低光合效率,导致植株生长迟缓甚至死亡[17]。本研究克隆并初步分析了蒺藜苜蓿叶绿素合成酶基因(MtCHLG)的表达模式、蛋白的亚细胞定位及该基因与MtCAO的上下游关系,发现紫花苜蓿同源基因MsCHLG的表达量与株高和产量成正相关,暗示CHLG可作为培育高产豆科饲草的备选基因。
植物CHLG属于UbiA超家族[18],基因结构和蛋白功能域相对保守。就进化关系来说,低等植物与高等植物的CHLG相对较远,二者基因的外显子/内含子组成稍有差异。绝大部分的CHLG由单基因编码,且高等植物CHLG具有更长的内含子。推测植物进化过程中CHLG基因数目稍有增加及其内含子明显加长的现象可能与高等植物逐渐适应陆地复杂多样的光照条件有关。
MtCHLG主要在绿色组织中表达且受光照等因素的影响。植物在接收到光照信号后,参与光信号的转录因子通过结合叶绿素合成基因启动子上的光响应元件调控下游靶基因的表达[19]。MtCHLG基因的启动子区域含有多个光响应元件,且定量分析发现该基因受光照诱导和黑暗抑制。这种昼增夜降的趋势与大多数叶绿素合成基因的昼夜节律类似,如烟草谷氨酰-tRNA还原酶(Glutamyl-tRNA reductase, GluTR)编码基因HEMA及拟南芥Mg-螯合酶(Magnesium chelatase, MgCH)I、D、H亚基基因(CHLI,CHLD和CHLH)的表达都具有昼夜节律[20-21]。延长光照处理MtCHLG表达量呈现先升高后降低的趋势,这与番茄幼苗中叶绿素a和b的含量随光照时间增加先增多后减少一致,说明适当增加光照时间有助于光合色素的合成,而光照时间过长会使植株产生光抑制的现象[22]。这可能是由于植物的光反应中心接收和储存的光子数饱和后多余的光子无法进行光合作用[23]。另外,ABA(100 μmol·L-1)对MtCHLG的表达有抑制作用。类似的,荔枝(Litchichinensis)果皮中叶绿素合成基因的表达受外源ABA抑制,该处理同时促进了某些叶绿素降解基因的表达[24],加速了叶绿素降解。PEG模拟的干旱处理蒺藜苜蓿24 h,MtCHLG表达水平约降低了一半。先前实验发现,在干旱胁迫下,白刺(Nitrariatangutorum)叶片中NtCHLG表达量下降,叶绿素a和叶绿素b的合成减少[25]。
MtCHLG是MtCAO的下游基因,且紫花苜蓿中CHLG的表达水平与株高和产量成正相关关系。MtCAO是叶绿素生物合成的最后一个限速酶,催化叶绿素酸酯a转化为叶绿素酸酯b[26]。mtcao突变体叶绿素b含量显著减少,主要是由于叶绿素b合成的前体叶绿素酸酯b生成受阻。该突变体中MtCHLG的表达量显著降低,表明MtCHLG位于MtCAO下游。MtCHLG既是叶绿素a又是叶绿素b合成的催化酶[15-16],还同时参与叶绿素生物合成途径的反馈调控[1]。生产中,植物叶绿素含量低通常表现为植物生长迟缓,植株矮小,生物量低[17]。豆科饲草紫花苜蓿的MsCHLG与MtCHLG蛋白高度同源(99.2%)。高、低两种秋眠级(FD4和FD8)的紫花苜蓿材料在株高、单株产量和叶片中MsCHLG的表达水平上都存在显著差异。而且,株高和单株产量与MsCHLG的表达水平显著正相关。本实验的产量数据来自第一茬,后续有待对不同茬次株高、生物量与MsCHLG表达量的相关性进行分析。
叶绿素合成酶是叶绿素a和叶绿素b生物合成的催化酶。本文通过对绿色植物中CHLG的进化关系和基因结构分析证明了CHLG是一类结构和功能域保守的基因。豆科模式植物蒺藜苜蓿中,MtCHLG-GFP融合蛋白主要定位在叶绿体。RNA水平上,MtCHLG在绿色组织中高丰度表达,且表达水平受光照诱导和黑暗抑制。叶绿素酸酯a 加氧酶(MtCAO)的功能缺失导致MtCHLG转录水平约减少了一半,表明MtCHLG位于MtCAO的下游。另外,紫花苜蓿MsCHLG的表达水平与株高和单株产量显著正相关,暗示CHLG可以作为培育高产豆科饲草的备选基因。后期将利用基因编辑技术创制MtCHLG敲除蒺藜苜蓿突变体,分析其叶绿素含量及植株生物量,确定MtCHLG的生物学功能。
